Lewis肺癌细胞TLR4对Foxp3表达的调控
2012-02-05张英林盖晓东付海英
历 春 杨 巍 张英林 盖晓东 李 一 付海英
(吉林大学白求恩医学院免疫学系,长春130021)
Lewis肺癌细胞TLR4对Foxp3表达的调控
历 春①杨 巍 张英林 盖晓东①李 一 付海英
(吉林大学白求恩医学院免疫学系,长春130021)
目的:探讨小鼠Lewis肺癌(Lewis lung cancer,LLC)细胞中TLR4对Foxp3表达的调控作用。方法:选择LPS为配体活化TLR4,采用RT-PCR方法检测LPS在不同浓度(0,1,10 μg/ml)和不同时间点(12,24,36,48小时)Foxp3 mRNA的表达量的变化,流式细胞术检测有效浓度LPS 10 μg/ml和最佳作用时间点24小时Foxp3蛋白和TLR4蛋白表达量的变化,RT-PCR和流式细胞术检测anti-TLR4/MD2抗体阻断TLR4后再用LPS刺激LLC细胞Foxp3表达量的变化。结果:LPS在10 μg/ml浓度作用LLC细胞后可显著上调Foxp3 mRNA的表达量,与未刺激组相比差异显著(P <0.05);LPS最佳作用时间为24小时;LPS在10 μg/ml浓度作用LLC细胞24小时后可显著上调Foxp3蛋白和TLR4蛋白的表达量,与对照组相比差异显著(P <0.05);阻断TLR4后再用LPS刺激LLC细胞,Foxp3的表达量较未阻断组明显降低(P <0.05)。结论:LLC细胞TLR4蛋白参与对Foxp3的表达调控,TLR4可能是Foxp3的上游信号分子。
叉头蛋白3;Lewis肺癌;Toll样受体4;脂多糖
叉头蛋白3(Forkhead box protein 3,Foxp3)是叉头/翼状螺旋转录因子家族中的一个成员,是CD4+CD25+调节性 T细胞(regulatory T cells,Tregs)特异的分子标记[1]。研究证实,肿瘤微环境中Foxp3作为Tregs发育和行使功能的决定因素,抑制局部免疫应答,促进肿瘤的免疫逃逸[2-4]。最近研究发现Foxp3在肿瘤细胞也有表达[5-8],本课题组已报道小鼠lewis肺癌细胞表达Foxp3,而且Foxp3可模拟Tregs发挥免疫抑制作用参与肺癌细胞的免疫逃逸[9],但肺癌细胞 Foxp3的表达调控机制尚不明确。TLR4是Toll样受体家族(Toll like receptors,TLRs)重要成员之一,最初发现于免疫细胞,通过识别某些外源性或内源性配体引发信号转导,在天然免疫和获得性免疫中发挥重要作用[10,11]。近年来研究发现 TLR4在很多肿瘤细胞系和肿瘤组织中也有表达,肿瘤细胞通过TLR4信号通路释放炎性细胞因子和免疫抑制因子诱导免疫微环境的免疫耐受,从而促进肿瘤的免疫逃逸[12-14]。有文献报道TLR4与Tregs关系密切,LPS活化TLR4后可增强Tregs的生存、增殖和抑制功能[15,16],因此我们推测 TLR4 可能参与对肺癌细胞Foxp3的表达调控。
为了探讨TLR4对肺癌细胞Foxp3表达的调控作用,本研究以小鼠Lewis肺腺癌(Lewis lung cancer,LLC)细胞为研究对象,选用LPS活化TLR4和anti-TLR4/MD2抗体阻断 TLR4,检测活化和阻断TLR4对 Foxp3表达量的影响,以探讨肺癌细胞Foxp3表达的调控机制。
1 材料与方法
1.1 细胞株及细胞培养 LLC细胞系为本实验室保存,贴壁生长在含10%新鲜小牛血清的DMEM培养液中,于37℃、5%CO2孵箱培养。
1.2 试剂 MMLV反转录酶和Ex Taq DNA聚合酶购自TaKaRa公司;Anti-mouseTLR4/MD2抗体(MTS510)购自eBioscience公司;兔抗鼠Foxp3及TLR4多克隆抗体购自武汉博士得生物公司,FITC标记的山羊抗兔IgG购自北京中杉金桥生物公司。1.3 RT-PCR检测目的基因表达 Trizol试剂提取细胞总RNA,逆转录成cDNA,以cDNA为模板,PCR仪扩增目的基因片段。Foxp3引物为:上游:5′-CAG CTG CCT ACA GTG CCC CTA G-3′;下游:5′-CAT TTG CCA GCA GTG GGT AG-3′。扩增条件:预变性94℃ 2分钟,(变性94℃ 30秒,退火60℃ 30秒,延伸72℃ 1分钟),共进行35个循环,最后72℃延伸10分钟。扩增产物为382 bp。内参β-actin引物为:上游:5′-TGG AAT CCT GTG GCA TCC ATG AAA C-3′;下游 5′-TAA AAC GCA GCT CAG TAA CAG TCC G-3′。扩增条件:预变性94℃ 2分钟,(变性94℃ 30秒,退火 52℃ 30秒,延伸 72℃ 1分钟),共进行25个循环,最后72℃延伸10分钟。扩增产物为320 bp。引物由上海生工有限公司合成。所有实验均重复3次。
1.4 流式细胞术检测 采用间接免疫荧光法检测:收集细胞,调整细胞浓度为1×106ml-1;PBS洗涤细胞1次,1 500 r/min离心5分钟,弃上清液;加入4%多聚甲醛200 μl固定细胞,4℃孵育20分钟; 1 500 r/min离心5分钟,弃上清液。PBS清洗后离心,弃上清;用破膜剂稀释兔抗鼠Foxp3多克隆抗体(1∶100)或 PBS稀释兔抗鼠 TLR4多克隆抗体(1∶100),4℃孵育 40分钟;1 500 r/min离心 5 分钟,弃上清液。再用PBS洗涤细胞1次,1 500 r/min离心5分钟,弃上清液;加入FITC标记的山羊抗兔IgG(稀释浓度1∶100),4℃避光染色30分钟;1 500 r/min离心5分钟,弃上清液。用PBS清洗后离心,弃上清;加0.5 ml PBS重悬细胞后上流式细胞仪检测细胞内平均荧光强度(MFI),所有实验均重复3次。
1.5 统计学分析 采用SPSS12.0统计软件进行数据统计,实验数据采用±s表示,样本均数比较采用多因素方差分析,P <0.05有统计学意义。
2 结果
2.1 不同浓度LPS刺激LLC细胞24小时 Foxp3 mRNA表达量的变化 首先采用RT-PCR方法检测不同浓度 LPS(0、1、10 μg/ml)作用 LLC 细胞 24 小时后Foxp3 mRNA表达量的变化。结果显示在1 μg/ml和 10 μg/ml的 LPS 作用下,Foxp3 mRNA 表达量均有上调,但以10 μg/ml的LPS最为显著,与未刺激组比较有统计学意义(P <0.05),见图1。2.2 不同时间点LPS刺激LLC细胞Foxp3 mRNA表达量的变化 进一步采用RT-PCR方法取有效浓度10 μg/ml的LPS作用LLC细胞,检测不同时间点(12、24、36、48 小时)Foxp3 mRNA 表达量的变化。结果显示在不同时间点Foxp3 mRNA的表达量均有上调,但以24小时时间点Foxp3 mRNA表达量最高(P <0.05),见图2。结果表明LPS活化LLC细胞
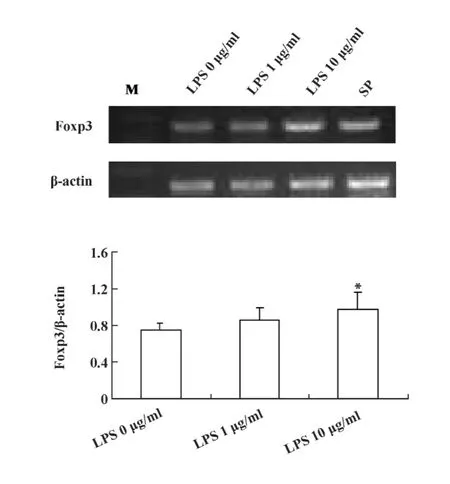
图1 不同浓度LPS作用LLC细胞Foxp3 mRNA表达量的变化Fig.1 The mRNA level of Foxp3 after LPS treatment at different concentration in LLC cells by RT-PCR
TLR4后Foxp3表达上调的最佳作用时间为24小时。
2.3 LPS刺激LLC细胞Foxp3蛋白表达量的变化为进一步验证TLR4对Foxp3的表达调控作用,采用流式细胞术选用有效浓度10 μg/ml和最佳作用时间24小时检测LPS刺激LLC细胞后Foxp3在蛋白水平的表达变化。结果显示,LPS刺激组Foxp3的MFI(5.11 ±0.56)较未刺激组 MFI(3.67± 0.42)显著增强,差异有统计学意义(P < 0.05),见图3。此结果进一步证实了LLC细胞TLR4活化后可诱导Foxp3的表达。
2.4 LPS刺激LLC细胞TLR4蛋白表达量的变化TLR4蛋白是LPS信号向胞内传导的门户蛋白。因此,采用流式细胞术检测不同浓度 LPS(0、1、10 μg/ml)刺激LLC细胞24小时时间点TLR4蛋白量的表达变化。结果显示,随着 LPS浓度的增加,TLR4蛋白的表达量也随之增强,以LPS 10 μg/ml最为显著,与LPS活化TLR4后Foxp3的表达有一致性。LPS 10 μg/ml组 TLR4 的 MFI(12.9 ±1.62)较 LPS 0 μg/ml组 MFI(9.8 ±1.25)显著增强,差异有统计学意义(P <0.05),见图4。结果表明,LPS活化LLC细胞TLR4后TLR4蛋白表达上调。
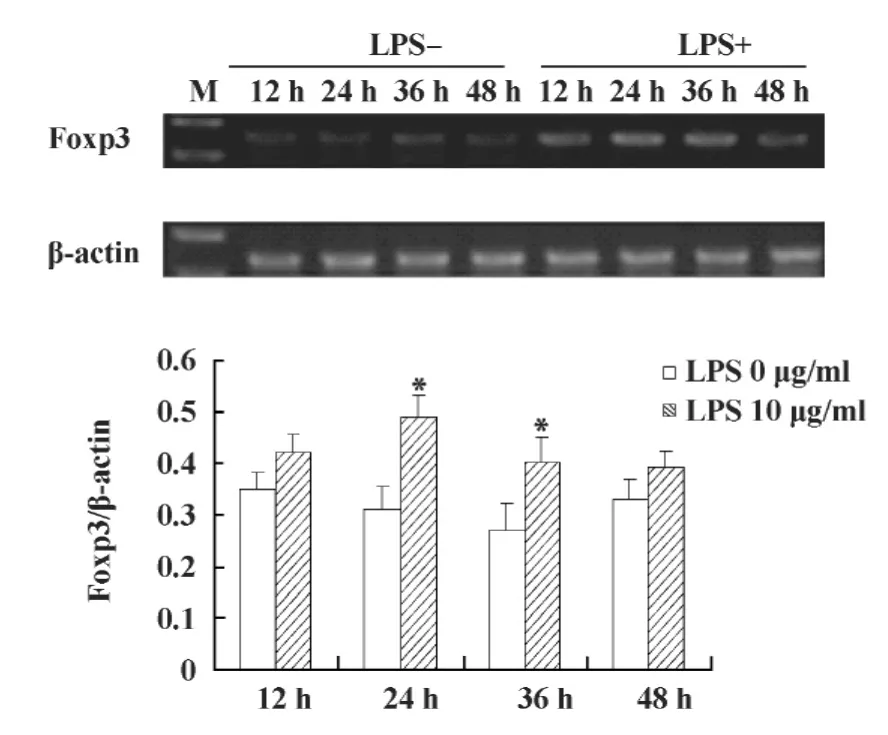
图2 不同时间LPS作用LLC细胞Foxp3 mRNA表达量的变化Fig.2 The mRNA level of Foxp3 after LPS treatment at different time in LLC cells by RTPCR
2.5 阻断TLR4后LLC细胞Foxp3 mRNA表达量的变化 前面研究显示LPS活化TLR4后可诱导Foxp3的表达,为进一步验证TLR4对Foxp3表达的调控作用,我们先用20 μg/ml的anti-TLR4/MD2抗体阻断 TLR4,再用10 μg/ml LPS刺激 LLC细胞,RT-PCR方法检测Foxp3 mRNA表达量的变化。结果显示阻断组Foxp3 mRNA的表达量较未阻断组明显降低,差异有统计学意义(P <0.05),见图5,表明阻断TLR4后可抑制Foxp3的表达上调。
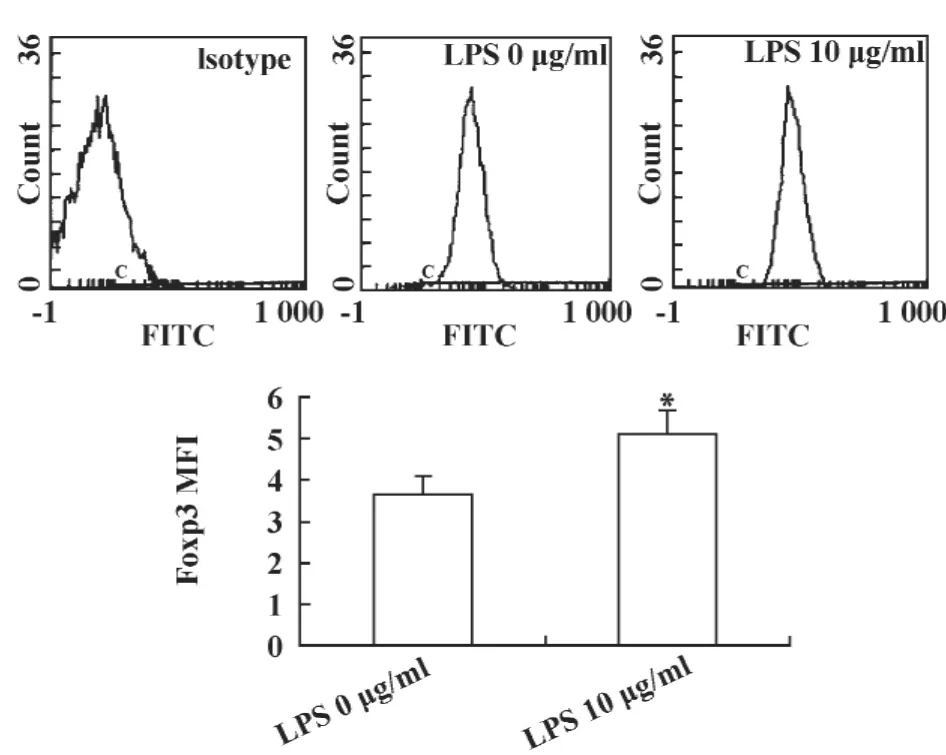
图3 LPS作用下LLC细胞Foxp3蛋白表达量的变化Fig.3 The protein level of Foxp3 after LPS treatment in LLC cells by FCM
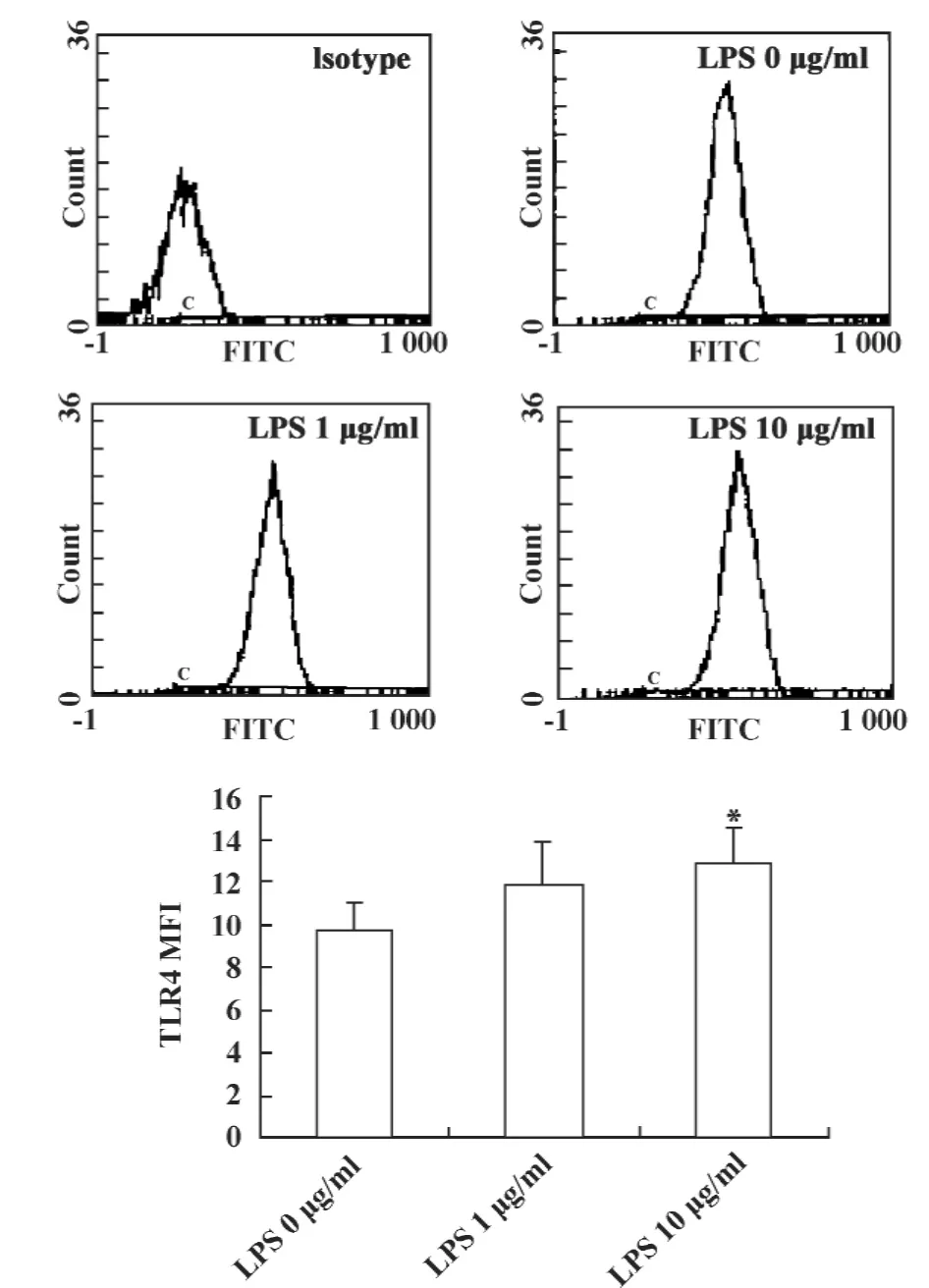
图4 LPS刺激LLC细胞后TLR4蛋白表达量的变化Fig.4 The protein level of TLR4 after LPS treatment in LLC cells by FCM
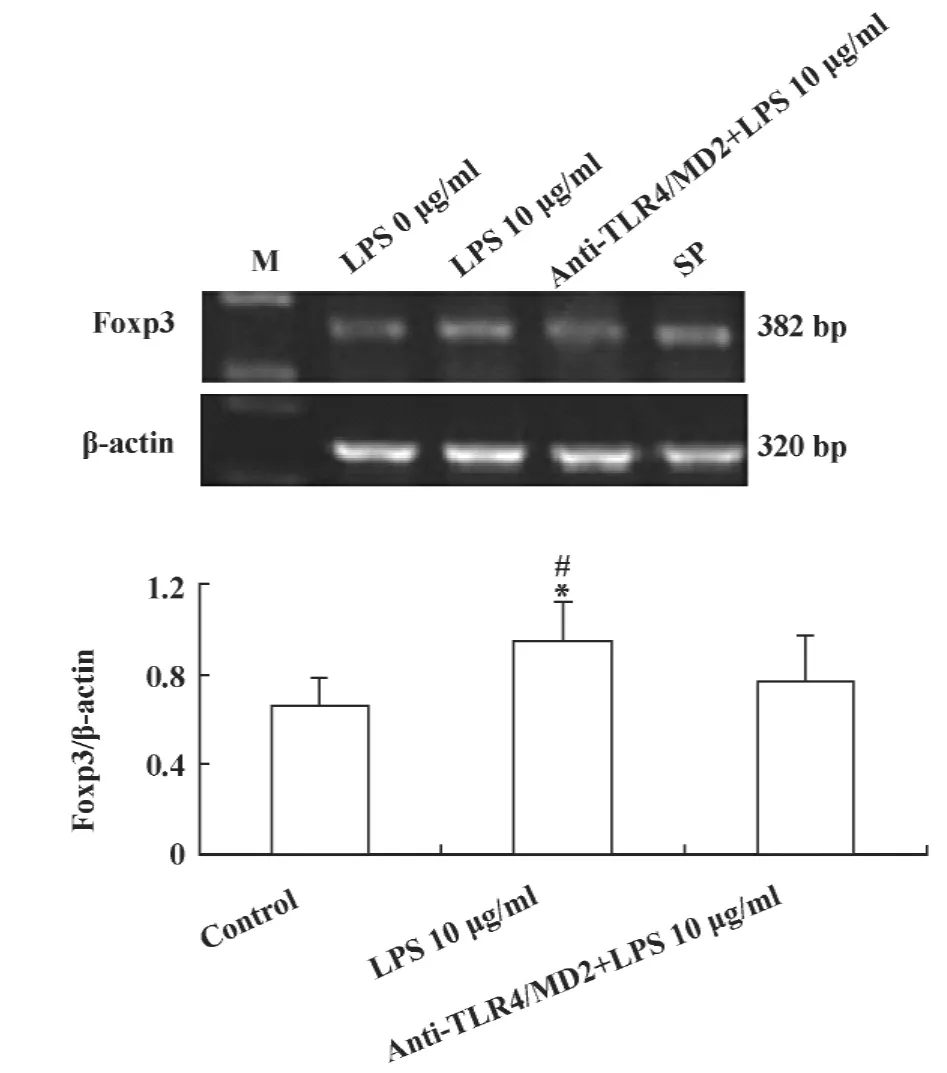
图5 阻断TLR4后对Foxp3 mRNA表达量的影响Fig.5 The mRNA level of Foxp3 after TLR4 blockade in LLC cells by RT-PCR
2.6 阻断TLR4后LLC细胞Foxp3蛋白表达量的变化 为进一步验证阻断LLC细胞TLR4后Foxp3在蛋白水平的表达变化,先用 20 μg/ml的 anti-TLR4/MD2 抗体阻断 TLR4,再用 10 μg/ml LPS 刺激LLC细胞,采用流式细胞术检测Foxp3蛋白量的变化。结果显示,阻断组 Foxp3的 MFI(1.75± 0.19)较未阻断组 MFI(2.04 ±0.23)明显降低,差异有统计学意义(P <0.05),与其mRNA检测的结果相符,见图6。此结果进一步证实TLR4参与对Foxp3的表达调控。
3 讨论

图6 阻断TLR4后对Foxp3蛋白表达量的影响Fig.6 The protein level of Foxp3 after TLR4 blockade in LLC cells by FCM
Foxp3是Tregs特异的标志物及细胞发育和功能的关键调节基因[1]。Tregs与肿瘤的发生发展密切相关,通过发挥免疫抑制作用促进肿瘤的免疫逃逸[2-4]。最近研究发现Foxp3在肿瘤细胞也有表达,在肿瘤的发生发展中也发挥重要的作用[5-9],但肿瘤细胞Foxp3的表达调控机制尚不明确。近年来研究发现,肿瘤细胞表面表达的TLR4与肿瘤的发生发展密切相关[17-19]。TLR4通过识别某些外源性及内源性配体引发信号转导,诱导肿瘤细胞生成大量的免疫抑制性因子诱导肿瘤微环境的免疫耐受促进肿瘤的免疫逃逸[12-14]。此外,TLR4与Tregs有着密切的联系[15,16]。LPS 刺激 TLR4 后可诱导 Tregs的活化,增强Tregs细胞的生存和增殖。更重要的是LPS刺激后,Tregs的抑制效率提高了10倍,表明TLR4活化后可增强Tregs的抑制功能[15]。另有研究表明,在LPS单独作用下,Tregs中Foxp3表达无明显变化,但在LPS和IL-2共同作用后,Tregs中Foxp3的表达较IL-2单独作用显著上调,Tregs的免疫抑制功能也相应增强,而且阻断TLR4下游NF-κB途径抑制了Foxp3的表达上调,表明TLR4可能间接参与Tregs中Foxp3的表达调控[16]。
结合以上文献报道,我们推测TLR4可能参与对肺癌细胞Foxp3的表达调控。为证实此推测,首先检测LPS活化LLC细胞TLR4后Foxp3的表达情况,结果显示LPS刺激LLC细胞后Foxp3表达在基因和蛋白水平均显著上调,初步表明 LLC细胞TLR4活化后可诱导Foxp3的表达。TLR4蛋白是LPS信号向胞内传导的门户蛋白,为进一步探讨TLR4蛋白在LPS诱导LLC细胞Foxp3表达中的作用,我们检测了LPS刺激LLC细胞后TLR4蛋白的表达情况。实验结果显示TLR4蛋白的表达在LPS刺激LLC细胞后明显上调,与LPS诱导Foxp3的表达上调有一致性,提示LPS活化TLR4后TLR4蛋白是功能性表达上调。
虽然TLR4是识别LPS的关键受体,但TLR4必需有 MD-2 协助才能识别 LPS[20,21],TLR4 与 MD-2相互作用形成复合物TLR4/MD2将LPS信号传递入细胞内,激活下游途径从而引起炎症因子的大量释放。因此为进一步验证TLR4对Foxp3的表达调控,先用anti-TLR4/MD2抗体阻断LLC细胞TLR4,再用LPS刺激,观察Foxp3的表达变化。结果显示阻断TLR4后Foxp3的表达较未阻断组明显降低,进一步证实了TLR4对Foxp3的表达调控作用。本研究中LLC细胞TLR4对Foxp3的表达调控不同于Tregs,Tregs在LPS单独作用下Foxp3表达无明显变化,但在LPS和IL-2共同作用下,Tregs中Foxp3表达明显上调[16],而我们的研究显示在LPS单独作用LLC细胞后Foxp3表达明显上调,表明TLR4可直接调控LLC细胞Foxp3的表达,TLR4可能是Foxp3的上游信号分子。
综合以上结果,肺癌细胞TLR4在LPS刺激活化后TLR4蛋白表达上调,进一步通过诱导Foxp3的表达促进肿瘤的免疫逃逸。TLR4下游信号通路包括MyD88依赖性和非依赖两条途径,而其对肺癌细胞Foxp3的调控作用具体是通过哪条途径还需进一步的深入研究。
1 Fontenot J D,Rasmussen J P,Williams L M et al.Regulatory T cell lineage specification by the forkhead transcription factor Foxp3[J].Immunity,2005;22:329-341.
2 Li B,Samanta A,Song X et al.FOXP3 ensembles in T-cell regulation[J].Immunol Rev,2006;212:99-113.
3 Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003;299: 1057-1061.
4 Woo E Y,Yeh H,Chu C S et al.Cutting edge:Regulatory T cells from lung cancer patients directly inhibit autologous T cell proliferation[J].J Immunol,2002;168(9):4272-4276.
5 Hinz S,Pagerols-Raluy L,Oberg H H et al.Foxp3 expression in pancreatic carcinoma cells as a novel mechanism of immune evasion in cancer[J].Cancer Res,2007;67:8344-8350.
6 Zuo T,Liu R,Zhang H et al.FOXP3 is a novel transcriptional repressor for the breast cancer oncogene SΚP2 [J].J Clin Invest, 2007;117:3765-3773.
7 Merlo A,Casalini P,Carcangiu M L et al.FOXP3 expression and overall survival in breast cancer[J].J Clin Oncol,2009;27:1746-1752.
8 Wang L H,Su L,Wang J T.Correlation between elevated FOXP3 expression and increased lymph node metastasis of gastric cancer[J].Chinese Med J,2010;123:3545-3549.
9 历 春,盖晓东,贾 婷et al.小鼠Lewis肺癌细胞Foxp3的表达对T淋巴细胞增殖的影响及机制[J].中国免疫学杂志,2010; 26(11):986-991.
10 O’Neill L A.When signaling pathways collide:positive and negative regulation of toll-like receptor signal transduction [J].Immunity,2008;29(1):12-20.
11 Kawai T,Akira S.The role of pattern recognition receptors in innate immunity:Update on Toll like receptors[J].Nat Immunol,2010; 11(5):373-384.
12 Huang B,Zhao J,Li H et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005;65 (12):5009-5014.
13 Goto Y,Arigami T,Kitago M et al.Activation of Toll-like receptors 2,3,and 4 on human melanoma cells induces inflammatory factors[J].Mol Cancer Ther,2008;7(11):3642-3653.
14 He W,Liu Q,Wang L et al.TLR4 signaling promotes immune escape of human lung cancer cells by inducing immunosuppressive cytokines and apoptosis resistance[J].Molecular Immunology,2007; 44(11):2850-2859.
15 Caramalho I,Lopes-Carvalho T,Ostler D et al.Regulatory T cells selectively express toll-like receptors and are activated by lipopolysaccharide[J].J Exp Med,2003;197(4):403-411.
16 Milkova L,Voelcker V,Forstreuter I et al.The NF-kappaB signalling pathway is involved in the LPS/IL-2-induced upregulation of FoxP3 expression in human CD4+CD25highregulatory T cells[J].Exp Dermatol,2010;19(1):29-37.
17 Schmausser B,Andrulis M,Endrich S et al.Toll-like receptors TLR4,TLR5 and TLR9 on gastric carcinoma cells:an implication for interaction with Helicobacter pylori[J].Int J Med Microbiol,2005;295(3):179-185.
18 Wang E L,Qian Z R,Nakasono M et al.High expression of Tolllike receptor 4/myeloid differentiation factor 88 signals correlates with poor prognosis in colorectal cancer[J].Br J Cancer,2010; 102(5):908-915.
19 Zhang J J,Wu HS,Wang L et al.Expression and significance of TLR4 and HIF-1α in pancreatic ductal adenocarcinom[J].World J Gastroenterol,2010;16(23):2881-2888.
20 Huber M,Kalis C,Keck S et al.R-form LPS,the master key to the activation of TLR4/MD-2-positive cells[J].Eur J Immunol,2006; 36(3):701-711.
21 Shimura H,Nitahara A,Ito A et al.Up-regulation of cell surface Toll-like receptor 4-MD2 expression on dendritic epidermal T cells after the emigration from epidermis during cutaneous inflammation[J].J Dermatol Sci,2005;37(2):101-110.
[收稿2012-04-26 修回2012-05-04]
(编辑 倪 鹏)
Regulation of Foxp3 expression by TLR4 in Lewis lung cancer cells
LI Chun,YANG Wei,ZHANG Ying-Lin,GAI Xiao-Dong,LI Yi,FU Hai-Ying.Department of Immunology,Norman Bethune College of Medicine,Jilin University,Changchun 130021,China
Objective:To investigate whether the expression of Foxp3 in Lewis lung cancer(LLC)cells could be regulated by TLR4 activation.MethodsLipopolysaccharide(LPS)was employed as exogenous ligands to activate TLR4.The mRNA level of Foxp3 was detected by RT-PCR at different time points(12,24,36,48 h)upon LPS stimulation(0,1,10 μg/ml).The protein level of Foxp3 and TLR4 was detected by FCM at 24 h time point upon 10 μg/ml LPS stimulation.Foxp3 mRNA and protein were detected by RTPCR and FCM respectively after LPS activation following blockade of TLR4 by anti-TLR4/MD2 antibody.ResultsThe mRNA level of Foxp3 was significantly increased by 10 μg/ml LPS stimulation at 24 hours(P < 0.05).The protein level of Foxp3 and TLR4 were significantly up-regulated at 24 h time point upon 10 μg/ml LPS stimulation(P < 0.05).The expression of Foxp3 protein was significantly decreased in LLC cells with TLR4 blockade followed by LPS stimulation than that of without TLR4 blocking ones(P < 0.05).ConclusionThese results indicate that TLR4 could be involved in the regulation of Foxp3 expression in LLC cells and TLR4 might be the upstream signaling molecules of Foxp3.
Foxp3;Lewis lung cancer;Toll like receptor 4;Lipopolysaccharide
R730.3
A
1000-484X(2012)08-0701-05
10.3969/j.issn.1000-484X.2012.08.006
①北华大学基础医学院免疫教研室,吉林132013
历 春(1972年-),女,吉林大学白求恩医学院免疫学博士,讲师,主要从事肿瘤免疫研究,E-mail:lichunjl@126.com;
及指导教师:付海英(1977年-),女,博士,讲师,主要从事免疫耐受研究,E-mail:fuhaiying612@yahoo.com.cn;
李 一(1961年-),女,教授,博士生导师,主要从事免疫耐受研究,E-mail:yilili19@yahoo.com.cn。
·肿瘤免疫学·
