TLR4活化对肝癌细胞H7402生物学特征的影响①
2012-02-05张誉艺山东大学药学院免疫药理与免疫治疗学研究所济南250012
张誉艺 屈 静 张 建 (山东大学药学院免疫药理与免疫治疗学研究所,济南250012)
TLR4活化对肝癌细胞H7402生物学特征的影响①
张誉艺 屈 静 张 建 (山东大学药学院免疫药理与免疫治疗学研究所,济南250012)
目的:分析TLR4在肝癌细胞H7402的表达水平,研究其活化对肿瘤细胞生物学功能、炎症应答以及对化疗药物治疗的影响。方法:RT-PCR方法检测肝癌细胞TLR4基因、细胞凋亡和细胞周期相关基因的表达水平。LPS作用于肝癌细胞后,利用MTT法检测细胞增殖,AnnexinV/PI双染法检测细胞凋亡,荧光定量PCR法检测肿瘤相关细胞因子的表达水平,流式细胞术检测肿瘤细胞表面淋巴细胞受体的配体及CyclinD1表达,Western blot检测Bcl-xl表达水平。结果:TLR4在人肝癌细胞系HepG2、H7402、PLC/PRF/5中都有表达,LPS能促进肝癌细胞系的增殖,抵抗顺铂的抗肿瘤作用。进一步的机制研究表明,LPS能上调肝癌细胞周期相关分子CyclinD1、凋亡相关分子Bcl-xl的表达,并下调Fas的表达、上调肿瘤相关的炎症因子的表达。结论:LPS诱导肝癌细胞H7402表达炎症因子、促进肿瘤细胞的增殖,导致肿瘤细胞对化疗药顺铂产生抵抗作用。
肝癌;TLR4;顺铂;增殖;炎症因子
Toll样受体(Toll like receptor,TLR)是一种模式识别受体,主要表达在免疫细胞上,特别是抗原递呈细胞,包括B细胞、巨噬细胞、树突状细胞等[1]。近些年来人们发现,TLRs也表达在一些非免疫细胞上,其中包括肿瘤细胞,例如肝癌、胃癌、结肠癌等[2-4],表达在肿瘤细胞上的TLRs与肿瘤的发生发展密切相关。研究表明,TLR激动剂在激活免疫系统的同时对肿瘤细胞也起着一定的作用。某些TLR激动剂能够抑制肿瘤生长,例如,用鞭毛蛋白活化乳腺癌细胞的TLR5后能够抑制细胞增殖从而抑制肿瘤的生长[5];但是,也有很多TLR激动剂对肿瘤的发生发展有一定的促进作用,例如,人头颈部鳞癌细胞系上的TLR4被激活后能够促进肿瘤的发展,并保护肿瘤细胞逃逸免疫攻击[6]。另外,表达在肿瘤细胞的TLRs被激活后,肿瘤细胞通过分泌免疫抑制因子抑制抗原递呈细胞的功能,并分泌促炎因子诱导慢性炎症;同时通过诱导抗凋亡蛋白表达,对化疗药产生抗药性,促进肿瘤细胞自身的生长[7]。因此,TLR激动剂被称为“双刃剑”。研究TLR激动剂对肿瘤的直接作用,对于TLR激动剂的应用具有很重要的意义。
肝癌是最常见的恶性肿瘤之一,在中国每年肝癌死亡人数达160万人,由肝癌引起的死亡率位居第三,对人类健康和生存产生了巨大的威胁,因此急需寻找有效的治疗方式。目前,由于肝癌的恶性程度高,手术切除率低,预后极差,药物治疗是主要的姑息治疗手段。TLR4在肝癌细胞上表达水平、其活化对肿瘤细胞生物学功能的改变以及对化疗药物的治疗是否产生影响,是本文主要探究的问题。
1 材料与方法
1.1 材料
1.1.1 细胞 人肝癌细胞系HepG2、H7402、PLC/ PRF/5均购自中国科学研究院(上海,中国),并在本实验室保存。
1.1.2 试剂 RPMI1640购于Gibco公司;胰酶购自上海生工生物工程有限公司;新生牛血清购自杭州四季青公司;MTT、LPS购于Sigma公司;DMSO购于上海生工生物工程技术服务有限公司;Trizol、MMLV逆转录酶试剂盒购自美国 Invitrogen公司; SYRB Green Mix购自日本TOYOBO公司;Easy Taq DNA Polymerase购自TRANSGEN公司;流式抗体MICA/B、ULBP2、ULBP4、CD54、Fas、CyclinD1 等抗体购自美国BD公司;Western blot抗体Bcl-xl购自Bioworld公司;三氯甲烷、异丙醇、无水乙醇等其他试剂为国产分析纯,引物由北京华大基因有限公司合成。
1.2 方法
1.2.1 细胞培养及细胞干预 细胞系 HepG2、H7402、PLC/PRF/5以含有10%新生牛血清的RPMI1640培养基培养于37℃、5%CO2的条件下。将细胞接种于12孔板中,待细胞贴壁后,换取无血清培养基使其饥饿12小时,再换取有血清培养基并加入10 μg/ml LPS刺激6~24小时,然后进行下一步检测。
1.2.2 细胞增殖实验 用MTT比色法检测细胞增殖。将0.5×104个肝癌细胞接种于96孔板,用不同浓度的LPS刺激24小时,终止培养前每孔加入20 μl MTT(10 mg/ml)继续培养4小时,以2 500 r/min的转速离心20分钟,弃去上清,每孔加入200 μl DMSO混匀,使甲瓒颗粒溶解。用酶标仪(Bio-Rad,Hercules,CA,USA)在570/630 nm的波长下测其吸光度。
1.2.3 顺铂对LPS处理的肿瘤细胞的作用 将H7402细胞接种于96孔板,每孔0.5 ×104个,100 μl,待细胞贴壁后,每孔加入 100 μl(20 μg/ml)的LPS,使其作用的终浓度达到10 μg/ml,同时设培养基对照组,待其作用12小时后,加入5~20 μg/ml顺铂,继续作用48小时,MTT比色法检测各组细胞增殖情况。
1.2.4 AnnexinV/PI双染法检测细胞凋亡 将1× 105个H7402细胞接种于12孔板,以10 μg/ml浓度的LPS作用12小时,加入10 μg/ml顺铂,继续作用10小时;各组收集细胞,1 000 r/min离心5分钟;用预冷的PBS洗一遍,弃去上清;用200 μl结合缓冲液将细胞重悬,每管加2 μl Annexin-V/FITC室温避光孵育15分钟,再加入5 μl 20 μg/ml PI溶液室温避光孵育5分钟;上机检测。
1.2.5 RT-PCR Trizol法提取细胞总 RNA,方法参照Trizol说明书。将总RNA逆转录成cDNA并参照之前的方法进行PCR[8]。将PCR获得的产物进行2%琼脂糖凝胶电泳,用AlphaEaseFC仪拍照并进行光密度分析。PCR所用到的引物的序列及产物大小见表1。
1.2.6 荧光定量 PCR 炎症相关基因 TNF-α、IL-6、IL-8、VEGF、免疫抑制因子 TGF-β 的表达情况采用荧光定量PCR的方法检测。该方法使用SYBR Green Master Mix染色,iCycleriQ real-time PCR仪进行检测。所用到的引物序列见表2。
1.2.7 流式细胞术检测细胞表面分子表达 收集细胞,1×PBS清洗一遍。200 μl PBS重悬细胞,混匀,加入1 μl抗体,阴性对照管加入IgG,室温避光孵育1小时。1×PBS清洗一遍,200 μl PBS重悬细胞,上机检测。
1.2.8 Western blot检测Bcl-xl表达 收集细胞加入蛋白裂解液提取总蛋白,BSA法绘制蛋白浓度标准曲线,测定提取的蛋白浓度。按照30 μg蛋白/泳道上样,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,电转移90分钟至PVDF滤膜,5%脱脂奶粉封闭3小时;加入兔源抗Bcl-xl一抗(1∶500),37℃孵育2小时;TBST漂洗3次,加羊抗兔二抗(1∶2 000),37℃孵育1小时;TBST漂洗3次,每次10分钟;化化学发光法显色后用Bio-Rad成像系统成像。

表1 PCR扩增所用的引物及其序列Tab.1 The primer sequences used for the PCR amplification
1.3 统计学方法 两组数据间比较采用成对t检验。P <0.05认为有显著性差异。
2 结果
2.1 TLR4在肝癌细胞中的表达 通常TLR表达在免疫细胞,例如巨噬细胞和树突状细胞,然而TLR在其他种类的细胞中也可能发挥作用。为了研究
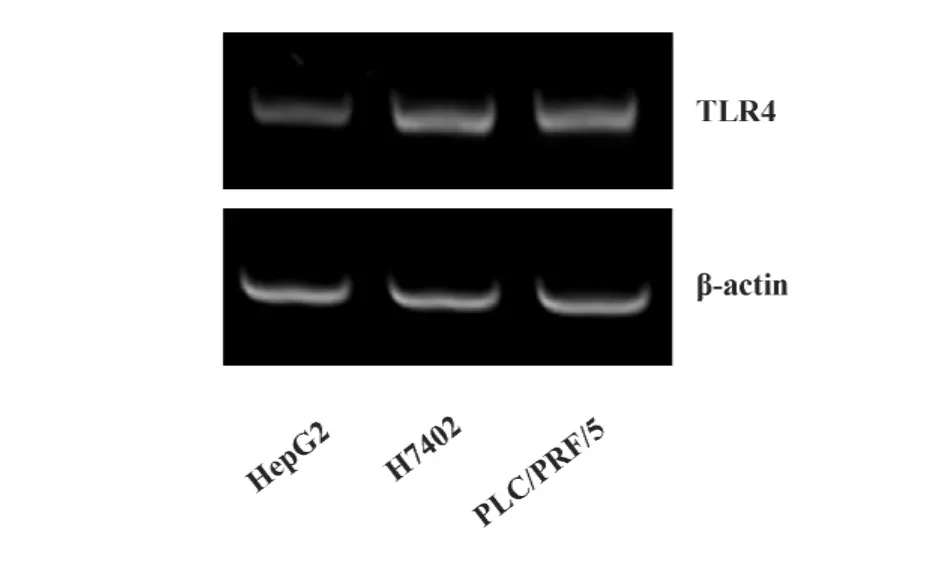
图1 TLR4在肝癌细胞中的表达Fig.1 The expression of TLR4 on hepatocellular carcinoma cells

图2 LPS对肝癌细胞的促增殖作用Fig.2 LPS promoted the proliferation of hepatocellular carcinoma cells
TLR4在肝癌细胞中的表达情况,我们采用RT-PCT的方法检测肝癌细胞系HepG2、H7402、PLC/PRF/5中TLR4的基因表达水平。图1显示,所检测的三种肝癌细胞均有TLR4基因表达。
2.2 TLR4激动剂LPS能肝癌细胞增殖 为了研究TLR4活化后对肝癌细胞的影响,我们选用了TLR4激动剂LPS。首先,用MTT比色法检测LPS对肝癌细胞增殖的影响。将不同浓度的(0.312 5~20 μg/ml)LPS加入到肝癌细胞中作用24小时,检测吸光度计算增殖率。如图2所示,LPS对肝癌细胞HepG2及H7402都有显著的促增殖作用,其中对H7402细胞的促增殖作用更为显著,当LPS剂量为20 μg/ml时,其增殖率达到 122.43%。
2.3 TLR4活化对顺铂抗肝癌效应的影响 顺铂通过诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖。为了阐明肝癌细胞TLR4的活化对顺铂的治疗作用是否有影响,我们首先用10 μg/ml的LPS预刺激肝癌细胞系H7402 12小时,再加入5~20 μg/ml的顺铂作用48小时,MTT比色法检测细胞的增殖水平。图3A显示,经LPS预刺激的细胞再加入顺铂,其OD值要高于顺铂单独作用组。进一步用AnnexinV/PI双染法在H7402细胞中检测到LPS预处理能削弱顺铂诱导细胞凋亡的作用(图3B),顺铂诱导细胞早期凋亡率下降了近50%,说明LPS能抵抗顺铂诱导的细胞凋亡作用。
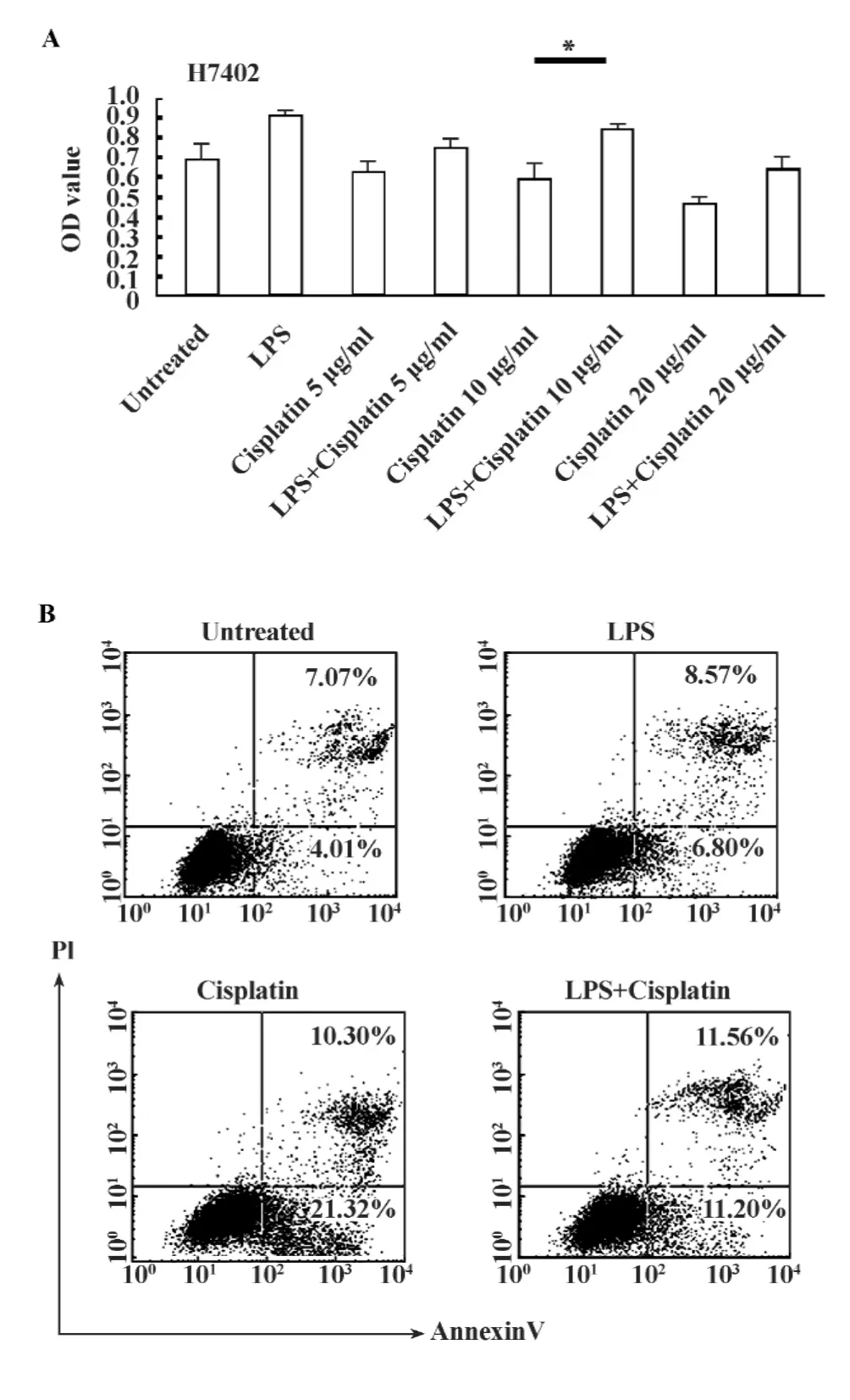
图3 LPS对顺铂诱导的肝癌细胞增殖抑制的影响Fig.3 The influence of LPS on Cisplatin induced the proliferation inhibition of hepatocellular carcinoma cells
2.4 LPS对肿瘤细胞周期、凋亡相关基因的调节为了研究LPS促进肝癌细胞增殖的机制,我们利用RT-PCR的方法检测LPS刺激后周期相关分子CyclinE1、CyclinD1、C-myc 及凋亡相关分子 Bcl-xl、Mcl-1的表达。图4A显示,H7402细胞经LPS刺激后,CyclinD1、Bcl-xl的表达水平显著上调,CyclinE1、C-myc、Mcl-1没有明显变化;进一步用流式细胞术和Western blot方法分别验证了CyclinD1、Bcl-xl的蛋白表达水平也在LPS作用后上调(图4B)。
2.5 LPS对肿瘤细胞炎症相关基因的调节 在肿瘤微环境中,炎症因子能够促进肿瘤的发生发展;免疫抑制细胞因子则抑制免疫细胞的功能,从而促进肿瘤的发展。为了研究LPS作用于肝癌细胞后对炎症因子的表达是否有影响,我们采用荧光定量PCR的方法检测H7402细胞经LPS刺激12小时后TNF-α、IL-6、IL-8、VEGF、TGF-β 的表达水平。图 5显示,LPS作用于 H7402 细胞后,TNF-α、IL-6、IL-8、VEGF等炎症相关基因的表达相对于对照组均有所上调,免疫抑制因子TGF-β的表达也有所上调。与对照组相比,上述基因的表达上调倍数分别为1.434、1.322、3.949、2.249 以及 1.506 倍。图 5 是三次以上平行实验的统计结果。
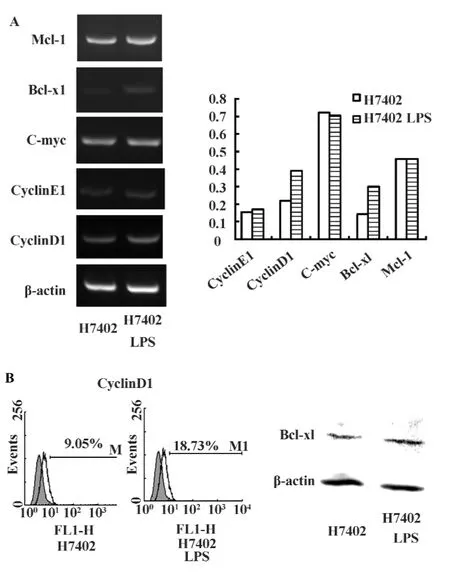
图4 LPS对肿瘤细胞周期、凋亡相关基因的调节Fig.4 LPS regulated the expression of molecules associated with cell apoptosis and cell cycle
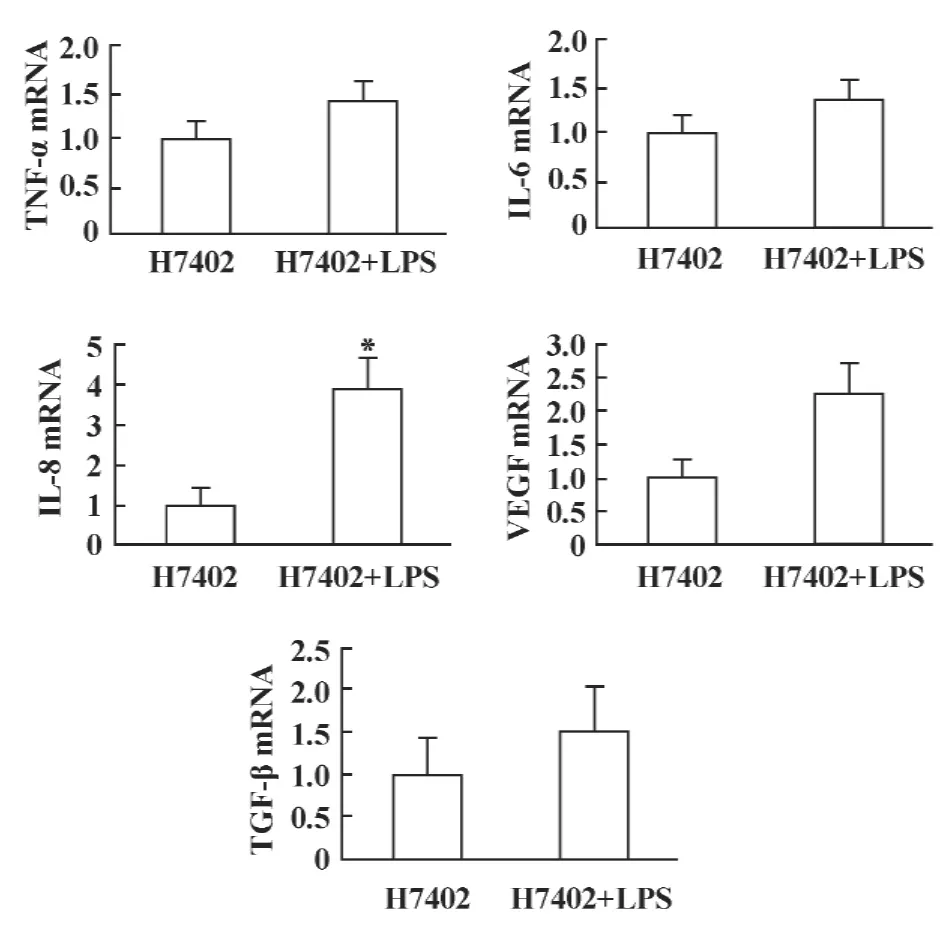
图5 LPS对肿瘤细胞炎症相关基因的调节Fig.5 LPS regulated the expression of genes related to inflammation
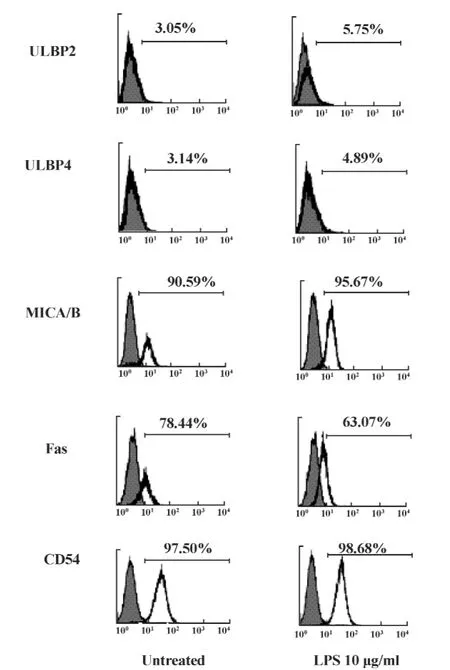
图6 LPS对肿瘤细胞表达淋巴细胞受体配体的调节Fig.6 LPS regulated the expression of ligands of lymphocyte receptors
2.6 LPS对肿瘤细胞表达淋巴细胞受体配体的调节 活化性受体NKG2D和凋亡相关分子FasL的活化能够促进淋巴细胞,如CTL和NK细胞,对肿瘤细胞的杀伤作用。与其相对应的是,肿瘤细胞表面表达的相应受体的配体水平也影响着肿瘤细胞对免疫细胞杀伤的敏感性。我们采用流式细胞术,检测LPS作用于肝癌细胞H7402 24小时后NKG2D的配体 MICA/B、ULBP2、ULBP4,FasL 的受体 Fas,以及粘附分子CD54的表达水平。我们发现LPS作用于肝癌细胞 H7402 后 MICA/B、ULBP2、ULBP4、CD54的表达均不受影响,而FasL的受体Fas在LPS作用后其表达显著下调,由78.44%下调到63.07%,见图6提示LPS能下调肿瘤细胞Fas的表达,有利于肿瘤细胞逃逸淋巴细胞的监视作用。
3 讨论
目前已发现多种 TLRs,其中在人类发现了TLR1-TLR11,在小鼠中发现了 TLR1-TLR13[3]。在TLRs中,TLR1、TLR2、TLR4、TLR5、TLR6 和 TLR10表达在细胞膜表面;TLR7、TLR8和TLR9表达在细胞内的内体上;而TLR3在细胞表面及内体都有表达。TLRs能够识别不同病原微生物高度保守的病原相关分子模式(PAMP)[4,9],其功能主要表现在活化天然免疫,启动抗感染免疫应答。例如,巨噬细胞等效应细胞借助TLRs识别PAMP而被激活,继而分泌炎性因子、介导炎症反应并发挥杀菌效应。同时,TLRs也能活化适应性免疫。TLRs与PAMP结合可激活APC,使之表达多种共刺激分子和细胞因子,从而参与T细胞的激活与增殖[4]。
TLRs不仅表达在免疫细胞上,在肿瘤细胞上也有表达,并且对肿瘤的发生发展起着重要的作用。一方面,肿瘤细胞上的TLRs被激活后,可以诱导细胞凋亡抑制细胞增殖;另一方面,它也能诱导慢性炎症的发生从而促进肿瘤的生长。因此,研究表达在肿瘤细胞上的不同TLRs的功能具有非常重要的意义。
对TLR4的很多研究都是基于TLR4对免疫细胞的作用,证明TLR4活化后能促进树突状细胞的成熟,这对于机体是有利的一面,并且已有报道认为表达在炎症细胞上的TLR4能抑制肿瘤的生长[10]。但是,表达在肿瘤细胞上的TLR4作用却不尽相同。例如,结肠癌上的TLR4活化能抑制NK细胞和效应性T细胞的活化从而促进结肠癌的发生发展[11];在肿瘤微环境中,肿瘤细胞上的TLR4活化能诱导慢性炎症[12]。
由于肝脏生理环境所决定,难以避免与细菌内毒素LPS的接触。我们的研究表明,TLR4在三种肝癌细胞系中都有表达,TLR4的激动剂LPS对肝癌细胞系有显著的促增殖作用;同时,LPS处理的肿瘤细胞对化疗药物顺铂的抗肿瘤效应产生明显的抵抗作用。虽然LPS的受体不仅限于TLR4,TLR2也可以识别 LPS[13],但是在我们其他的实验中发现LPS对于不表达TLR4的肿瘤细胞不具有促进其增殖的作用,说明LPS对消化系统相关肿瘤的刺激作用依赖于TLR4的表达。
进一步研究表明,LPS作用于肿瘤细胞后周期相关的基因CyclinD1表达上调,是引发LPS促增殖作用的关键分子;而凋亡相关分子Bcl-xl表达的上调,使肿瘤细胞抗凋亡的能力增强。另外,我们还发现LPS能促进肝癌细胞H7402炎性因子(IL-6、IL-8、TNF-α)、VEGF等的表达上调。这些因子不仅能够促进肿瘤细胞的生长,同样还能促进髓系诱导的抑制性细胞(MDSC)的生长[14-19]。反过来,MDSC又能诱导慢性炎症,活化调节性T细胞而产生免疫抑制作用[20]。同时,肿瘤细胞Fas表达量的下调,有利于肿瘤细胞逃逸CTL或NK细胞的杀伤。
以上研究结果提示,LPS持续活化TLR4可能是导致肝癌发展、抵抗化疗药的原因之一。本研究为阐明TLR4在肝癌中的意义和寻找有效的肿瘤的生物治疗策略提供了新的实验依据。
1 Kumagai Y,Takeuchi O,Akira S.Pathogen recognition by innate receptors[J].J Infect Chemother,2008;14:86-92.
2 Curtin J F,Liu N,Candolfi M et al.HMGB1 mediates endogenous TLR2 activation and brain tumor regression[J].PLoS Med,2009; 6:e10.
3 Fukata M,Chen A,Vamadevan A S et al.Toll-like receptor-4 promotes the development of colitis-associated colorectal tumors[J].Gastroenterology,2007;133:1869-1881.
4 Goto Y,Arigami T,Kitago M et al.Activation of Toll-like receptors 2,3,and 4 on human melanoma cells induces inflammatory factors[J].Mol Cancer Ther,2008;7:3642-3653.
5 Cai Z,Sanchez A,Shi Z et al.Activation of Toll-like receptor 5 on breast cancer cells by flagellin suppresses cell proliferation and tumor growth[J].Cancer Res,2011;71(7):2466-2475.
6 Szczepanski M J,Czystowska M,Szajnik M et al.Triggering of tolllike receptor 4 expressed on human head and neck squamous cell carcinoma promotes tumor development and protects the tumor from immune attack [J].Cancer Res,2009;69:3105-3113.
7 Sato Y,Goto Y,Narita N et al.Cancer cells expressing toll-like receptors and the tumor microenvironment[J].Cancer Microenviron,2009;2(Suppl 1):205-214.
8 Sun X,Zhang J,Wang L et al.Growth inhibition of human hepatocellular carcinoma cells by blocking STAT3 activation with decoy-ODN[J].Cancer Lett,2008;262(2):201-213.
9 Seth Rakoff-Nahoum,Ruslan Medzhitov.Toll-like receptors and cancer[J].Nature Reviews Cancer,2009;9:57-63.
10 Apetoh L,Ghiringhelli F,Tesniere A et al.Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy[J].Nat Med,2007;13:1050-059.
11 Huang B,Zhao J,Li H et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005;65: 5009-5014.
12 Chen R,Alvero A B,Silasi D A et al.Inflammation,cancer and chemoresistance:taking advantage of the toll-like receptor signaling pathway[J].Am J Reprod Immunol,2007;57:93-107.
13 Werts C,Tapping R I,Mathison J C et al.Leptospiral lipopolysaccharide activates cells through a TLR2-dependent mechanism[J].Nat Immunol,2001;2(4):346-352.
14 Toi M,Matsumoto T,Bando H.Vascular endothelial growth factor: its prognostic,predictive,and therapeutic implications[J].Lancet Oncol,2001;2:667-673.
15 Takahashi A,Kono K,Ichihara F et al.Vascular endothelial growth factor inhibits maturation of dendritic cells induced by lipopolysaccharide,but not by proinflammatory cytokines[J].Cancer Immunol Immunother,2004;53:543-550.
16 Abdollahi T,Robertson N M,Abdollahi A et al.Identification of interleukin 8 as an inhibitor of tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in the ovarian carcinoma cell line OVCAR3[J].Cancer Res,2003;63:4521-4526.
17 Nakashima J,Tachibana M,Horiguchi Y et al.Serum interleukin 6 as a prognostic factor in patients with prostate cancer[J].Clin Cancer Res,2000;6:2702-2706.
18 Vredevoe D L,Widawski M,Fonarow G C et al.Interleukin-6(IL-6)expression and natural killer(NK)cell dysfunction and anergy in heart failure[J].Am J Cardiol,2004;93:1007-1011.
19 Bronte V,Chappell D B,Apolloni E et al.Unopposed production of granulocyte-macrophage colony-stimulating factor by tumors inhibits CD8 T cell responses by dysregulating antigen-presenting cell maturation[J].J Immunol,1999;162:5728-5737.
20 Serafini P,Mgebroff S,Noonan K et al.Myeloid-derived suppressor cells promote cross-tolerance in B-cell lymphoma by expanding regulatory T cells[J].Cancer Res,2008;68:5439-5449.
[收稿2011-11-20 修回2012-03-16]
(编辑 许四平)
The effects of TLR4 activation on the characterizations of hepatocellular carcinoma cell line H7402
ZHANG Yu-Yi,QU Jing,ZHANG Jian.Institute of Immunopharmacology and Immunotherapy,School of Pharmaceutical Sciences,Shandong University,Jinan 250012,China
Objective:To analyze the expression levels of TLR4 expressed on hepatocellular carcinoma cell line H7402,and investigate the effect of LPS on the tumor characterizations,including proliferation ability,inflammatory response and sensitivity to chemotherapy.MethodsThe expression of TLR4,molecules associated with apoptosis and cell cycle on hepatocellular carcinoma cells was detected by RT-PCR.The proliferation of tumor cells was detected by MTT assay.Cell apoptosis was analyzed by AnnexinV/PI assay.The expression of inflammatory factors was determined by quantitative real-time PCR.FACS was used to detect the expression of the molecules expressed on cell surface and CyclinD1.The expression of Bcl-xl was detected by Western blot.ResultsTLR4 was expressed on human hepatocellular carcinoma cell line HepG2,H7402,PLC/PRF/5.LPS could promote the proliferation of hepatocellular carcinoma cells and protect tumor cells from chemotherapy drug.Further investigation indicated that the molecules associated with cell cycle and apoptosis,CyclinD1 and Bcl-xl,were up-regulated,whereas Fas was down-regulated.Additionally,the inflammatory cytokines were also up-regulated by LPS.ConclusionLPS could induce the expression of inflammatory cytokines,promote the proliferation of hepatocellular carcinoma cell H7402 and protect tumor cells from chemotherapy drug.
Hepatocellular carcinoma;TLR4;Cisplatin;Proliferation;Inflammatory cytokines
R735
A
1000-484X(2012)08-0695-06
10.3969/j.issn.1000-484X.2012.08.005
①本文为国家自然科学基金(81172789,30972692)资助项目
张誉艺(1986年-),女,在读硕士,主要从事免疫药理与免疫治疗方向的研究,E-mail:yuyi0924@yahoo.com.cn;
及指导教师:张 建(1965年-),女,博士生导师,主要从事免疫药理与免疫治疗学方面的研究,E-mail:zhangj65@sdu.edu.cn。
