肺癌的微创外科治疗
2012-02-03徐恩五综述乔贵宾审校
徐恩五 综述 乔贵宾 审校
(广州军区广州总医院胸外科,广州 510010)
肺癌的微创外科治疗
徐恩五 综述 乔贵宾*审校
(广州军区广州总医院胸外科,广州 510010)
·文献综述·
肺癌的微创外科治疗经历了从最初的保留胸壁肌肉的小切口手术到胸腔镜以及机器人手术的演变历程。目前,广泛开展的胸腔镜手术符合肺癌治疗的原则,肺癌微创外科治疗正逐步从手术径路的微创化向保留更多脏器功能以及实行靶向区域淋巴结清扫的实质化微创过渡。
肺癌; 电视胸腔镜手术
* 通讯作者,E-mail:guibinqiao@126.com
随着微创化理念的不断发展和成熟,近20年来,肺癌的微创手术取得了长足发展。目前,电视胸腔镜手术 (video-assisted thoracoscopic surgery,VATS)是肺癌微创手术的主要术式。虽然胸腔镜下肺癌手术的可行性、安全性以及肿瘤切除的彻底性曾引起大家的争议,但随着国内外多中心研究结果的公布,VATS治疗肺癌可以达到与传统开胸手术同样的效果。本文就肺癌的微创外科治疗进行综述,探讨目前的肺癌手术径路的微创化,如何过渡到保留更多的肺组织,从而实现全面、实质上的肺癌微创治疗。
1 肺癌微创外科治疗的历史
自1933年Graham首次成功采用解剖性全肺切除的方法进行肺癌手术以来,人们对肺癌的外科手术术式进行了系统探讨。目前,采用后外侧切口径路进行肺叶切除联合纵隔淋巴结清扫已成为标准的肺癌手术方式。后外侧切口径路具有手术野暴露好,可以满足各种肺癌手术需要等优点,但其缺点是手术切口过长,创伤巨大,必须切断背阔肌及前锯肌,出血较多,开关胸时间长,术后恢复慢,尤其是术后疼痛剧烈,易导致心血管、呼吸系统等并发症的发生。另外,标准后外侧切口破坏了肩带肌肉的结构,易致术后持续性胸痛、冻结肩,术后患者生活质量下降。20世纪80年代末期开始,出现了保留胸肌的微创开胸术式(muscle-sparing thoracotomy,MST),该切口保持了背阔肌的完整性,不破坏肩带肌肉的结构,术后疼痛及肩关节功能障碍明显减少,因此,该手术径路在当时盛行一时。随着新的手术设备和器械的出现以及腔镜技术的不断完善,Lewis于1992年首先报道电视胸腔镜治疗肺癌的肺叶切除术。2006年,McKenna等[1]报道上千例胸腔镜下肺叶切除的经验,引起了国内外胸外科医生的广泛兴趣。几乎与此同时,在北京大学人民医院王俊等[2]的大力推广下,国内的全胸腔镜肺叶切除手术也日趋成熟,目前已发展为国内各大医院胸外科日常开展的常规手术。也正是由于胸腔镜在肺叶切除及纵隔淋巴结清扫中地位的确立,2006年美国NCCN肺癌诊治指南[3]将胸腔镜肺叶切除术首次正式列为早期非小细胞肺癌的根治性手术方式。美国近5年胸腔镜肺叶切除术由原来的16%增长到49%,开放肺叶切除由原来的81%下降到42%[4]。目前,对各种早中期肺癌,甚至部分经高度选择的局部晚期肺癌均可采用胸腔镜辅助或全胸腔镜手术进行根治。
2 肺癌的微创外科技术
主要包括保留胸壁肌肉的小切口手术和胸腔镜手术两大类。
2.1 保留胸壁肌肉(muscle sparing,MS)的肺癌手术
这类手术尽可能保持胸壁肌肉的完整性,可以改善患者术后早期疼痛并减少肺部并发症的发生,利于康复,且切口较小,位置隐匿,更易被年轻女性患者所接受。应用较多的手术径路主要为腋下小切口和听诊三角切口。
2.1.1 腋下小切口 也称为传统的MS开胸切口,手术时保留背阔肌,沿肌纤维钝性牵开前锯肌,唯一要切断的肌肉为肋间肌,为临床最常用的MS切口。术中应用微创开胸牵开器缓缓撑开,以防止肋骨骨折及椎旁神经受压。腋下小切口不影响背阔肌、斜方肌、菱形肌及前锯肌运动,不切断肋骨,不牵拉肩胛骨,对肌肉及骨骼影响较小,对肩关节活动功能影响较小,可预防患者术后冻结肩的发生[5,6]。该切口位于标准后外侧切口的中央部位,当手术困难时可将切口向两端延伸成为标准的后外侧切口。
2.1.2 听诊三角切口 顾名思义,利用听诊三角无肌肉区进胸进行手术,利用斜方肌与背阔肌、前锯肌之间的间隙进胸,三角的底为脂肪组织、深筋膜和第6肋间隙。与传统MS切口相比,少了传统的MS为显露前锯肌后缘而需要大范围游离皮瓣及背阔肌,所以切口更小,进胸时间和关胸时间更短[7]。
由于MS手术操作与传统开胸手术相似,所以一经推广就被大多数胸外科医师所采纳。随着器械的改进和小切口下手术操作技巧的提高,MS治疗肺癌的适应证亦不断扩大,基本上可以覆盖大多数适合手术的肺癌患者。
2.2 VATS 治疗肺癌
胸腔镜技术是胸心外科发展中仅次于体外循环的一次技术革命[8]。VATS可以分为3种手术方式,即完全胸腔镜肺叶切除术、胸腔镜辅助肺叶切除术和胸腔镜辅助小切口肺叶切除术,不论哪种术式都必须做一胸部切口以取出标本。
2.2.1 完全胸腔镜肺叶切除术(thoracoscopic lobectomy) 胸部切口2~4个,其中主切口3~5 cm,可做操作和取标本之用,附加切口1~3个,长度1~1.5 cm。要求不使用肋骨撑开器撑开肋骨,外科医生仅通过电视屏幕窥视手术视野。完全胸腔镜肺叶切除术的适应证为:①临床Ⅰ期肺癌;②肿瘤<5 cm;③段支气管中央型肺癌。相对适应证:①临床Ⅱ、ⅢA期肺癌;②>5 cm或过小难以触及的肿瘤;③中央型肺癌。禁忌证:①胸壁、纵隔侵犯(T3、T4);②术前放疗;③支气管周围淋巴结结核(陈旧性)。但完全胸腔镜手术常需使用一次性手术器械,昂贵的耗材费用是该技术在中国推广的重要制约因素。
2.2.2 胸腔镜辅助肺叶切除术(即杂交胸腔镜手术,thoracoscopic-assisted lobectomy or hybrid thoracoscopic lobectomy) 胸部切口常为8~10 cm,术中需要应用微创肋骨撑开器撑开肋间,手术操作可在直视或腔镜电视屏幕的监视下进行,故手术适应证较全腔镜手术明显扩大,对<5 cm的周围型肺癌,较小的中央型肺癌,有孤立的肺门或纵隔淋巴结转移者,均可容易做到完全切除。胸腔镜手术技巧熟练的医师可通过该径路完成肺血管-支气管成形术和隆突切除重建术。但由于该术式常需要撑开肋骨,术后近期疼痛明显,因而被很多学者所诟病。但8~10 cm的切口,毕竟比传统切口已明显改进,应用常规的手术器械,打结器、电凝钩,可以完成绝大多数肺癌手术,并且可以做到“零耗材”,不增加手术成本,更符合中国国情,便于地市或县一级基层医院的应用。杂交手术的另外一个优势在于,通过胸腔镜和小切口技术的结合,适用于一些全胸腔镜下难以进行的复杂手术,比如肿瘤过小难以触及或肿瘤分期偏晚的中央型肺癌的手术,部分存在胸腔粘连不能通过腔镜操作完成的手术,也可以应用该方法完成。
2.2.3 胸腔镜辅助小切口肺叶切除术(thoracoscope-assisted minithoracotomy or videoassisted minithoracotomy,VAMT) 胸部小切口一般在10~15 cm,需要使用肋骨撑开器撑开肋骨,使用常规手术器械进行手术操作,术者大多通过切口观察术野。配合胸腔镜胸腔内照明或观察处理肋膈角或胸顶等较难直视观察的部位,解决了MS手术视野显露欠佳的缺点,适用于绝大多数适合手术的肺癌患者。可以利用腔镜器械或仅仅是普通手术器械,为不同的消费人群提供更多的选择。值得一提的是,与全胸腔镜手术相比,胸腔镜辅助小切口手术虽然创伤较大,但可明显减少一次性手术材料的应用,降低了手术费用。因此,我们认为在腔镜手术方式选择时应强调个体化,应注重病人的疗效和安全,还要从我国的国情出发,考虑到微创手术方式的经济性,不要一味追求完全胸腔镜手术,当VAMT更有利于病灶切除,性价比更高时,就应选用辅助小切口完成手术。
3 肺癌微创手术的治疗效果
3.1 手术的可行性和安全性
Z0030[9]是美国外科医生协会肿瘤学研究组于1999~2004年进行的一项旨在对比系统性纵隔淋巴结清扫和淋巴结采样在肺癌外科治疗中作用的大型前瞻性随机对照研究,该研究共入组1111例早期肺癌病人,由于绝大多数手术为传统的开放手术,因此,现在在讨论肺癌手术的可行性和安全性时,常将Z0030的研究结果作为标准进行比较。McKenna等[1]和杜克大学的 Onaitis等[10]所报道的全胸腔镜肺叶切除手术与Z0030研究的具体情况见表1。
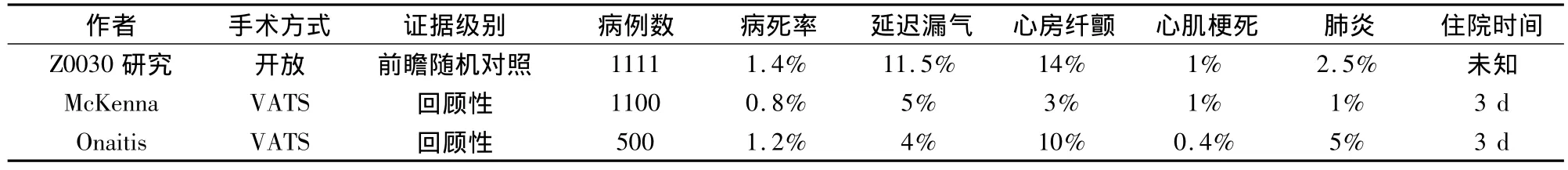
表1 常规开胸与胸腔镜下肺叶切除术后并发症发生率情况
为明确胸腔镜手术治疗肺癌的可行性,Gopaldas等[11]对2004~2006 年美国全国住院病人数据库中所有接受肺叶切除的病人进行了统计,13 619例肺癌接受了肺叶切除术,其中常规开胸手术12 860例,胸腔镜手术759例,胸腔镜肺叶切除术中并发症的发生率是常规开胸手术的1.6倍,但2组在手术近期死亡率、住院时间和费用上没有明显差异。需要指出的是,术中并发症发生率高主要出现在胸腔镜肺叶切除手术不熟练的医生中,2组住院费用没有明显差异,主要与国外常规开胸手术中也应用较多一次性耗材有关。此外,CALGB 39802[12]研究对127例<3 cm的周围型肺癌进行了VATS肺叶切除,结果显示VATS手术成功率、死亡率、复发和生存,与常规开胸手术无明显差异,手术时间较开胸手术稍长,术后并发症、1年生存率等均未见明显差异。国内的研究[13]也得出类似的结果。
3.2 肿瘤切除的彻底性
能否进行彻底的淋巴结清扫一直是胸腔镜肺叶切除手术备受争议的问题。Kondo等[14]对肺癌患者在施行VATS辅助小切口行肺叶切除联合纵隔淋巴结清扫后,再开胸手术进一步清扫残留淋巴结,结果显示VATS辅助小切口手术后残余淋巴结仅占总淋巴结数目的2.7% ~2.9%,占总重量的2.1% ~2.9%。Sagawa等[15]比较 29例(左侧 12例,右侧17例)临床Ⅰ期的非小细胞肺癌,在行VATS肺叶切除联合纵隔淋巴结清扫后立即由另一名外科医生行开胸探查并切除残留的纵隔淋巴结,结果显示右侧VATS平均切除淋巴结40.3枚,重量为10.0 g,平均残留淋巴结1.2枚,残留重量0.2 g;左侧VATS平均切除淋巴结37.1枚,重量8.3 g,残留淋巴结1.2枚,残留重量0.2 g,而且在残留淋巴结中均未见肿瘤。以上数据表明,胸腔镜下肺叶切除术仅残留2%~3%的淋巴结组织,说明胸腔镜手术在淋巴结清扫上可以达到与开胸手术相当的彻底程度。但以上研究存在的主要问题是研究者定义的胸腔镜手术采用了7~8 cm胸部切口并需要用肋骨撑开器撑开肋间,而且约有一半的手术是在直视下进行操作,因此,该结论可以作为胸腔镜辅助下肺叶切除术与常规手术比较的结果,不能代表全胸腔镜下肺叶切除术清扫淋巴结的程度。杨帆等[16]将全胸腔镜纵隔淋巴结清扫与传统开胸手术对比,胸腔镜组与开胸组纵隔淋巴结清扫组数[中位数4组(3~6组)vs.4组(3~7组)]和数量[(13.7 ±6.1)枚 vs.(14.6 ±7.2)枚]无差异,各区域(右侧上纵隔、中下纵隔,左侧主动脉弓周围、中下纵隔)2组间淋巴结清扫数亦无显著差异。一项来自日本的研究[17]进一步比较了完全胸腔镜下肺叶切除术(4 cm胸部切口且非肋间撑开)与胸腔镜辅助小切口肺叶切除术(10 cm胸部切口且肋间撑开)在淋巴结清扫程度上的差别,39例肺癌被随机分成2组,胸腔镜辅助小切口组平均送检32枚淋巴结,完全胸腔镜组平均送检29枚,2种术式在淋巴结清扫上没有差异(P=0.12)。
Shiraishi等[18]认为虽然胸腔镜肺叶切除治疗肺癌不会降低患者的生存率,但是仍然会增加那些淋巴结阳性患者的局部复发风险,他们认为可能与胸腔镜下淋巴结清扫不如直视操作下更加彻底有关,所以多数人认为对术前已有N1或N2淋巴结肿大的患者手术应慎选。Congregado等[19]总结13年来应用胸腔镜肺叶切除术的经验,他们认为胸腔镜肺叶切除是符合肿瘤学治疗标准的,是当前治疗T1~T2N0M0期支气管肺癌的理想术式。Flores等[20]认为对ⅠA期肺癌的外科治疗采用全胸腔镜肺叶切除联合淋巴结清扫较开胸手术具有优势。多中心大样本的研究表明VATS术后肺癌患者的生存率与传统开胸手术相当,甚至更好[21]。基于以上研究结果,绝大多数专家认同胸腔镜肺叶切除联合淋巴结清扫符合肿瘤治疗原则[22],并已被NCCN非小细胞肺癌诊疗指南等权威机构认可。
4 肺癌微创治疗的未来
全胸腔镜肺叶切除联合纵隔淋巴结清扫治疗肺癌已日趋成熟,随着各种微创手术器械的发展和手术技巧的不断熟练,既往被认为是胸腔镜手术禁忌证的胸膜广泛粘连,>5 cm的肿瘤以及某些支气管成形手术也可在全胸腔镜或胸腔镜辅助下顺利完成。但目前这种主要以腔镜为技术手段的肺癌微创治疗主要围绕在手术径路创伤的微创化上,还仅仅是“皮毛”技术。
由于目前最公认的全胸腔镜肺叶切除适合肿瘤比较小的早期肺癌,如果对这些病人能进行保留最大器官功能的小于肺叶解剖范围的手术切除,其微创价值具有更为重要的现实意义。事实上,日本、欧美和国内的[23]一些胸外科医生已经进行了许多卓有成效的临床尝试,散在的数据表明,对孤立结节样肺癌[含肺内磨玻璃密度影(ground glass opacity,GGO)]进行肺段或楔形切除可取得与肺叶切除相同的治疗效果。为证实以上观点,目前在北美和日本分别开展了3项大型的前瞻性随机对照研究。在北美开展的 CALGB140503[24]计划于2007 ~2012 年共入组1300例<3 cm的早期非小细胞肺癌,将病人随机分为局部切除和肺叶切除2组,对比2种方法的治疗效果。日本临床肿瘤研究组开展的JCOG0804[25]研究是一项前瞻性Ⅱ期临床试验,计划从2009年开始共入组330例<2 cm的腺癌,并要求肺部病灶在影像学上主要表现为GGO(实性成份<25%),将病人随机分为局部切除和肺叶切除2组,对比治疗效果。另一项由日本临床肿瘤组开展的 JCOG0802[26]是一项Ⅲ期临床试验,2009 ~2012年入组1100例<2 cm的腺癌,而病灶主要为实性成份(实性成份>25%),将病灶随机分为2组后观察2种方法的治疗效果。相信随着5年后上述3个临床试验生存结果的面世,对于早期肺癌是否可以进行局部切除,哪些早期肺癌可以接受局部切除等目前尚存争论的诸多问题可以进行初步回答,这三项研究也被誉为“将会改变教科书中肺癌治疗方式”的研究。
大约20%<20 mm的肺腺癌与5%<10 mm的肺部病灶已存在淋巴结转移[27]。肺叶特异性的淋巴结清扫术,即清扫范围仅限于收纳受累肺叶的主要淋巴引流区域,已显示出替代完全性系统淋巴结清扫术的趋势[28]。一项多中心前瞻性临床试验将术中分期为T1~2N0无肺门N1的NSCLC患者随机分组,分别接受淋巴结采样术或系统性淋巴结清扫术,结果显示在3.8%接受系统性淋巴结清扫术的患者中发现隐匿淋巴结转移,但无总生存期方面的获益[29]。最新的研究亦显示在非常早期腺癌的某些特殊类型中,尤其是GGO病灶,通常不需要行系统性淋巴结清扫术[30],但是这些结果不应类推至相对晚期的患者中。
近来,采用达芬奇机器人手术系统进行肺叶切除[31]是肺癌微创治疗的一种新手段,通过该系统医生可在三维显像下利用接近人手活动度的机械臂进行手术操作,但该系统存在需要人工安放装置、运行和养护费用昂贵等缺点。随着经自然腔道内镜手术在腹部手术中的广泛应用以及各种手术器械的不断发展,经口肺叶切除或肺肿瘤切除的理念也一定可以实现。
1 McKenna RJ Jr,Houck W,Fuller CB.Video-assisted thoracic surgery lobectomy:experiencewith 1,100 cases.Ann Thorac Surg,2006,81(2):421 -425.
2 李剑锋,李 运,王 俊,等.全胸腔镜下肺叶切除技术要点分析.中国微创外科杂志,2009,9(1):30 -32.
3 NCCN Clinical Practice Guidelines in Oncology.www.nccn.org
4 Seder CW,Hanna K,Lucia V,etal.The safe transition from open to thoracoscopic lobectomy:a 5-year experience.Ann Thorac Surg,2009,88(1):216 -225.
5 钟 镭,徐志飞,孙耀昌,等.腋下垂直小切口行肺切除术.中国胸心血管外科杂志,2004,11:153 -154.
6 苗朝良,张益红,于秋风,等.腋下小切口在肺癌手术中的应用.中国现代医药杂志,2009,11(8):70 -71.
7 蒋 伟,王 群,范 虹,等.听诊三角保留肌肉剖胸切口临床应用体会.复旦大学学报(医学版),2007,34(4):586 -588.
8 王 俊.电视胸腔镜在胸部疾病治疗中的应用现状.临床外科杂志,2005,13(6):384 -385.
9 Scott WJ,Allen MS,Darling G,et al.Video-assisted thoracic surgery versus open lobectomy for lung cancer:A secondary analysis of data from the American College of Surgeons Oncology Group Z0030 randomized clinical trial.J Thorac Cardiovasc Surg,2010,139:976-983.
10 Onaitis MW,Petersen PR,Balderson SS,et al.Thoracoscopic lobectomy is a safe and versatile procedure:experience with 500 consecutive patients.Ann Surg,2006,244:420 -425.
11 Gopaldas RR, Bakaeen FG, Dao TK, et al. Video-assisted thoracoscopic versus open thoracotomy lobectomy in a cohort of 13,619 patients.Ann Thorac Surg,2010,89(5):1563 -1570.
12 Swanson SJ,Herndon JE,D’Amico TA,et al.Video-assisted thoracic surgery(VATS)lobectomy-report of CALGB 39802:a prospective,multi-institution feasibility study.J Clin Oncol,2007,25:4993-4997.
13 姜冠潮,王 俊,李 晓,等.连续256例全胸腔镜肺叶切除术结果分析.中华胸心血管外科杂志,2009,25,(6):382 -386.
14 Kondo T,Sagawa M,Tanita T,et al.Assessment of systematic nodal dissection by VATS lobectomy for lung cancer.Kyobu Geka,2000,53(1):8 -12.
15 Sagawa M,Sato M,Sakurada A,et al.A prospective trial of systematic nodal dissectionfor lung cancer by video-assisted thoracic surgery.Can it be perfect?Ann Thorac Surg,2002,73(3):900 -904.
16 杨 帆,王 俊,刘 军,等.临床Ⅰ期非小细胞肺癌全胸腔镜与开胸纵隔淋巴结清扫的对比研究.中国微创外科杂志,2010,10(4):344-350.
17 Shigemura N,Akashi A,Nakagiri T,et al.Complete versus assisted thoracoscopic approach:a prospective trial comparing a variety of video-assisted thoracoscopic lobectomy techniques.Surg Endosc,2004,18:1492 -1497.
18 Shiraishi T,Hiratsuka M,Yoshinaga Y,et al.Thoracoscopic lobectomy with systemic lymph node dissection for lymphnode positive non-small cell lung cancer is thoracoscopic lymph node dissection feasible.Thorac Cardiovasc Surg,2008,56(3):162 -166.
19 Congregado M,Merchan RJ,Gallardo G,et al.Video-assisted thoracic surgery(VATS)lobectomy:13 years’experience.Surg Endosc,2008,22(8):1852 -1857.
20 Flores RM,Alam N.Video-assisted thoracic surgery lobectomy(VATS),open thoracotomy,and the robot for lung cancer.Ann Thorac Surg,2008,85(2):S710-S715.
21 Rueth NM,Andrade RS.Is VATS lobectomy better:perioperatively,biologically and oncologically?Ann Thorac Surg,2010,89(6):S2107-S2111.
22 Thomas P,Doddoli C,Yena S,et al.VATS is an adequate oncological operation for stageⅠ non-small cell lung cancer.Eur J Cardiothorac Surg,2002,21(6):1094 -1099.
23 何建行,杨运有,张镜芳.肺部微小结节的微创伤诊治.中华胸心血管外科杂志,2000,16(3):144 -146.
24 CALGB 140503:A Randomized phaseⅢTrial of lobectomy versus sublobar resection for small(<2cm)peripheral non-small cell lung cancer.http://www.cancer.gov/clinicaltrials/CALGB -140503
25 PhaseⅡstudy of limited surgical resection for peripheral early lung cancer defined with thoracic thin-section computed tomography(JCOG0804/WJOG4507L).www.umin.ac.jp/ctr
26 Nakamura K,Saji H,Nakajima R,et al.A phaseⅢ randomized trial of lobectomy versus limited resection for small-sized peripheral non-small cell lung cancer(JCOG0802/WJOG4607L).Jpn JClin Oncol,2010,40(3):271 -274.
27 Asamura H,Suzuki K,Watanabe S,et al.A clinicopathological study of resected subcentimeter lung cancers:a favorable prognosis for ground glass opacity lesions.Ann Thorac Surg,2003,76:1016-1022.
28 Ishiguro F,Matsuo K,Fukui T,et al.Effect of selective lymph node dissection based on patterns of lobe-specific lymph node metastases on patient outcome in patients with resectable non-small cell lung cancer:a large-scale retrospective cohort study applying a propensity score.J Thorac Cardiovasc Surg,2010,139:1001 -1006.
29 Darling GE,Allen MS,Landreneau RJ,et al.Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patientwith N0 or N1(less than hilar)non-small cell carcinoma:results of the ACOSOG Z0030 Trial.JThorac Cardiovasc Surg,2011,141(3):662 -670.
30 Nomori H,Iwatani K,Kobayashi H,et al.Omission ofmediastinal lymph node dissection in lung cancer:its techniques and diagnostic procedures.Ann Thorac Cardiovasc Surg,2006,12:83 -88.
31 Melfi FMA, Ambrogi MC, Lucchi M, et al. Video robotic lobectomy.MMCTS,2005,10:1510 -1515.
(责任编辑:李贺琼)
R734.2
A
1009-6604(2012)08-0748-04
2011-08-15)
2012-01-29)
·术式探讨·
