晚期糖基化终产物对大鼠血管外膜成纤维细胞中烟酰胺腺嘌呤二核苷酸磷酸氧化酶p22phox亚基及活性氧表达的影响
2012-02-03刘亚洋李鹤吴宗贵汤锡友
刘亚洋,李鹤,吴宗贵,汤锡友
晚期糖基化终产物对大鼠血管外膜成纤维细胞中烟酰胺腺嘌呤二核苷酸磷酸氧化酶p22phox亚基及活性氧表达的影响
刘亚洋,李鹤,吴宗贵,汤锡友
目的:探讨晚期糖基化终产物(AGE)对大鼠血管外膜成纤维细胞(AF)中烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶p22phox亚基及活性氧表达的影响。
方法:用组织贴块法培养SD大鼠的血管外膜成纤维细胞,用逆转录—聚合酶链反应、蛋白质印迹检测不同浓度的糖基化人血清白蛋白(AGE-HSA,分为对照组、100μg/m l AGE-HSA组,200μg/ml AGE-HSA组、300μg/m l AGE-HSA组)对NADPH氧化酶p22phox亚基信使核糖核酸(mRNA)及蛋白的表达的影响,并观察不同干预因素[分为对照组1、200μg/ml AGE-HSA组(200μg/ml处理组1)、200μg/ml AGE-HSA+50μg/ml抗RAGE中和抗体组(抗RAGE中和抗体组1)及200μg/ml AGE-HSA+30 nmol/L坎地沙坦组(坎地沙坦组1)对AGE-HSA上调NADPH氧化酶p22phox亚基mRNA和蛋白表达的影响。用2’,7’-二氯荧光黄双乙酸盐检测不同干预因素[空白对照组、AGE-HSA 200μg/ml组(200μg/ml处理组2)、200μg/ml AGE-HSA+50μg/ml抗RAGE中和抗体组(抗RAGE中和抗体组2)、200μg/ml AGE-HSA+30μmol/L夹竹桃素组(夹竹桃组),200μg/ml AGE-HSA+30 nmol/L坎地沙坦组(坎地沙坦组2)对血管外膜成纤维细胞内活性氧表达的影响。
结果:3个浓度(100μg/ml、200μg/ml和300μg/ml)的AGE-HSA组均与对照组比较,血管外膜成纤维细胞NADPH氧化酶p22phox亚基mRNA及蛋白的表达随AGE-HSA增加呈浓度依赖性上调;抗RAGE中和抗体组1、坎地沙坦组1比200μg/m l处理组1的p22phoxmRNA及蛋白表达降低;抗RAGE中和抗体组2、夹竹桃素组2及坎地沙坦组2比200μg/ml AGE-HSA处理组2血管外膜成纤维细胞内活性氧相对荧光强度降低,上述比较差异均有统计学意义(P<0.05)。
结论:AGE-HSA经由RAGE影响活性氧与NADPH氧化酶p22phox亚基的表达上调,活性氧的上调与NADPH氧化酶p22phox亚基表达相关。NADPH氧化酶抑制剂及坎地沙坦可通过下调NADPH氧化酶p22phox亚基的表达减少血管外膜成纤维细胞内活性氧的产生。
晚期糖基化终产物;晚期糖基化终产物受体;血管外膜成纤维细胞;NADPH氧化酶;p22phox
Objective:To investigate the effect of advanced glycation end products(AGE)on NADPH oxidase subunit p22phox expression and reactive oxygen species(ROS)production in vascular adventitial fibroblasts(VAF)in rats.
Methods:The isolated VAF of SD ratswere cultured with the adherent tissue explantsmethod.①The effectof AGE-HSA on p22phoxmRNA and protein expression weremeasured by RT-PCR and Western-blotwith different concentrations of AGE-HSA at 100 μg/ml,200 μg/ml,300 μg/ml and Control group respectively. ②The effect of different reagents on AGE-HSA regulating p22phoxmRNA and protein expression were conducted as200 μg/m l AGE-HSA group,200 μg/ml AGE-HSA+anti-RAGE neu-tralizing antibody group,and 200μg/ml AGE-HSA+Candesartan group.③The effectof different reagents on ROSproduction in AF weremeasured by ROSassay kit as 200 μg/m l AGE-HSA group,200 μg/m l AGE-HSA+anti-RAGE neutralizing antibody group,200 μg/ml AGE-HSA+Apopcin group,and 200 μg/m l AGE-HSA+Candesartan group.
Results:①Compared with Control group,p22phoxmRNA and protein expression were up-regulated by AGE-HSA in a dosedependentmanner.②Compared with 200μg/m l AGE-HSA group,p22phoxmRNA and protein expression decreased in 200μg/ml AGE-HSA+anti-RAGE neutralizing antibody group and 200μg/ml AGE-HSA+Candesartan group.③Compared with 200 μg/ml AGE-HSA group,the ROS production in VAF decreased in 200 μg/ml AGE-HSA+anti-RAGE neutralizing antibody group,200 μg/ml AGE-HSA+Apopcin group,and 200 μg/m l AGE-HSA+Candesartan group.All P<0.05.
Conclusion:ThemRNA and protein expression of p22phox,the ROS production in VAF were up-regulated by AGE-HSA in rats,and those effects could be inhibited by RAGE.NADPH oxidase inhibitors and candesartan can reduce ROSby down-regulating p22phox expression.
(Chinese Circulation Journal,2012,27:228.)
氧化应激是动脉粥样硬化发生发展的中心环节[1,2],它与糖尿病并发症的发生发展密切相关。糖尿病患者血管组织中的晚期糖基化终产物(AGE)逐渐堆积,AGE-糖基化终产物受体(RAGE)-氧化应激轴参与了糖尿病血管并发症的发生过程[3]。血管外膜成纤维细胞氧化应激的产生诱发外膜炎症,烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶作为活性氧的调控酶,其亚基p22phox在多种组织的氧化应激反应中起着枢纽性作用。本研究探讨AGE对血管NADPH氧化酶p22phox亚基表达的影响,并观察RAGE中和抗体、坎地沙坦等干预因素对血管外膜成纤维细胞氧化应激的影响。
1 材料与方法
实验动物及材料:2008-10至2009-10选择6周龄清洁级健康雄性SD大鼠8只,体重(200±6.5)g(上海市中科院动物中心提供,合格证号:中科院动管会第005号)。材料:改良 Eagle培养基(DMEM)、胎牛血清、胰蛋白酶、总核糖核酸(RNA)提取试剂(Trizol,美国Gibco公司),培养皿(美国Corning公司),糖基化人血清白蛋白(AGE-HSA,美国Sigma公司)。氧化酶抑制剂夹竹桃素(德国默克公司)。2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)荧光探针(江苏碧云天公司)。SYBR Green荧光染料(美国Molecular Probes公司),BCA蛋白浓度测定试剂盒(上海康成生物工程公司)。小鼠抗大鼠Phospho-p22 phox单克隆抗体(美国,R&D公司),小鼠抗RAGE抗体,辣根过氧化物酶—抗小鼠-IgG(美国Santa Cruz生物技术公司)。
方法:血管外膜成纤维细胞培养:10周龄雄性SD大鼠,取胸主动脉,剥取外膜,将其剪成约1 mm3左右的小块,把每小块组织均匀贴于培养皿底部,用含10%小牛血清的DMEM液培养,免疫组化鉴定,Vimentin单抗染色阳性,α肌动蛋白单抗染色阴性,即为所需血管外膜成纤维细胞,纯度达98%。生长接近融合时按1∶3传代,实验使用3~5代细胞。
实验分组:①AGE-HSA对血管外膜成纤维细胞NADPH氧化酶p22phox亚基表达的影响:通过多次预实验筛选出有效药物浓度。按血管外膜成纤维细胞中添加不同浓度的 AGE-HSA,分为对照组(0μg/ml AGE-HSA)、100 μg/ml AGE-HSA 组、200 μg/ml AGEHSA组和300μg/ml AGE-HSA组,刺激24 h后进行检测。②干预因素对AGE-HSA上调NADPH氧化酶p22phox亚基mRNA和蛋白表达的影响:分为对照组1(0μg/m l AGE-HSA)、200μg/ml处理组1(200μg/ml AGE-HSA)、抗RAGE中和抗体组1(200μg/ml AGEHSA+50μg/ml抗 RAGE中和抗体)、坎地沙坦组1(200μg/ml AGE-HSA+30 nmol/L坎地沙坦)。③干预因素对血管外膜成纤维细胞内活性氧的影响:同步化的血管外膜成纤维细胞分空白对照组、200μg/ml处理组2(AGE-HSA 200μg/ml)、抗RAGE中和抗体组2(200μg/ml AGE-HSA+50μg/ml抗RAGE中和抗体)、坎地沙坦组2(200μg/m l AGE-HSA+30 nmol/L坎地沙坦)和夹竹桃素组(200μg/m l AGE-HSA+30μmol/L夹竹桃素),加入干预因素预孵育1 h后加入200μg/ml AGE-HSA共同孵育23 h,检测活性氧。
逆转录-聚合酶链反应检测血管外膜成纤维细胞NADPH氧化酶p22phox亚基信使核糖核酸(mRNA)表达:NADPH氧化酶p22phox亚基基因序列扩增的上游引物序列:5’-GCT CAT CTG TCT GCT GGA GTA-3’;下游引物序列:5’-ACG ACC TCA TCT GTA ACT GGA-3’,扩增片段为435 bp。扩增产物于含溴化乙锭琼脂糖凝胶中进行电泳。
蛋白质印迹:生长达融合状态的细胞同步化后经各干预因素预处理45 min后加AGE刺激24 h。分别收集上述细胞,提取总蛋白,行蛋白质印迹检测。
2’,7’-二氯荧光黄双乙酸盐荧光探针检测细胞内活性氧:将细胞接种于6孔培养板中,各孔中加入玻片,待细胞培养至80%融合时,0.25%胰酶消化,用缓冲液PBS洗涤后制成3×105/m l的单细胞悬液;待细胞长满后,用37℃预温的缓冲液PBS洗细胞1次,然后与终浓度为10μmol/L的荧光染料DCFH-DA在37℃条件下避光孵育30 min;缓冲液PBS洗2次,室温下静置5 min;荧光显微镜下观察细胞内活性氧水平。
2 结果
AGE-HSA对血管外膜成纤维细胞NADPH氧化酶p22phox亚基mRNA及蛋白表达影响:血管外膜成纤维细胞NADPH氧化酶亚基p22phox mRNA的表达,100 μg/mlAGE-HSA 组(1.32±0.21)、200 μg/ml AGE-HSA组(2.65±0.23)及300 μg/mlAGE-HSA 组(2.83±0.20)与对照组(1.00)比较,随AGE-HSA浓度NADPH氧化酶p22phox亚基mRNA表达增加呈浓度依赖性上调;200μg/ml AGE-HSA组比100μg/ml AGE-HSA组增加,差异均有统计学(P<0.05)。图1A。血管外膜成纤维细胞NADPH氧化酶p22phox亚基蛋白的表达,100 μg/ml AGE-HSA 组(2.45±0.18)、200 μg/ml AGE-HSA组(4.21±0.15)及 300μg/ml AGE-HSA组(4.38±0.10)与对照组(1.00)比较,随AGE-HSA浓度增加其表达呈浓度依赖性上调,200μg/ml AGE-HSA组比100μg/ml AGE-HSA组增加,差异有统计学意义(P<0.05)。200μg/ml AGE-HSA组与 300μg/ml AGEHSA组比较差异无统计学意义(P>0.05)。图1B
不同干预因素对AGE-HSA上调NADPH氧化酶p22phox亚基mRNA和蛋白表达的影响:NADPH氧化酶p22phox亚基mRNA表达200μg/ml处理组1(2.65±0.22)比对照组1(1.00)增强;抗RAGE中和抗体组1(1.02±0.14)、坎地沙坦组1(0.98±0.12)比200 μg/ml处理组1(2.65±0.22)降低。图2A。NADPH氧化酶p22phox亚基的蛋白表达200μg/ml处理组1(4.33±0.23)比对照组1(1.00)增强;抗RAGE中和抗体组1(1.01±0.14)、坎地沙坦组1(0.99±0.13)比200 μg/ml处理组1(4.33±0.23)降低,图2B。上述比较差异均有统计学意义(P<0.05)。
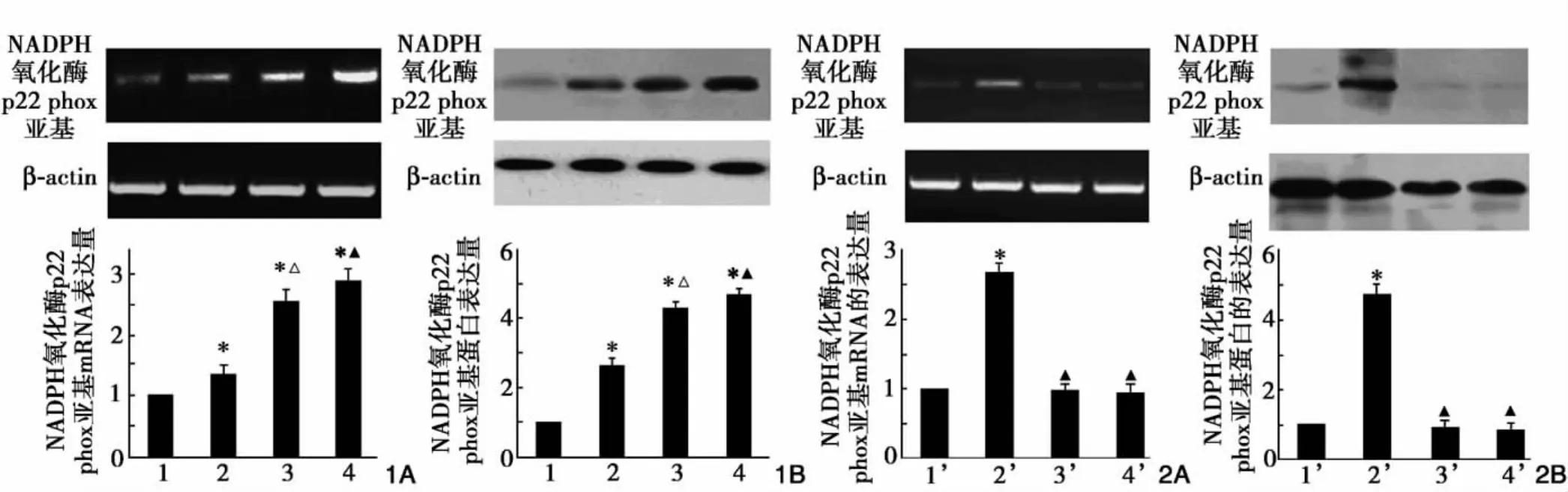
图1 不同AGE-HSA对血管外膜成纤维细胞NADPH氧化酶p22phox亚基mRNA和蛋白表达的影响(n=3)1A NADPH氧化酶p22phox亚基mRNA的表达 1B NADPH氧化酶p22phox亚基蛋白的表达 1:对照组;2:100μg/ml AGE-HSA组;3:200μg/ml AGE-HSA组;4:300μg/ml AGE-HSA组 与对照组比较*P<0.05;3组与2组比较△P<0.05 图2 不同干预因素对AGE-HSA上调血管外膜成纤维细胞p22phox表达的影响(n=3)2A 逆转录—聚合酶链反应分析结果 2B 蛋白质印迹分析结果 1’:对照组1;2’:200μg/ml has处理组1;3’:抗RAGE中和抗体组1;4’:坎地沙坦组1 与对照组比较*P<0.05 与2组比较△P<0.05 β-actin:β-肌动蛋白 AGEHSA:糖基化人血清白蛋白 mRNA:信使核糖核酸
不同干预因素对血管外膜成纤维细胞内活性氧的影响:200μg/ml处理组2(2.62±0.31)比空白对照组(1.00)血管外膜成纤维细胞内活性氧相对荧光强度明显增强;抗RAGE中和抗体组2(0.73±0.33)、夹竹桃素组(0.82±0.20)、坎地沙坦组2(0.93±0.31)比200 μg/ml处理组2(2.62±0.31)血管外膜成纤维细胞内活性氧相对荧光强度降低,差异均有统计学意义(P<0.05)。
3 讨论
目前,关于AGE对血管外膜成纤维细胞NADPH氧化酶及活性氧的影响较少报道,本研究就以此为着眼点进行探讨,揭示其影响机制。
本研究发现,AGE-HSA可使血管外膜成纤维细胞的NADPH氧化酶p22phox亚基表达增加,从而促使NADPH氧化酶激活。RAGE中和抗体、血管紧张素Ⅱ受体阻滞剂(ARB)类坎地沙坦预处理均可起到抑制AGE所致NADPH氧化酶亚基p22phox上调;RAGE中和抗体可部分阻断AGE与RAGE的结合,实验结果提示AGE可能通过RAGE影响NADPH氧化酶p22phox亚基,从而影响氧化应激。研究还发现,AGEHSA可上调血管外膜成纤维细胞内活性氧的产生。NADPH氧化酶拮抗剂、RAGE中和抗体、坎地沙坦可抑制活性氧的产生。AGE可能通过AGE-RAGE-氧化应激途径发挥重要生理作用。研究结果提示阻断AGE-RAGE交互作用,抑制AGE产生,抑制RAGE表达以及干预其下游通路等可抑制AGE所致氧化应激。
NADPH氧化酶是体内重要的氧化酶,参与了动脉粥样硬化的发生和发展过程[3]。NADPH氧化酶p22phox亚基蛋白作为NADPH氧化酶的亚单位,在维持酶活性和合成活性氧的过程中起关键作用[4,5],活性氧是调节血管结构和功能状态的重要信号分子,介导对其敏感的转录因子及炎症因子的表达,促进动脉粥样硬化病变形成[6,7]。夹竹桃素通过抑制 NADPH氧化酶各亚基的聚集而特异性抑制该酶的活性,减少活性氧的产生和氧化应激的程度。本研究发现夹竹桃素可抑制 AGE所致活性氧表达增加,阻断 AGERAGE-氧化应激信号通路可减少活性氧的表达。AGE发挥其生物学效应主要由RAGE介导,和RAGE相互作用后激活NADPH氧化酶,产生活性氧,并引起核因子NF-κB的激活,NF-κB的激活可诱导产生多种损伤因子。这即为AGE-RAGE-氧化应激轴的作用机制。Yamagishi等[8]指出糖尿病血管并发症是一种加速的动脉粥样硬化,干预AGE-RAGE-氧化应激轴,是治疗糖尿病血管并发症的新策略。
研究表明,血管紧张素Ⅱ通过增强NADPH氧化酶的活性而增加活性氧的产生[9],血管紧张素Ⅱ受体阻滞剂可下调NADPH氧化酶表达的作用,在减轻氧化应激中发挥重要作用[1]。我们的相关研究发现AGE可上调RAGE的表达,且呈剂量相关性,坎地沙坦可以抑制该效应[10],本研究发现坎地沙坦预处理可起到抑制AGE所致NADPH氧化酶亚基p22phox上调作用,且抑制活性氧的表达,提示该效应可能为坎地沙坦抑制RAGE的表达,从而抑制AGE-RAGE的相互作用,影响NADPH氧化酶p22phox亚基的表达及活性氧的表达。
总之,本研究揭示AGE可使血管外膜成纤维细胞的NADPH氧化酶p22phox亚基表达上调,从而引发氧化应激。坎地沙坦可干预该作用,从而减弱氧化应激,推测可能对改善糖尿病患者血管重塑、减轻血管炎症有一定的作用,抗氧化治疗是糖尿病患者预防和治疗动脉粥样硬化可选择的靶点。
[1] Madamanchi NR,Vendrov A,Runge MS.Oxidative stress and vascular disease.Arterioscler Thromb Vasc Biol,2005,25(1):29-38.
[2] Papaharalambus CA,Griendling KK.Basic mechanisms of oxidative stress and reactive oxygen species in cardiovascular injury.Trends Cardiovasc Med,2007,17(2):48-54.
[3] Bayraktutan U.Coronary microvascular endothelial cell growth regulates expression of the gene encoding p22-phox.Free Radic Biol Med,2005,39(10):1342-1352.
[4] Collins-Underwood JR,Zhao W,Sharpe JG,et al.NADPH oxidase mediates radiation-induced oxidative stress in rat brain microvascular endothelial cells.Free Radic Biol Med,2008,45(6):929-938.
[5] Ding H,Aljofan M,Triggle CR.Oxidative stress and increased eNOS and NADPH oxidase expression in mouse microvessel endothelial cells.JCell Physiol,2007,212(3):682-689.
[6] Shen WL,Gao PJ,Che ZQ,et al.NAD(P)H oxidase-derived reactive oxygen species regulate angiotensin-Ⅱinduced adventitial fibroblast phenotypic differentiation.Biochem Biophys Res Commun,2006,339(1):337-343.
[7] 何晋,谢秀梅,陈晓彬,等.非对称性二甲基精氨酸诱导内皮祖细胞氧化应激损伤及L-精氨酸的保护作用.中国循环杂志,2008,23(1):66-69.
[8] Yamagishi S,Nakamura K,Matsui T,etal.Agents thatblock advanced glycation end product(AGE)-RAGE(receptor for AGE)-oxidative stress system:a novel therapeutic strategy for diabetic vascular complications.Expert Opin Investig Drugs,2008,17(7):983-996.
[9] 刘雪平,张桂茹,祝玮玮,等.贝那普利对老龄自发性高血压大鼠血管糖基化终末产物形成及血管损伤的抑制.中国循环杂志,2008,23(2):139-142.
[10] Liu YY,Liang C,Liu X,etal.AGEs increasedmigration and inflammatory responses of adventitial fibroblasts via RAGE,MAPK and NF-kappaB pathways.Atherosclerosis,2010,208(1):34-42.
(助理编辑:曹洪红)
Effect of Advanced Glycation End Products on NADPH Oxidase Subunit p22phox Expression and Reactive Oxygen Species Production in Vascular Adventitial Fibroblasts in Rats
LIU Ya-yang,LIHe,WU Zong-gui,TANG Xi-you.
Department of Cardiology,The 73071 Hospital of Chinese PLA,Xinyi(221400),Jiangsu,China Corresponding Author:LIU Ya-yang,Email:liuyayang@gmail.com
Advanced glycation end-products;Receptor for advanced glycation end products(RAGE);Vascular adventitial fibroblasts;Nicotinamide adenine dinucleotide phosphate(NADPH)oxidase;Subunit p22phox.
221400 江苏省新沂市,中国人民解放军73071部队医院 心内科(刘亚洋),江苏省淮安市中医院(李鹤),上海第二军医大学第二附属医院 心内科(吴宗贵),中国人民解放军第八二医院 心内科(汤锡友)
刘亚洋 主治医师 博士 主要从事冠心病防治研究 Email:liuyayang@gmail.com 通讯作者:刘亚洋
R541
A
1000-3614(2012)03-0228-04
10.3969/j.issn.1000-3614.2012.03.021Abstract
2011-06-30)
·难忘病例·
