500例可疑医疗器械不良事件报告分析
2012-02-02李爱军王琦霞
李爱军,王琦霞
(德州市食品药品监督管理局直属分局,山东德州253023)
开展医疗器械不良事件监测工作,是确保上市后医疗器械安全有效、促进临床合理用械和保证公众生命安全的重要手段.随着医疗器械不良事件监测工作的深入,医疗器械不良事件逐步被公众了解和认识.为更好地开展医疗器械不良事件监测,及时发现疑似医疗器械不良事件,以便有效控制和干预安全隐患,切实保证用械安全,现就德州市食品药品监督管理局直属分局2011年度收到的前500例有效可疑医疗器械不良事件监测报告进行分析.
1 各项监测数据及分析
截止2011年10月,德城区医疗器械不良事件监测站共收到可疑医疗器械不良事件报告523例,经审核评价,符合要求的有效报告500例.通过国家医疗器械不良事件监测系统下载数据,依据国家食品药品监督管理局制定的《医疗器械分类目录》对涉及的器械进行分类,对不良事件涉及的报告日期、报告来源、患者特征、医疗器械类别和数量、不良事件主要表现等进行统计,对不良事件的发生原因进行分析[1~3].
1.1 报告日期 2011年监测的前500例医疗器械不良事件报告时间分布不均衡,参考下表可见:一是年初监测工作思想松懈,第一季度无报告.二是中期报告数量较多,究其原因与其中进行的监测工作开展情况通报及督导有关.三是后期上报较集中,监测效果明显(见图1).
1.2 报告来源 来源于医疗器械经营企业的报告有39例,使用单位上报461例,可以看出,医疗机构仍然作为医疗器械不良事件报告的主要来源,在不良事件监测中发挥着重要作用.
1.3 各单位上报情况 市立医院120例,联合医院66例,运河卫生院45例,区妇幼保健院28例,袁桥卫生院18例,抬头寺卫生院16例,计生服务站12例,赵虎卫生院11例,宋官屯卫生院11例,新华卫生院10例,二屯卫生院4例,天衢卫生院3例,黄河涯卫生院2例,其他使用单位118例,经营单位36例.可以看出二级以上医疗机构尤其是市立医院、联合医院监测工作态度积极、措施得力、成效突出,各镇街卫生院工作进展不平衡,个别卫生院进度缓慢.
1.4 患者性别及年龄 前500例报表中,患者为男性的有275例,占55%,女性的为216例,约占43%,不涉及患者的有9例,约占2%.患者男女比例为1.27∶1,男性略多于女性.
涉及患者年龄分布方面,21~30岁年龄段患者比例最高,占27.6%,其次为31~40年龄段,占19.8%.可以看出,医疗器械在使用时发生不良事件时患者年龄主要集中分布在21~40岁,且成年患者除60至70年龄段略有增加外有逐段减少的趋势(见图2).
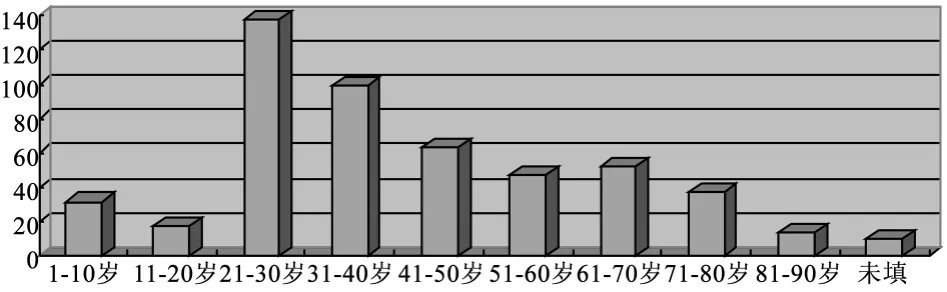
图2 发生不良反应患者年龄分布图
1.5 事件后果 从前500例报表的事件后果来分析,选择“其他”的有473例,选择“需要内外科治疗避免永久损伤”的有27例,无死亡病例.其中,“需要内外科治疗避免永久损伤”的医疗器械主要为宫内节育器.
1.6 器械分类 前500例医疗器械不良事件报告中,涉及一类医疗器械的有92例,占18.4%,二类医疗器械有116例,占23.2%,三类医疗器械有292份,占58.4%.二类与三类医疗器械比重均较往年有一定提高,表明对高风险器械的监测力度有所提高,为提高监测报告的可利用度、开展分析评价工作打下良好基础.
1.7 产品主要分布 笔者将多于10例的医疗器械不良事件报告分类进行统计,前6位发生不良事件最多的医疗器械类别、主要分布及其数量(见表1).

表1 医疗器械不良事件统计表(不良事件>10例)
1.8 操作人员 选择“专业人员”的报告有487例,占97.4%,选择“患者”的报告有13例,占2.6%,其中患者报告的事件主要分布在隐形眼镜、橡皮膏、血压计等医疗器械.
1.9 初步原因分析 笔者进行汇总统计发现,在500例医疗器械不良事件中,由于产品质量问题、患者自身原因或操作不当引发的不良事件占到全部的86%,其中,由产品质量问题引发的不良事件有343例,由于患者产生过敏反应的事件有73例,患者对医疗器械产生排异反应的有14例,由于医疗器械操作不当引起的事件有6例.
1.10 事件报告状态 经统计,经营企业上报共39例不良事件中,均只通知了经营企业和药监部门.而在使用单位上报的461例报告中,仅通知使用单位和药监部门的有253例,另外又通知生产企业的有14例,通知经营企业的有192例,同时通知生产企业和经营企业的有2例.可见医疗机构在发生医疗器械不良事件后通知产品生产企业及经营企业的意识较高.
1.11 报告人类别 经统计,前500例报告中,报告人为医师的有243例,占48.6%,为技师的有33例,占6.6%,为护士的有224例,占44.8%.
2 多发及重点监测器械分布及主要事件表现
此次分析的500例不良事件报告中,医用高分子材料及制品、注射穿刺器械、医用卫生材料等种类发生数量较多,静脉留置针、隐形眼镜、植入器材等品种作为重点监测品种,比重较往年有所提升,笔者就其产品信息、不良事件主要表现等问题做了详细统计,就其发生原因作一分析.
2.1 一次性使用输液器引发不良事件共116例,占总数23.2%.
2.1.1 厂家分布 经统计,一次性使用输液器的厂家分布相对比较集中,主要有以下生产企业:河南圣光医用制品有限公司44例,山东威高集团医用高分子制品股份有限公司21例,山东新华安得医疗用品有限公司13例,江西洪达医疗器械集团有限公司11例,茌平医光医疗器械有限公司10例,河南莲花医疗用品有限公司7例,山东康利莱医疗器材有限公司5例,洪湖泰宁医疗器械有限公司2例,漯河曙光医疗器械有限公司2例,江西庐乐医疗器械有限公司1例.
2.1.2 主要事件表现 一次性使用输液器发生的不良事件主要表现有以下几种:①漏液42例,主要是药液过滤器与管路结合处、茂菲氏滴管上端与管路结合处等发生漏液现象;②输液针针头问题22例,主要表现有堵塞、弯曲、无保护套、无针头、松动等;③外包装漏气16例,究其原因与产品质量问题或运输中受挤压等因素有关;④流量调节器问题16例,主要表现为失控现象.
2.1.3 发生原因分析 主要为产品质量缺陷、器械设计、器械材料等问题及产品运输不当所致.
2.2 注射类器械引发不良事件83例,占总数16.6%.其中一次性使用注射器59例,一次性使用配药注射器17例,一次性使用溶药注射器7例.
2.2.1 厂家分布 山东新华安得医疗用品有限公司30例,河南圣光医用制品有限公司24例,河南曙光健士医疗器械集团有限公司12例,河南莲花医疗用品有限公司6例,常州悦康医疗器材有限公司3例,枣庄东大医疗器材有限公司3例,洪湖泰宁医疗器械有限公司1例,江西洪达医疗器械集团有限公司1例,山东康利莱医疗器材有限公司1例,陕西海达医疗器械科技有限公司1例,盐城市输液器厂1例.
2.2.2 主要事件表现 ①注射针针头问题引发的不良事件26例,主要有松动、不通畅、无保护套、无尖、钝、无针头、带钩、无斜面等;②包装问题12例,表现为一次性包装破损漏气;③裂缝问题8例,集中在外套有裂缝;④芯杆问题8例,表现为芯杆断裂、滑脱;⑤活塞与芯杆分离3例;⑥漏液问题2例,主要表现为注射针针栓处、注射针与外套连接处漏液.
2.2.3 发生原因分析 主要为产品本身质量原因、运输储藏环境不符合要求等.
2.3 医用卫生材料及敷料共80例,占总数16%,其中敷料、护创材料共37例,粘贴材料43例,主要产品有胶带、绷带、橡皮膏、敷贴等.
2.3.1 事件表现 主要有黏性差、红肿、瘙痒、皮疹、黏性过强不易撕下、灼热、分割不完全等.
2.3.2 应对措施 主要有服用、涂抹抗过敏药物、停用、更换等措施,未给患者造成严重伤害.
2.3.3 发生原因分析 主要为产品质量问题、患者敏感体质、温度低、皮肤潮湿等因素.
2.4 一次性使用导尿包引发不良事件20例,占总数4%,主要事件表现为包内无手套、单向阀堵塞、导尿管堵塞、无尿袋、纱布变质、球囊破裂、手套破损、尿道口红肿瘙痒等,应对措施主要为停用、更换及抗感染治疗,分析其发生原因主要为产品质量问题、储存或运输不当、留有致敏原、患者过敏反应等.
2.5 静脉留置针作为重点监测品种,引发不良事件22例,主要事件表现为针头钝、不通畅、弯曲、带钩、肝素帽脱落、与输液器连接处漏液、穿刺部位红肿、瘙痒等,究其发生原因主要为产品质量部合格、储存或运输不当、无菌操作不规范、患者过敏体质等因素.
2.6 隐形眼镜及其护理液引发的不良事件32例,其中隐形眼镜22例,主要表现为边缘不圆滑、异物感、干涩流泪、充血、刺痛感、发红、模糊、视力下降、结膜炎.经统计,其发生原因有患者排异反应、超时佩戴、操作不当、手未洗净、护理清洗不当、基弧不准、佩戴不当等引起.另外接收到10例隐形眼镜护理液引发的不良事件,主要表现为充血、发红、瘙痒、流泪、异物感、刺痛感,由顾客产生排异反应、过敏反应、操作不卫生等原因造成.
2.7 作为重点监测品种,植入器械引发的不良事件有2例,产品为金属髓内针、接骨板,主要事件是手术部位疼痛、瘙痒、红肿,原因分析主要是患者产生排异或过敏反应,主要是采取药物进行抗过敏治疗,没有引起严重伤害.
2.8 宫内节育器14例,主要事件有下移、腰酸、腹痛、阴道分泌物增多、月经量增加、时间延长、月经淋漓不尽、阴道不规则流血、下腹坠痛,伤害程度均选择“需要内、外科治疗避免上述永久损伤”,最终结果为取器.判断其发生原因主要为节育器对子宫产生机械性刺激引发内膜炎症、节育器与子宫一致性差等原因.
3 医疗器械不良事件报告质量分析
对500例医疗器械不良事件报告进行质量评估结果表明,全区可疑医疗器械不良事件报告总体质量较好,患者信息和医疗器械信息可追溯,事件主要表现、事件陈述等事项填写较为完整,危害性质的可识别性也较好.但个别报表在审核通过前的填写上还存在如下问题:
3.1 报告单位信息填写不完整 主要表现为单位名称填写不规范、联系地址空白.
3.2 个别患者信息填写不完整 主要是患者联系方式未填写、预期治疗疾病空白或不准确.
3.3 医疗器械产品信息填写不准确 主要为医疗器械产品名称不准确、注册证号填写不规范、注册证号与产品执行标准号混淆、产品批号空白等.
3.4 事件陈述不够详细 一方面因为报告人对器械部位名称、医学术语不熟悉;另一方面填报系统中的基础数据库如诊断学名次、器械故障名词等未建立.
3.5 上报时间滞后 按相关规定,一般医疗器械不良事件报表应于发现或知悉之日起15个工作日内上报,造成严重伤害的应在5个工作日内报告,大多数报表上报时间滞后,一般为30日左右,这就影响到早期信号的提取、预警,也为关联性评价增加了难度.
[1] 山东省药品不良反应监测中心,山东省2010年度药械安全性监测报告[R].2011.4.
[2] 山东省药品不良反应监测中心,山东省2009年度药械安全性监测报告[R].2010.5.
[3] 孔庆衍,周勇,田月洁,等.239例医疗器械不良事件报告分析[J].中国药物警戒,2008,5(1):19-23.
