Wnt信号通路在前列腺癌中的研究进展
2012-02-01郑润泉栾兆辉秦云龙李玉红解放军第三军医大学学员旅四队重庆400038
郑润泉 栾兆辉 秦云龙 李玉红 (解放军第三军医大学学员旅四队,重庆 400038)
Wnt信号通路在前列腺癌中的研究进展
郑润泉 栾兆辉 秦云龙 李玉红1(解放军第三军医大学学员旅四队,重庆 400038)
Wnt信号通路;前列腺癌;肿瘤干细胞;骨转移
前列腺癌在世界癌症总发病数中占十分之一,全球范围内每年约有20万患者死于前列腺癌〔1〕。前列腺癌的发病原因迄今仍不清楚,越来越多的研究发现Wnt信号通路在前列腺癌发生发展中具有非常重要的作用。本文对Wnt信号通路在前列腺癌发生发展中的作用进行综述。
1 Wnt信号通路概述
Wnt信号通路是细胞增殖和分化的关键。它通过正向和负向的自我反馈调节构成了一个复杂的网络。Wnt信号通路分为经典的和非经典的Wnt信号通路。研究最多的是经典的Wnt信号,它通过经典的 Wnt配体(Wnt1,Wnt3A,Wnt8,and Wnt8b)组成一个包括Frizzled(Fzd)跨膜受体和LRP5/6复合受体(low-density lipoprotein receptor related protein 5/6)的三元复合体〔2,3〕。其中Fzd跨膜受体是卷曲蛋白,为7次跨膜蛋白,结构类似于G蛋白耦联型受体,LRP5/6属于低密度脂蛋白受体。Wnt蛋白与Fzd手提及辅助受体LRP5/6结合激活Wnt信号通路。Wnt蛋白与半胱氨酸的结构域结合作用于胞内的Dsh蛋白从而阻断胞质蛋白(β-catenin)的降解途径,从而使胞内βcatenin积累并进入细胞核。与T细胞因子/淋巴增强子因子(TCF/LEF)相互作用,调节靶基因的表达。
非经典 Wnt信号通路包括 Wnt/Jnk、Wnt/Rho、Wnt/Ca2+等信号通路。非经典的Wnt配体(Wnt4,Wnt5a和Wnt11等)释放的不是β-catenin,而是一些特殊信号〔4〕。比如在哺乳动物中,ROR家族受体酪氨酸激酶已显示出作为Wnt5a受体或辅助受体,以调节非经典Wnt信号〔5〕。非经典信号激活Rho、Rac、JNK、PKC或Ca2+等,编码结合到LRP5/6的Wnt信号,分泌拮抗剂D ICKKOPF21(DKK21)并诱导其吞噬,导致经典Wnt信号通路抑制,与经典Wnt信号通路形成负反馈环路〔6〕。
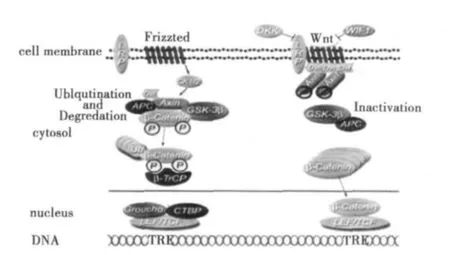
图1 Wnt/β-catenin信号通路示意图〔4〕
2 Wnt信号通路与前列腺癌
2.1 Wnt配体与前列腺癌 在晚期的前列腺癌细胞,几种Wnt配体表达水平发生了改变。Wnt1和β-catenin高水平的表达和前列腺癌骨转移、雄激素非依赖性有关,然而正常的前列腺组织中不存在β-catenin〔7〕。其他研究也表明Wnt1在前列腺癌发生淋巴结转移和骨转移时高水平表达〔8〕。在前列腺癌细胞系中,有研究者发现Wnt-3a选择性地刺激雄激素依赖的前列腺癌细胞分化〔9〕。随着前列腺癌进展,Wnt11在前列腺癌中高表达从而导致前列腺癌细胞神经内分泌样分化且其侵袭、转移能力增强〔10〕。人类前列腺癌中也发现了Wnt配体如Wnt2和Wnt5a的过度表达。Wnt5a提高细胞内游离钙浓度,而且CaMKⅡ在前列腺癌细胞系也增多,表明在前列腺癌中,Wnt/Ca2+通路通过CaMKⅡ最终诱导细胞骨架重组和增加细胞运动。Wnt5a在人类前列腺癌细胞中的过度表达刺激其侵袭行为。通过免疫组化发现,Wnt5a在28%的前列腺癌中不正常表达,并且确实和前列腺癌的格里森评分、恶化相关〔11〕。
2.2 Wnt信号通路与前列腺肿瘤干细胞 越来越多的学者认为肿瘤是一种干细胞疾病,近年来的研究热点也逐渐集中于肿瘤干细胞(TSC)方面。肿瘤干细胞即肿瘤中具有自我更新能力并且能产生异质性肿瘤细胞的细胞〔12〕,是存在于肿瘤内的极少数细胞,这些细胞具有无限增殖、自我更新及多向分化潜能。它们是肿瘤的种子,是肿瘤无限增殖、复发和转移的根源〔13〕。Collins等〔14〕从不同Gleason分级及转移的前列腺癌标本中分离出一类细胞,现被充分认为是前列腺癌肿瘤干细胞,约占肿瘤细胞的0.1%,其分子标记是CD44+/-β-hi/CD133+,具有很强的再生能力,产生表型为杂合状态的前列腺癌,表达AR及PAP。CD44阳性的前列腺癌细胞与CD44阴性的前列腺癌细胞比较,具有更强的增殖能力、克隆形成能力、致瘤能力及转移能力。其致瘤性较CD44阴性细胞强100倍〔15〕。CD44阳性前列腺癌细胞多表达β-catenin,而β-catenin在Wnt信号途径中起主要作用,Wnt信号通路的异常激活与前列腺癌的发生与发展相关〔16〕。肿瘤干细胞具有在远隔部位或相邻区域形成新的转移灶的能力与肿瘤的侵袭与转移密不可分。Wnt信号在决定着肿瘤转移的肿瘤干细胞中扮演重要角色。Brabletz等〔17〕研究发现与间质毗邻的侵袭前沿的肿瘤细胞内出现βcatenin的核累积,出现β-catenin核累积的肿瘤细胞细胞周期阻滞和上皮间充质转化,表现为不再表达E-钙黏素,而表达间充质细胞的标志纤维结合蛋白〔18〕,这些所谓的“转移肿瘤干细胞”可能重获自我更新及分化的能力,以至于使他们能短暂的逆分化而易于侵袭邻近组织,并最终通过间充质-上皮细胞转化而在远隔器官形成转移灶〔19〕。
2.3 Wnt信号通路与雄激素受体 根据治疗和发展过程,前列腺癌分为激素依赖性和激素非依赖性,都与AR有密切关系。研究发现β-catenin能与AR结合,并能有效地协助AR诱导AR调控基因的表达〔20〕。理论上β-catenin和AR结合只有在雄激素存在的情况下才会发生,但β-catenin能诱导AR构象变化,导致AR对配体的“要求”显得不那么高,平时一些不能与AR结合的配体(如雄烯二酮、雌二醇)也能结合到AR上并调节雄激素调控基因的表达〔21,22〕。另外,Chesire 等〔23〕发现在雄激素存在的情况下,β-catenin主要与AR结合,从而增强AR调控基因的转录活性。故AR在极低浓度雄激素条件下也具有激活转录活性的功能。前列腺癌中,Wnt通路异常激活会造成β-catenin的积累,可能在前列腺癌由雄激素依赖转变为非依赖性的发展中起重要作用。Wang等〔24〕发现GSK-3β还能作为负性调控因子作用于AR,使AR相关调控基因表达下调。该研究发现在LNCaP细胞中,诱导GSK-3β高表达能减少前列腺特异性抗原(PSA)及其他雄激素调控基因的表达;在前列腺癌细胞中加入LiCl(抑制GSK-3β活性)后,AR活性都得到了增强。Wnt信号通路被激活能将GSK-3β磷酸化并抑制其活性,从而导致一系列的变化。以上这些信息都提示Wnt信号通路在前列腺癌病程发展中起着非常重要的作用。前面已述,Wnt信号通路是通过TCF/LEF来调节相关基因的表达。Yang等〔25〕发现在AR基因上游DNA序列中有8个潜在的TCF结合位点,其中3个位点在Wnt信号通路激活的情况下能结合βcatenin,表明AR基因是受LEF-1/TCF调节的,通过半定量RTPCR检测发现LNCaP、CWR22rv-1细胞系中AR mRNA表达提高至正常前列腺细胞的12~16倍,表明激活的Wnt信号通路对AR基因的转录具有较强的上调作用。此外,Takahashi等〔26〕发现,Wnt信号非经典通路中的Wnt5a敲除以后,AR受体的反式激活作用减落。另外,sFRP4是Wnt受体抑制剂,能抑制Wnt信号通路激活从而影响 AR调控基因的表达〔27〕。sFRP1是Wnt受体抑制剂,能直接负性调控AR从而调节相关基因表达〔28〕。
2.4 Wnt信号通路与前列腺癌骨转移 在转移性前列腺癌患者中,有大约90%的病人是骨转移。X光片发现90%的前列腺癌骨转移灶存在骨的硬化〔29〕。硬化灶的出现是由于癌细胞侵入骨后,骨重建增强所致。经典的Wnt信号通路减少细胞内β-catenin的降解,增多的β-catenin与与DNA结合蛋白TC/LEF结合,在核内共同调控靶基因的表达,从而诱导骨的形成〔30〕。Wnt信号能诱导骨保护素(OPG)和内皮缩血管肽(ET)-1的形成〔31〕。OPG是RANKL的诱导受体,能阻止 NF-核因子配体(RANKL)和RANK受体结合,从而抑制破骨细胞的功能,ET-1刺激破骨细胞增殖分化,降低破骨细胞的稳定性和活性〔32〕。DKK作为Wnt信号通路的抑制分子。在前列腺癌诱导溶骨性骨转移的实验中发现了高水平表达的DKK-1,而在前列腺癌诱导成骨性骨转移的实验中没有发现〔33〕。这与起初的时候DKK-1增强溶骨性活动,而后DKK-1低水平表达,从而失去了对Wnt信号通路的抑制,结果导致骨的硬化。另外,实验发现,阻断Wnt信号,可以使前列腺癌溶骨性的骨转移变为成骨性的骨转移〔34〕,提示Wnt信号通路在前列腺癌成骨性的骨转移中发挥重要作用。
2.5 Wnt信号通路与其他前列腺癌相关通路之间的联系TGF-β是一种抑癌基因,但其表达和激活方式的缺陷及TGF-β(转化生长因子-β)受体或受体后水平缺陷都可导致生长抑制作用消失而导致细胞恶性增殖,故TGF-β作为肿瘤抑制基因和癌基因的双重角色存在。Wikstrom等〔35〕研究发现,前列腺癌标本中TGF-β表达增高、转化生长因子-β受体Ⅱ(TβRⅡ)表达降低、肿瘤的血管计数与肿瘤转移呈正相关,提示TGF-β可能通过刺激促血管生成因子如VEGF等生成,间接促进肿瘤血管形成,增加前列腺癌的转移能力,李伟等〔36〕发现,Wnt信号通路通过上调cyclinD1(细胞周期蛋白D1)的表达拮抗TGF-β对PC-3细胞(前列腺癌PC-3细胞)生长抑制作用,同时通过激活TGF-β诱导VEGF(血管生成因子)表达功能促进血管的生成。新生血管的形成对前列腺癌的生长及侵袭转移至关重要,肿瘤血管为前列腺癌提供必需的营养和氧,而前列腺癌细胞又可渗入血管向远处转移。
3 展望
前列腺癌发生是一个多因素作用、多基因参与、经过多个阶段才最终形成的极其复杂的生物学现象。上文综述了Wnt信号通路在前列腺癌肿瘤干细胞、AR、前列腺癌骨转移以及和其他与前列腺癌有关的通路的协调等方面影响前列腺癌的形成、发展。尽管Wnt信号通路对前列腺癌发生发展机制的研究尚处于初步阶段,相信随着对该信号通路对前列腺癌调节认识的不断深入,必将有利于以后针对前列腺癌靶向调控治疗,从而达到预防和治疗前列腺癌的目的。
1 Folly R.Hollywood D,Lawler M.Molecular pathology of prostate cancer:the key to identifying new biomarkers of disease〔J〕.Endocr Relat Cancer,2004;11(3):477-88.
2 Filipovich A,Gehrke I,Poll-Wolbeck SJ,et al.Physiological inhibitors of Wnt signaling〔J〕.Eur JHaematol,2011;86(6):453-65.
3 刘 洋,张晨光,周春燕.经典Wnt/β-catenin信号通路中的双向调控〔J〕. 北京大学学报(医学版),2010;42(2):238-42.
4 KharaishviliG,Simkova D,Makharoblidze E,etal.Wnt signaling in prostate development and carcinogenesis〔J〕.Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2011;155(1):11-8.
5 Minami Y,Oishi I,Endo M,et al.Ror-family receptor tyrosine kinases in noncanonicalWnt signaling:their implications in developmentalmorphogenesis and human diseases〔J〕.Dev Dyn,2010;239(1):1-15.
6 徐 东,杨小龙.Wnt21或Wnt/beta-catenin信号通路在恶性肿瘤中的研究进展〔J〕.现代诊断与治疗,2010;21(4):214-7.
7 Chen G,Shukeir N,Potti A,et al.Up-regulation ofWnt-1 and beta-catenin production in patients with advanced metastatic prostate carcinoma:potential pathogenetic and prognostic implications〔J〕.Cancer,2004;101:1345-56.
8 Chen G,Shukeir N,Potti A,et al.Up-regulation ofWnt-1 and beta-catenin production in patients with advanced metastatic prostate carcinoma:potential pathogenetic and prognostic implications〔J〕.Cancer,2004;101(6):1345-56.
9 Cronauer MV,Schulz WA,Ackermann R,et al.Effects of WNT/betacatenin pathway activation on signaling through T-cell factor and androgen receptor in prostate cancer cell lines〔J〕.Intern JOncol,2005;26:1033-40.
10 Uysal-Onganer P,Kawano Y,Caro M,et al.Wnt-11 promotes neuroendocrine-like differentiation,survival and migration of prostate cancer cells〔J〕.Mol Cancer,2010;9:55.
11 Yamamoto H,Oue N,Sato A,et al.Wnt5a signaling is involved in the aggressiveness of prostate cancer and expression of metalloproteinase〔J〕.Oncogene,2010;29(14):2036-46.
12 Clarke MF,Dick JE,Dirks PB,et al.Cancer stem cells-perspectives on current status and future directions:AACR Workshop on cancer stem cells〔J〕.Cancer Res,2006;66(19):9339-44.
13 Dick JE.Breast cancer stem cells revealed〔J〕.Proc Natl Acad Sci U S A,2003;100(7):3547-9.
14 Patrawala L,Calhoun T,Schneider-Broussard R,et al.Highly purified CD44+prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells〔J〕.Oncogene,2006;25(12):1696-708.
15 Li L,Neaves WB.Normal stem cells and cancer stem cells:the niche matters〔J〕.Cancer Res,2006;66(9):4553-7.
16 Collins AT,Berry PA,Hyde C,et al.Prospective identification of tumorigenic prostate cancer stem cells〔J〕.Cancer Res,2005;65(23):10946-51.
17 Brabletz T,Jung A,Hermann K,et al.Nuclear overexpression of the oncop rotein betacatenin in colorectal cancer is localized predominantly atthe invasion front〔J〕.Pathol Res Pract,1998;194(10):701-4.
18 Kirchner T,Brabletz T.Patterning and nuclear beta-catenin expression in the colonic adenoma-carcinoma sequence.Analogies with embryonic gastrulation〔J〕.Am JPathol,2000;157(4):1113-21.
19 Zhang Y,Lin HS.Wnt signaling pathway and cancer stem cell〔J〕.Modern Oncol,2009;17(2):347-50.
20 Truica CI,Byers S,Gelmann EP.Beta-catenin affects androgen receptor transcriptional activity and ligand specificity〔J〕.Cancer Res,2000;60(17):4709-13.
21 Dehm SM,Tindall DJ.Regulation of androgen receptor signaling in prostate cancer〔J〕.Expert Rev Anticancer Ther,2005;5(1):63-74.
22 Javidan J,Deitch AD,Shi XB,et al.The androgen receptor and mechanisms for androgen independence in prostate cancer〔J〕.Cancer Invest,2005;23(6):520-8.
23 Chesire DR,Isaacs WB.Ligand-dependent inhibition of beta-catenin/TCF signaling by androgen receptor〔J〕.Oncogene,2002;21(55):8453-69.
24 Wang L,Lin HK,Hu YC,etal.Suppression of androgen receptor-mediated transactivation and cell growth by the glycogen synthase kinase3 beta in prostate cells〔J〕.JBiol Chem,2004;279(31):32444-52.
25 Yang X,Chen MW,Terry S,et al.Complex regulation of human androgen receptor expression by Wnt signaling in prostate cancer cells〔J〕.Oncogene,2006;25:3436-44.
26 Takahashi S,Watanabe T,Okada M,et al.Noncanonical Wnt signaling mediates androgen-dependent tumor growth in amousemodel of prostate cancer〔J〕.Proc Natl Acad Sci U SA,2011;108(12):4938-43.
27 Horvath LG,Lelliott JE,Kench JG,et al.Secreted frizzled-related protein 4 inhibits proliferation and metastatic potential in prostate cancer〔J〕.Prostate,2007;67(10):1081-90.
28 Kawano Y,Diez S,Uysal-Onganer P,etal.Secreted Frizzled-related protein-1 is a negative regulator of androgen receptor activity in prostate cancer〔J〕.Br JCancer,2009;100(7):1165-74.
29 Perk H,Yildiz M,Kosar A,et al.Correlation between BMD and bone scintigraphy in patients with prostate cancer〔J〕.Urol Oncol,2008;26(3):250-3.
30 Krishnan V,Bryant HU,Macdougald OA.Regulation of bone mass by Wnt signaling〔J〕.JClin Invest,2006;116(5):1202-9.
31 Sun P,Xiong H,Kim TH,et al.Positive inter-regulation between betacatenin/T cell factor-4 signaling and endothelin-1 signaling potentiates proliferation and survival of prostate cancer cells〔J〕.Mol Pharmacol,2006;69(2):520-31.
32 Nelson JB,Hedican SP,George DJ,et al.Identification of endothelin-1 in the pathophysiology of metastatic adenocarcinoma of the prostate〔J〕.Nat Med,1995;1(9):944-9.
33 Schwaninger R,Rentsch CA,Wetterwald A,etal.Lack ofnoggin expression by cancer cells is a determinant of the osteoblast response in bone metastases〔J〕.Am JPathol,2007;170(1):160-75.
34 Hall CL,Bafico A,Dai J,et al.Prostate cancer cells promote osteoblastic bonemetastases through Wnts〔J〕.Cancer Res,2005;65(17):7554-60.
35 Wikstrom P,Damber J,Bergh A.Role of transforming growth factor-be-ta1 in prostate cancer〔J〕.Microsc Res Tech,2001;52(4):411-9.
36 李 伟,辛殿祺,郭应禄.前列腺癌PC-3细胞中Wnt信号通路与TGF-β信号通路相互调节〔J〕.中华泌尿外科杂志,2006;27(1):59-62.
R73
A
1005-9202(2012)16-3579-04;
10.3969/j.issn.1005-9202.2012.16.124
国家自然科学基金资助项目(No.81101208)
1 解放军第三军医大学基础部细胞生物学教研室
李玉红(1980-),男,讲师,主要从事干细胞与再生医学研究。
郑润泉(1989-),男,在读本科,主要从事干细胞与再生医学研究。
〔2011-12-06收稿 2012-03-17修回〕
(编辑 张 慧)
