双相抑郁患者前额叶及海马磁共振质子波谱成像研究☆
2012-02-01贾艳滨,王颖,钟舒明等
双相抑郁患者前额叶及海马磁共振质子波谱成像研究☆
贾艳滨*王颖**钟舒明*徐贵云△凌雪英**刘斯润**黄力**
目的 探讨双相抑郁患者前额叶及海马磁共振质子波谱(protonmagnetic resonance spectroscopy,1HMRS)的代谢物变化特点,为其神经生物学研究提供线索。方法 应用磁共振质子波谱成像技术检测26例双相抑郁患者(患者组)和26例单相抑郁患者及13例健康志愿者(对照组)双侧前额叶白质、前扣带回皮质、海马N-乙酰天门冬氨酸(N-Acetylaspartate,NAA)、胆碱(choline,Cho)、肌酸(creatine,Cr)3 种代谢物,以 Cr为参照物,分别计算双侧NAA/Cr和Cho/Cr比值。 采用SPSS 13.0进行统计处理。 结果 患者组左侧前额叶白质 NAA/Cr(1.65±0.31)低于对照组(2.37 ± 0.36),左侧前额叶白质 Cho/Cr(1.35 ± 0.27)低于对照组(1.65 ± 0.21),差异有统计学意义(P < 0.05);右侧前额叶白质 NAA/Cr、Cho/Cr值与正常对照组差异无统计学意义;患者组双侧前扣带回 NAA/Cr、Cho/Cr值与正常对照组差异无统计学意义;患者组双侧海马NAA/Cr、Cho/Cr值与正常对照组差异无统计学意义;患者组与单相抑郁组的双侧额叶白质、双侧前扣带回皮质、双侧海马NAA/Cr、Cho/Cr值差异均无统计学意义。结论 双相抑郁患者可能存在左侧前额叶神经元功能下降和膜磷脂代谢异常,其代谢物特点存在偏侧化。
双相抑郁 前额叶 海马 磁共振波谱学
双 相 抑 郁 障 碍 (bipolar depressive disorder,BDD)是曾有过躁狂或轻躁狂发作的抑郁发作,尤其在首次发作时经常被误诊为单相抑郁障碍(unipolar depressive disorder,UDD)。 目前大量研究证据表明BDD与UDD比较可能存在着不同的病因学机制[1]。现有神经影像学研究已发现BDD多个脑区的结构和(或)功能异常,包括额叶、丘脑、基底节、及边缘系统,其中以前额叶和海马的改变最为显著[2,3]。 利用 MRS 技术已发现双相抑郁患者存在额叶、海马、扣带回、基底节多个脑区的代谢物水平异常,但结果不尽一致,甚至出现相互矛盾的结果[4,5]。分析其原因可能包括患者发病年龄、病程、药物治疗、及未对单双相抑郁障碍进行区分等。因此本研究选择确诊的非老年BDD患者,在本次发作未进行药物治疗前进行MRS检测,对双侧前额叶白质、扣带回皮质和海马的N-乙酰天门冬氨酸(N-acetylaspartate, NAA),胆碱(choline-containing compounds, Cho)与肌酸(creatine, Cr)3 种代谢物进行半定量分析比较,旨在探讨BDD患者的前额叶白质、扣带回皮质及海马区的代谢特点。希望结果能够为其神经生物学研究提供线索。
1 对象和方法
1.1 研究对象 为2008年6月至2010年6月期间就诊于暨南大学附属第一医院精神科门诊及住院患者。入组标准:①符合美国精神障碍诊断与统计手册第4版双相抑郁和单相抑郁诊断标准;② 汉 密 尔 顿 抑 郁 量 表 (Hamilton Depression,HAMD)17项评分 >17分;③年龄18~60岁。排除标准:①混合型及快速循环型发作;②妊娠及产后抑郁患者;③器质性及精神活性药物所致抑郁;④此次发作后未服用过任何抗抑郁药、抗精神病药物、情感稳定剂、益智药物及电休克治疗或者rTMS治疗者。双相抑郁患者共26例,其中男9例,女 17 例;年龄 18~ 45 岁,平均为(33.93 ± 11.48)岁;HAMD 评分为 18~35 分, 平均 (25.10 ± 5.94)分;总病程 12~ 32 个月,平均为(21.15 ± 11.31)月,此次发作病程为15 d~30 d,平均 (14.20±28.16)d;均为右利手;单相抑郁患者 26 例,其中男8例,女 18例;年龄 18~ 45岁,平均为(32.33±12.44)岁;HAMD 评分为 18~34 分,平均(22.89 ±6.64) 分; 总病程6~30个月, 平均为 (19.67±14.25)月,此次发作病程为 21 d~45 d,平均(16.35 ± 35.33)d;均为右利手。 研究经由暨南大学附属第一医院伦理委员会审核批准,所有患者签署知情同意书。
对照组为自愿参加本研究的健康人。既往无精神病史或精神病阳性家族史,无情感障碍,无颅脑外伤、器质性精神障碍、酒精依赖等病史。由精神科医生晤谈后确认目前及既往无抑郁发作。共13名,其中男 6 名,女 7 名;平均年龄为(31.45 ±12.44)岁;HAMD17评分 < 8 分;均为右利手。
研究对象在性别、年龄、受教育程度等方面差异无统计学意义(P>0.05),具有良好的可比性。受试者本人或其监护人已详细了解本研究,并签署知情同意书。
1.2 方法
1.2.1 MRI检查 使用美国 GE公司 Sigma HD 1.5TMRI扫描仪,采用头颈8通道相控阵线圈。受试者头部采用海绵垫固定,以避免运动伪影,精确摆位,尽量达到中线居中,两侧对称。常规均行轴位 T1加权像(TIW1)和 T2加权像(T2W1)及液体衰减反转恢复序列扫描。由2名经验丰富的影像科医师对常规MRI图像进行诊断,未发现显著形态学异常者进入后续的扫描序列。
1.2.2 2 D1H-MRS扫描 首先选择 T2W1作为 MRS定位相,横轴位扫描,参数为:重复时间(TR)=5000,回波时间(TE) = 113ms,激发次数(NEX) =1,层厚=5mm,层距=0mm。在轴位T1WI图上确定兴趣区(volume of interest,VOI),额叶 VOI 选取双侧侧脑室前角的前方白质及扣带回前部,尽量避开侧脑室和脑沟内脑脊液的影响;海马VOI选取海马头部为中心位置的层面,尽量避开接触颅底结构。多体素2D1H-MRS检查采用定点分辨波谱序列,TR = 1000ms,TE = 144ms,NEX = 1,视野 =24 cm×24 cm,矩阵=18×18,饱和VOI周围头皮脂肪及空气,控制水峰的半高全宽<10 Hz,水抑制 >98%,扫描时间5min 28 s。
1.2.3 影像分析 MRS数据经 GE AW4.2工作站后处理得不同代谢物在扫描区内的分布彩图,并把代谢图和定位MRI图进行重叠。在双侧额叶白质、前扣带回、海马头,选择最小体素(1体素 =56.2mm3)作为测量单位,获得该区脑组织2D1HMRS曲线,测量各脑区 NAA、Cho、Cr峰下面积,同时计算NAA/Cr、Cho/Cr比值。由1名有经验的影像科医师在不了解被检查者任何临床资料的情况下完成所获图像及数据的处理,排除取样部位的偏差,明确谱线的稳定性。
1.3 统计学方法 使用SPSS 13.0统计软件进行统计分析。数据以(±s)表示,对数据进行方差齐性分析,一致性检验,患者组与对照组之间各代谢物比较采用组间独立样本t检验等统计分析。以P<0.05为差异有统计学意义。
2 结果
2.1 MRS定位图及谱线图 本研究采用饱和VOI周围头皮脂肪及空气,控制水峰的半高全宽<10 Hz,水抑制 >98%,预扫描达到上述标准,扫描均成功。见图1-3
2.2 患者组与对照组双侧前额叶白质、前扣带回皮质、海马1H-MRS代谢物水平的比较 与对照组相比,患者组左侧前额叶白质NAA/Cr低于对照组,左侧额叶白质Cho/Cr低于对照组,差异有统 计 学 意 义 (t = -2.88,P < 0.01;t = -2.62,P <0.05);右侧前额叶白质 NAA/Cr、Cho/Cr值与正常对照组差异无统计学意义(P>0.05);与正常对照组比较,BDD患者组双侧前扣带回皮质和海马NAA/Cr、Cho/Cr值与正常对照组差异均无统计学意义(P > 0.05),见表 1。

图1 额叶MRS定位图图2 海马MRS定位图图3 双相抑郁患者左侧额叶白质MRS谱线图
2.3 双相抑郁患者组与单相抑郁组的双侧额叶白质、前扣带回皮质、海马1H-MRS代谢物水平的比较 单相抑郁患者组与双相抑郁患者组的双侧额叶白质、前扣带回皮质、海马 NAA/Cr、Cho/Cr值差异均无统计学意义(P>0.05)。见表2。
2.4 回归分析 以双相抑郁患者HAMD得分为因变量,双侧额叶白质、前扣带回皮质、海马影像学结果为自变量,进行多元线性回归分析,采用向前似然比法,纳入标准为α=0.10,排除标准为β=0.15。进入方差的有额叶白质左侧NAA/Cr和前扣带回皮质右侧NAA共2个影像学结果。见表3。
表1 患者组与对照组前额叶白质、前扣带回皮质和海马1H-MRS代谢物水平的比较(±s)
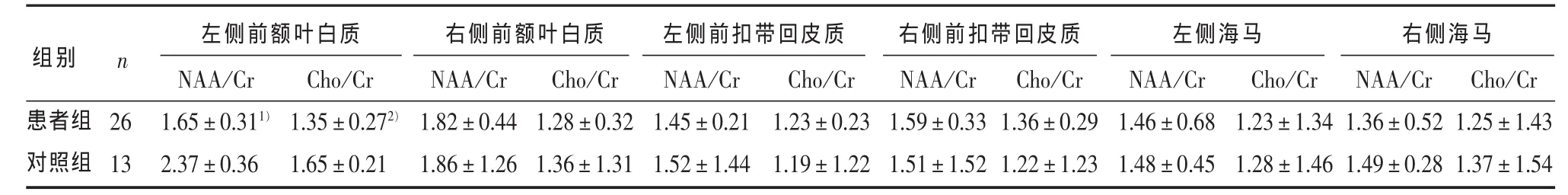
表1 患者组与对照组前额叶白质、前扣带回皮质和海马1H-MRS代谢物水平的比较(±s)
1)与对照组比较,经 t检验,P < 0.012)与对照组比较,经 t检验,P < 0.05
左侧前额叶白质 右侧前额叶白质 左侧前扣带回皮质 右侧前扣带回皮质 左侧海马 右侧海马n组别患者组对照组26 13 NAA/Cr 1.65 ± 0.311)2.37 ± 0.36 Cho/Cr 1.35 ± 0.272)1.65 ± 0.21 NAA/Cr 1.82 ± 0.44 1.86 ± 1.26 Cho/Cr 1.28 ± 0.32 1.36 ± 1.31 NAA/Cr 1.45 ± 0.21 1.52 ± 1.44 Cho/Cr 1.23 ± 0.23 1.19 ± 1.22 NAA/Cr 1.59 ± 0.33 1.51 ± 1.52 Cho/Cr 1.36 ± 0.29 1.22 ± 1.23 NAA/Cr 1.46 ± 0.68 1.48 ± 0.45 Cho/Cr 1.23 ± 1.34 1.28 ± 1.46 NAA/Cr 1.36 ± 0.52 1.49 ± 0.28 Cho/Cr 1.25 ± 1.43 1.37 ± 1.54
表2 患者组与单相组前额叶白质、前扣带回皮质、海马 1H-MRS代谢物水平的比较(±s)
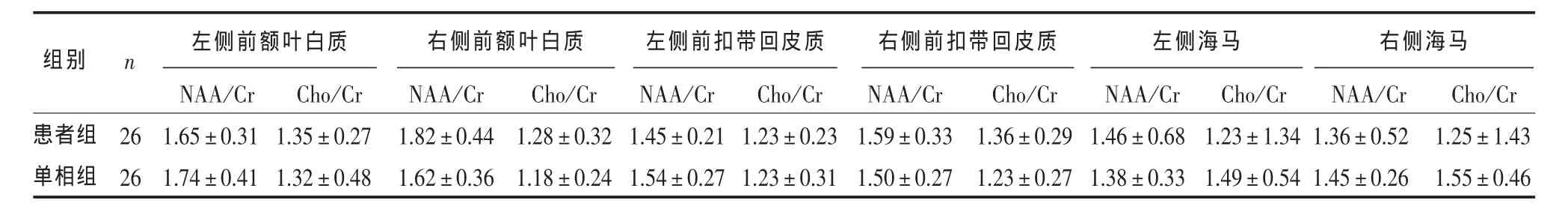
表2 患者组与单相组前额叶白质、前扣带回皮质、海马 1H-MRS代谢物水平的比较(±s)
左侧海马 右侧海马组别 n 左侧前额叶白质 右侧前额叶白质 左侧前扣带回皮质 右侧前扣带回皮质患者组单相组26 26 NAA/Cr 1.65 ± 0.31 1.74 ± 0.41 Cho/Cr 1.35 ± 0.27 1.32 ± 0.48 NAA/Cr 1.82 ± 0.44 1.62 ± 0.36 Cho/Cr 1.28 ± 0.32 1.18 ± 0.24 NAA/Cr 1.45 ± 0.21 1.54 ± 0.27 Cho/Cr 1.23 ± 0.23 1.23 ± 0.31 NAA/Cr 1.59 ± 0.33 1.50 ± 0.27 Cho/Cr 1.36 ± 0.29 1.23 ± 0.27 NAA/Cr 1.46 ± 0.68 1.38 ± 0.33 Cho/Cr 1.23 ± 1.34 1.49 ± 0.54 NAA/Cr 1.36 ± 0.52 1.45 ± 0.26 Cho/Cr 1.25 ± 1.43 1.55 ± 0.46
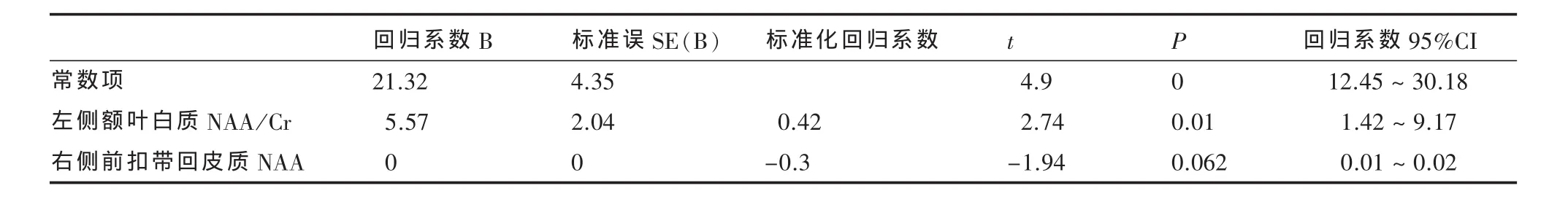
表3 双相抑郁患者抑郁评分与影像学结果的多元线性回归
3 讨论
额叶占整个脑容积的40%~50%,与人类的高级精神活动密切相关,尤其是情感活动、认知功能。大脑神经影像学研究显示BDD患者存在额叶结构和功能异常。本研究结果发现BDD患者的左侧前额叶白质NAA/Cr低于正常对照组,与国外研究报道一致[4-6]。而且回归分析发现左侧额叶白质NAA/Cr与抑郁严重程度有关,但国外研究多关注前额叶皮质,而对额叶白质代谢变化的研究较少。Wang等[7]对MDD前额叶白质研究发现,MDD存在双侧 NAA/Cr降低,说明 BDD与MDD前额叶代谢存在差异。NAA主要存在于神经元胞体和轴突、树突中,是公认的反映神经元的内标志物。但新近有研究显示,NAA在成熟少突胶质细胞中也有表达[8],少突胶质细胞是构成白质纤维髓鞘的主要细胞类型,与髓鞘的形成和维持有关。本研究结果提示BDD患者存在左侧前额叶神经元受损,左侧前额叶神经元受损是否与髓鞘功能异常有关仍需进一步研究。Frazier等[9]发现BDD患者额叶的白质各向异性值(faraction anistropy,FA值)降低,且与抑郁的严重度呈负相关,推测其前额叶白质功能和完整性受损,进而影响额叶的情绪管理功能。对于BDD患者的尸检研究也发现背外侧前额叶神经元和锥体细胞密度降低[10],以及少突胶质细胞密度降低,均支持本研究结果。目前对于BDD患者Cho水平的研究结果不甚一致。有些研究发现Cho水平升高[4],但也有研究报道Cho减低[5]。本研究发现BDD患者左侧额叶白质Cho减低,提示患者可能存在细胞膜磷脂代谢及细胞内信号转导异常。此外,本研究发现BDD患者前额叶白质的代谢异常均发生在左侧,说明患者的前额叶白质的结构和/或功能损伤存在偏侧化,其原因可能是因为本组右利手患者其优势半球在左侧,主要的精神活动如认知、情绪、行为影响左半球功能有关。我们对双相抑郁患者与单相抑郁进行比较,各代谢物比值在前额叶白质、前扣带回皮质及海马未见差异,而有研究对单相抑郁患者的分听研究发现患者较正常组表现出较强的右耳优势,也支持单相抑郁患者脑功能偏侧化异常[11]。
扣带回是边缘系统的重要组成部分。本研究发现BDD患者双侧的前扣带回皮质的NAA/Cr和Cho/Cr值与对照组比较无统计学差异,与文献报道一致[4,12]。但目前大多数国内外研究主要运用单体素1H-MRS技术研究扣带回,未能区分左右侧扣带回。本研究使用的多体素技术可以扩大VOI检查范围,并能进一步分析VOI内的小体素及左右侧扣带回,使结果更准确。
近年来大量研究证实,在认知情绪环路中海马起关键作用。本研究未发现BDD患者双侧海马的NAA/Cr和Cho/Cr与单相抑郁及正常对照组在统计学的差异。分析原因可能与本组患者平均年龄较低、平均病程较短有关。Colla等[13]对稳定期BDD患者双侧海马进行MRS研究发现NAA和Cho均未见异常。但是谷氨酸(glutamate content,Glu)水平增高,且Glu与NAA成明显相关。但也有研究发现BDD患者双侧海马NAA降低,Cho正常[14]。因此,BDD患者是否可能存在海马区代谢的异常尚需要进一步扩大样本研究。
本研究利用1H-MRS技术检测BDD患者前额叶白质和海马的代谢物,发现BDD患者存在左侧前额叶白质的神经元代谢障碍。但由于研究限制可能对结果产生影响,尚不能定论。第一样本量尚小;第二,因为方法学限制,没有对代谢物谷氨酸和谷氨酰胺复合物 (composed mainly of glutamate and glutamine,Glx)及肌醇(myoinositolml)进行测定,有研究发现BDD前额叶和前扣带回皮质Glx浓度增加[15];第三本研究采用 Cr比值,而没有对代谢物进行绝对定量分析,Cr在每一个体脑区是相对稳定的,但是一些研究结果对Cr作为参照比值的准确性仍存在争论。因此有待今后利用MRS绝对定量技术,例如线性拟合模型 (LCModel)对BDD患者脑内各代谢物浓度进行定量检测。
[1]McGuffin P, Rijsdijk F, Andrew M, et al.The heritability of bipolar affective disorder and the genetic relationship to unipolar depression[J].Arch Gen Psychiatry, 2003,60(5):497-502.
[2]Strakowski SM,DelBello MP,Adler CM.The Functional neuroanatomy of bipolar disorder: a review of neuroimaging findings[J].Mol Psychiatry, 2005,10(1):105-116.
[3]Emsell L,McDonald C.The structural neuroimaging of bipolar disorder[J].Int Rev Psychiatry, 2009, 21(4):297-313.
[4]Yildiz-Yesiloglu A, Ankerst DP.Neurochemical alterations of the brain in bipolar disorder and their implications for pathophysiology:a systematic review of the in vivo proton magnetic resonance spectroscopy findings[J].Prog Neuropsychopharmacol, 2006,30(6):969-995.
[5]Dager SR, Oskin NM, Richards TL, et al.Research applications of magnetic resonance spectroscopy(MRS) to investigate psychiatric disorders[J].Top Magn Reson Imaging, 2008,19(2):81-96.
[6]Sassi RB,Stanley JA,Axelson D, et al.Reduced NAA levels in the dorsolateral prefrontal cortex of young bipolar patients[J].Am JPsychiatry, 2005,162(11):2109-2115.
[7]Wang Y, Jia YB, Xu GY, et al.Frontal white matter biochemical abnormalities in first-episode, treatment-naive patients with major depressive disorder: A proton magnetic resonance spectroscopy study[J].Affect Disord, 2012,136 (3):620-626.
[8]Bhakoo KK, Pearce D.In vitro expression of N-acetyl aspartate by oligodendrocytes:Implications for proton magnetic resonance spectroscopy signal in vivo[J].JNeurochemistry, 2000,74(1):254-262.
[9]Frazier JA, Breeze JL, Papadimitriou G, et al.White matter abnormalities in children with and at risk for bipolar disorder[J].bipolar Disord, 2007,9(8):799-809.
[10]Rajkowska G,Halaris A,Selemon LD.Reductions in neuronal and glial density characterize the dorsolateral prefrontal cortex in bipolar disorder[J].Biol Psychiatry, 2001,49(9):741-752.
[11]王继才,赵旭东,许秀峰.抑郁症患者脑功能偏侧化的分听研究[J].中国神经精神疾病杂志,2004,30(5):328-331.
[12Amaral JA, Tamada RS, Issler CK, et al.A 1HMRS study of the anterior cingulate gyrus in euthymic bipolar patients [J].Hum Psychopharmacol, 2006,21(4):215-220.
[13]Colla M,Schubert F,Bubner M,et al.Glutamate as a spectroscopic marker of hippocampal structural plasticity is elevated in long-term euthymic bipolar patients on chronic lithium therapy and correlates inversely with diurnal cortisol[J].Mol Psychiatry, 2009,14(7):696-704.
[14]Bertolino A,Frye M, Callicott JH, et al.Neuronal pathology in the hippocampal area of patients with bipolar disorder: a study with proton magnetic resonance spectroscopic imaging[J].Biol Psychiatry, 2003,53(10):906-913.
[15]Frye MA, Watzl J, Banakar S, et al.Increased anterior cingulate/medial prefrontal cortical glutamate and creatine in bipolar depression[J].Neuropsych, 32:2490-2499.
A1H magnetic resonance spectroscopy imaging study on the prefrontal lobe and hippocam pus in patients with bipolar depressive disorder.
JIA Yanbin, WANG Ying, ZHONG Shuming, XU Guiyun, LING Xueying, LIU Sirun, HUANG Li.The psychiatry Department, The first Affiliated Hospital of Jin'an University, Guangzhou 510632,China.Tel: 020-38688120.
ObjectiveTo investigate the changes of proton magnetic resonance spectroscopy (1H-MRS) in the prefrontal lobe and hippocampus in patientswith bipolar depressive disorder, and to provide some clues to neurobiology process of bipolar depressive disorder.M ethods The N-acetylaspartate (NAA), choline-containing compounds (Cho)and creatine (Cr) of the prefrontalwhitematter, anterior cingulated cortex and hippocampus were studied in 26 patients with bipolar depressive disorder, 26 patientswith unipolar disorder and 13 healthy controls.The ratios of NAA /Cr and Cho/Crwere calculated.Results The NAA/Cr and Cho/Cr in the left prefrontalwhitematter were significantly lower in patients than in normal controls (1.65 ± 0.31 vs 2.37 ± 0.36 and 1.35 ± 0.27 vs 1.65 ± 0.21; P < 0.01 and P < 0.05,respectively).There were no significant difference in NAA/Cr and Cho/Cr in the right prefrontal whitematter, anterior cingulated cortex and hippocampus between patients and controls (P > 0.05).There was no significant difference in the ratios of NAA /Cr and Cho/Cr in the prefrontal white matter, anterior cingulated cortex and hippocampus between patients with bipolar depressive disorder and those with unipolar disorder (P > 0.05). Conclusions Patients with bipolar depressive disordermay have neuronal dysfunction and abnormalmembrane phospholipid metabolism in the left prefrontalwhitematter, which is primarily lateralized to the left side.
Bipolar depressive disorder Prefrontal lobe Hippocampus Magnetic resonance spectroscopy
△ 广州市精神病医院情感障碍科
R749.4
A
10.3969 /j.issn.1002-0152.2012.06.009
☆ 广州市卫生局科技攻关计划(编号:2007Z3-E0611),广东省重大科技专项(编号:2011A080502014),中央高校基本科研业务费专项资金(编号:21612432)
* 暨南大学附属第一医院精神心理科(广州 510630)
(E-mail:yanbinjia2006@163.com)
** 暨南大学附属第一医院影像中心
2012-01-03 )
文飞)
·论 著·
