呼吸干冷空气对气道功能的影响
2012-01-30王明明
王明明
冬季晨练者和冬训运动员易出现呼吸道症状,对锻炼和训练造成不同程度的影响。我国气候的特点显示,冬季空气的温度和湿度在一年中均处于最低范围,故冬季晨练者和冬训运动员呼吸道症状的产生与冬季干冷的空气特点明显相关,本文拟从吸入干冷空气对气道功能影响的角度,阐述冬季晨练者和冬训运动员呼吸道症状产生的机理。
1 气道对吸入空气的生理性调节
1.1 气道对吸入空气温度和湿度的调节
气道可以成功地将一定温度和湿度范围内的吸入空气在到达肺泡表面前变成体核温度(血液温度)和100%相对湿度的状态[1]。吸入气体在通过咽部、气管和细支气管的粘膜层时,温度和湿度被提高,但该过程同时使粘膜温度和湿度都降低,并且,在正常情况下,调节温度和湿度的过程均发生在咽部和气管内。所以气道内存在一个温度和湿度到达体核温度和100%相对湿度的分界线(即恒温饱和分界线),同时在气道内也存在着从周围温度和湿度到恒温饱和分界线的温度和湿度梯度。该梯度和恒温饱和分界线都是动态变化的,其变化围绕周围温度和湿度的变化[2]、鼻腔或口腔呼吸方式[2]、通气方式[3]和疾病状态[4]等而表现出不同程度。例如,在平静状态下,一个健康的人通过鼻腔呼吸室内空气(22℃,50%相对湿度,10 mg/L绝对湿度),吸入空气温度和湿度在气道内的梯度如下:咽部为31~33℃,26~32mg/L绝对湿度;中段气管约为34℃,34~38mg/L绝对湿度;主气管达到体核温度和100%相对湿度即37℃,44mg/L绝对湿度[4]。
1.2 气道对吸入空气温度和湿度的修复
气道温度和湿度的修复途径有三个,即从吸入气体、呼出气体以及系统贮备中得到补充。
气道粘膜的终末呼吸温度和水含量是动态变化的,其受体核温度(血液温度)和吸入空气的温度和湿度来调节[4]。在每次呼吸过程中,气道粘膜所含的部分热和湿在吸气时被转移到吸入空气中,在呼气时可以得到补偿。在恒温饱和分界线之上气道粘膜,在吸气时被冷却和干燥,但在呼气之前从系统中得不到完全补偿[5],故呼出的肺泡气体将遇到一个较冷而干燥的粘膜,气体被浓缩,从而释放热和湿度到气道粘膜。所以呼出气体的温度和湿度直接与吸入气体的温度和湿度相关,即可以通过呼出气体预测吸入气体的动态变化[3]。例如,一个正常人在室内平静地通过鼻腔呼吸,肺泡气体通过以下的温度和湿度梯度得到冷却:在咽部大约36℃,40mg/L绝对湿度,从鼻孔部呼出时约为32~34℃,27~34mg/L绝对湿度[4]。所以,每次呼吸都有热和湿正常地从气道粘膜散失到周围空气中。热和湿需要从系统中得到补偿以满足下一次的呼吸。
2 干冷空气导致气道的病理性改变
2.1 气道狭窄
在干燥环境中,剧烈运动超过6分钟~8分钟时,水液补充到气道表面的速度明显不能达到气道湿化的需要[6]。水液不能及时补充首先反映在渗透压的变化。由于气道表面Na+和 Cl-平衡优先于渗透压平衡[7],所以由渗透梯度引起的Na+和Cl-浓度升高以滞留水分,从而形成气道的高渗环境。高渗环境被认为可以激活细胞包括释放介质在内的防御机制。这些介质可导致气道平滑肌(ASM)收缩,直接引发气道狭窄。同时,这些介质也可以引起气道暂时性的水肿,从而加重ASM收缩引起的狭窄。
大量吸入寒冷空气可导致气道冷却。而气道冷却首先引起支气管血管收缩,之后可出现血管反应性充血和水肿[8],形成气道狭窄。同时,在冷环境中,由于气道脱水后的冷刺激和渗透压改变[9]以及感觉神经[10]和粘液腺[11]的刺激可引起粘液分泌过多,从而加重气道狭窄。
当水液蒸发导致气道表面脱水达到一定程度时,小气道参与了对吸入空气的调节,从而导致了小气道脱水而损伤;同时,吸入冷空气通过增加参与调节空气的气道表面积,增加了气道对运动的反应性。如果损伤引起微血管渗漏浸入气道粘膜下层,则可导致气道对运动的正常反应被放大。例如,在温和的环境中,中等量运动,只需要10~12级气道参与调节吸入空气;而高强度运动或吸入冷空气,则需要更多的气道参与调节吸入的空气,甚至涉及直径小于1.0 mm的气道[6]。小气道参与空气调节过程是导致气道狭窄的关键事件。
2.2 气道损伤
气道损伤的产生与反复吸入大量的干冷空气而产生的病理反应有关,大量的研究积累了丰富的证据。首先,与创伤愈合和损伤相一致的证据是基底膜粘蛋白增加。气道活检显示滑雪者细胞外基质蛋白粘蛋白表达增加[12]。有研究发现,伴有呼吸道症状的冰上运动者诱导产生的痰液上,清液中基质金属蛋白酶(MMP-8)浓度显著升高[13]。其次,运动员痰液中性粒细胞数量增加。Larsson等[14]报道称健康受试者在短时间暴露于冷空气的跑步活动活动可导致其支气管肺泡灌洗液中的中性粒细胞和巨噬细胞数量增加。Karjalainen等[15]发现滑雪运动员有更高水平的中性粒细胞浸润。最直接证据是小鼠耐力运动后[16]和狗对干燥空气应激[17]出现的细支气管上皮损伤和修复。
2.3 气道高反应性
上皮损伤后,迅速而短暂的血液渗出作为支气管粘膜的一种防御作用已经被深入研究[18]。从毛细血管后小静脉的大量血液渗出不参与气道上皮屏障的损害。其在数分钟内产生,持续的时间也很短。其作用好像是在脱水后恢复气道表面液体水平,为覆盖基底细胞提供物质,修复损伤的上皮组织。但是,在冬季运动员体内,上皮损伤和修复过程可能重复多次[19]。平滑肌反复暴露于血浆衍生物之后,其收缩特性改变的首要表现是气道高反应性[20]。同时,中性粒细胞引发的气道炎症可增加气道平滑肌的敏感性[21]。
肥大细胞介质存在于气道粘膜,在气道平滑肌变得敏感和介质急性释放之前,只是气道反复损伤的一种物质。若没有经典哮喘的气道炎症存在,导致肌肉对介质的敏感/反应增强的原因可能是由于PGE2水平的降低,PGE2是对上皮刺激反应有防护作用的前列腺素。PGE2减少可能是由于气道损伤和上皮细胞丢失或渗透液应激导致其耗竭[22]。此外,水液通过蒸发散失或吸入高渗性气溶胶引起短暂的高渗效应可使气道表面或其附近的炎性细胞(肥大细胞和嗜酸性细胞)释放炎性介质,这些介质包括PGD2, LTE4和组胺,介质作用于受体可引起平滑肌收缩和气道狭窄[23]。
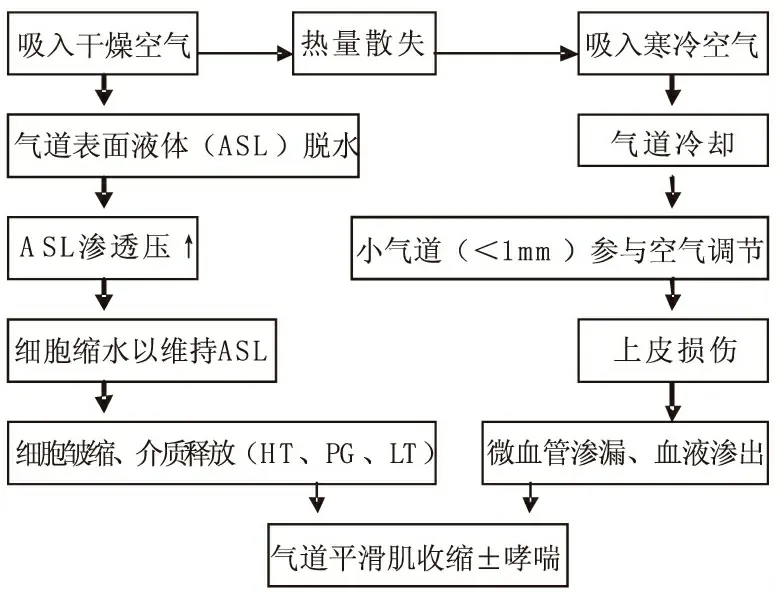
图1干冷空气对气道功能影响示意图
3 小结
过度吸入干冷空气是冬季晨练者和冬训运动员出现呼吸道症状的主要原因。干冷空气导致小气道参与了吸入空气温度和湿度的调节而脱水受到损伤,小气道反复损伤致使微血管渗漏和血液渗出,形成气道狭窄以及气道损伤,同时,气道平滑肌由于反复暴露于血液渗出物而导致收缩特性改变而成气道高反应性。所以在冬季晨练或冬训时,应该充分注意呼吸健康。运动时戴口罩,可以温暖和湿润吸入空气,对在冬天进行运动的运动员有特殊的价值[24]。与用口呼吸比较,用鼻呼吸通过温暖、过滤和湿润空气,缓减气道被冷却和干燥[25]。防治呼吸干冷空气影响气道功能的机理尚需进一步深入研究。
[1] Dery R. Humidity in anaesthesiology. IV. Determination of the alveolar humidity and temperature in the dog[J]. Can Anaesth Soc J, 1971,18(2):145~151.
[2] Ingelstedt S. Studies on the conditioning of air in the respiratory tract[J]. Acta Otolaryngol Suppl, 1956, 131:1~91.
[3] Ferrus L, Guenard H, Vardon G, et al. Respiratory water loss[J]. Respir Physiol, 1980, 39(3):367~381.
[4] Primiano FP, Saidel GM, Montague FW, et al. Water vapour and temperature dynamics in the upper airways of normal and CF subjects[J]. Eur Respir J, 1988,1(5):407~414.
[5] Cole P. Respiratory mucosal vascular responses to air conditioning and thermoregulation[J]. J Laryngol Otol, 1954, 68:613~622.
[6] Anderson SD, Daviskas E. The mechanism of exercise-induced asthma is ...[J]. J Allergy Clin Immunol, 2000,106(3):453~459.
[7] Chen BT, Yeates DB. Ion transport and regulation of respiratory tract fluid output in dogs[J]. J Appl Physiol, 2001,90(3):821~831.
[8] McFadden ER, Lenner KA, Strohl KP. Postexertional airway rewarming and thermally induced asthma[J]. J Clin Invest, 1986, 78(1):18~25.
[9] Anderson SD, Holzer K. Exercise-induced asthma: is it the right diagnosis in elite athletes?[J]. J Allergy Clin Immunol, 2000,106(3):419~428.
[10] Pisarri TE, Jonzon A, Coleridge HM, et al. Vagal afferent and reflex responses to changes in surface osmolarity in lower airways in dogs[J]. J Appl Physiol, 1992,73(6):2305~2313.
[11] Dwyer TM, Farley JM. Mucus glycoconjugate secretion in cool and hypertonic solutions[J]. Am J Physiol Lung Cell Mol Physiol, 1997,272(6 Pt 1):L1121~1125.
[12] Karjalainen EM, Laitinen A, Sue-Chu M, et al. Evidence of airway inflammation and remodeling in ski athletes with and without bronchial hyperresponsiveness to methacholine[J]. Am J Respir Crit Care Med, 2000, 161(6):2086~2091.
[13] Obase Y, Helenius I, Rytila P, et al. MMP-8 and TIMP-1 expression in induced sputum in elite hockey players and nonathletes with and without asthma (abstract). Eur Respir J, 2004, 24(Supp 48):ASM.
[14] Larsson K, Tornling G, Gavhed D, et al. Inhalation of cold air increases the number of inflammatory cells in the lungs in healthy subjects[J]. Eur Respir J, 1998,12(4):825~830.
[15] Karjalainen EM, Laitinen A, Sue-Chu M, et al. Evidence of airway inflammation and remodeling in ski athletes with and without bronchial hyperresponsiveness to methacholine[J]. Am J Respir Crit Care Med, 2000, 161(6):2086~2091.
[16] Chimenti L, Morici G, Paterno A, et al. Endurance training damages small airway epithelium in mice[J]. Am J Respir Crit Care Med, 2007,175(5):442~449.
[17] Omori C, Schofield BH, Mitzner W, et al. Hyperpnea with dry air causes time-dependent alterations in mucosal morphology and bronchovascular permeability[J]. J Appl Physiol, 1995;78(3):1043~1051.
[18] Persson CGA, Erjefalt JS. Airway epithelial restitution after shedding and denudation. In The Lung[M]. 2nd ed. New York: Raven Press, 1997:2611~2627.
[19] Persson CG, Erjefalt JS, Andersson M, et al. Extravasation, lamina propria flooding and lumenal entry of bulk plasma exudate in mucosal defence, inflammation and repair[J]. Pulm Pharmacol, 1996,9(3):129~139.
[20] Anderson SD, Kippelen P. Exercise-induced bronchoconstriction: Pathogenesis[J]. Curr Allergy Asthma Rep, 2005,5(2):116~122.
[21] Anticevich SZ, Hughes JM, Black JL,et al. Induction of hyperresponsiveness in human airway tissue by neutrophils—mechanism of action[J]. Clin Exp Allergy, 1996,26(5):549~556.
[22] Hallstrand TS, Moody MW, Aitken ML, et al. Airway immunopathology of asthma with exercise-induced bronchoconstriction[J]. J Allergy Clin Immunol, 2005,116(3):586~593.
[23] Eggleston PA, Kagey-Sobotka A, Lichtenstein LM. A comparison of the osmotic activation of basophils and human lung mast cells[J]. Am Rev Respir Dis, 1987, 135(5):1043~1048.
[24] Schacter E, Lach E, Lee M. The protective effects of a cold weather mask on exercised-induced asthma[J]. Ann Allergy, 1981,46(1) 12~16.
[25] Shturman-Ellstein R, Zaballos RJ, Buckley JM, et al. The beneficial effect of nasal breathing on exercise-induced bronchoconstriction[J]. Am Rev Respir Dis, 1978, 118(1):65~73.
