单侧输尿管梗阻大鼠肾脏岩藻糖基转移酶8的表达变化*
2012-01-30王大鹏王伟东孙艳玲林洪丽
沈 楠, 银 涛, 王大鹏, 王伟东, 谢 华, 孙艳玲, 林洪丽
(大连医科大学附属第一医院肾内科,辽宁大连116011)
各种进行性慢性肾脏病发展为终末期肾功能衰竭的共同的病理特征为肾间质纤维化[1]。转化生长因子 β1(transforming growth factor β1,TGF - β1)是作用最强的致肾纤维化细胞因子[2-3],它通过促进肾小管上皮细胞间充质转化(epithelial-mesenchymal transition,EMT)和细胞外基质(extracellular matrix,ECM)的过度沉积最终导致肾脏纤维化[4]。通常情况下,TGF-β先与其Ⅱ型受体结合,再使Ⅰ型受体磷酸化并与前二者结合,激活下游信号转导途径,发挥致纤维化作用[5]。近年来的研究表明核心岩藻糖化对TGF-β1生理功能的发挥具有重要作用[6],岩藻糖基转移酶8(fucosyltransferase 8,FUT8)是TGF-β1受体糖基化修饰的关键酶[7]。目前尚未见系统研究参与肾间质纤维化的FUT8表达和分布的报道。因此,我们以经典的单侧输尿管梗阻(unilateral ureteral obstruction,UUO)模型为肾间质纤维化模型[8],通过检测FUT8和TGF-β致纤维化的关键受体活化素受体样激酶 5(activin receptor-like kinase 5,ALK5)在肾脏的表达和分布,以期弄清 FUT8及ALK5在正常肾脏和肾间质纤维化发生和进展中的分布和变化规律,揭示TGF-β在肾间质纤维化中的作用机制。
材料和方法
1 动物
雄性Wistar大鼠,体重180~200 g(大连医科大学动物实验中心提供),常规饲料喂养。
2 主要试剂
Trizol试剂(Invitrogen),AMV Hot Start酶、TaKa-Ra RNA PCR Kit 3.0试剂盒,FUT8和 β -actin引物(大连宝生物公司),兔抗大鼠FUT8、ALK5、α-平滑肌肌动蛋白(α -smooth muscle actin,α -SMA)、Ⅰ型胶原(collagen type I,Col I)、纤维连接蛋白(fibronectin,FN)和 β -actin多克隆抗体(Santa Cruz),辣根过氧化酶标记抗鼠、抗兔、抗山羊的IgG(H+L)和免疫组化染色试剂盒SP-9003(北京中杉金桥生物技术公司),FITC-兔抗羊 IgG(H+L)(Invitrogen),TRITC-驴抗羊IgG(H+L)和FITC-驴抗兔IgG(H+L)(Proteintech)。
3 主要方法
3.1 实验分组 将90只大鼠随机分为3组:(1)正常对照组(control)30只;(2)假手术组(sham)30只,仅切开腹腔并游离左侧输尿管,不予结扎和剪断;(3)UUO组30只,参照文献[9]行UUO术。分别于 UUO 术后1 d、3 d、7 d、14 d 和21 d 处死,每次分别随机处死control组、sham组和UUO组各6只大鼠。取大鼠下腔静脉血上清置于-20℃保存待测。左侧肾脏用肝素生理盐水原位灌流去除血细胞后,肾组织部分行10%中性甲醛固定,部分做冰冻切片处理,其余于液氮中保存。
3.2 生化指标的检测 使用日立7080全自动生化分析仪测定各组大鼠血肌酐及尿素氮。
3.3 肾脏病理及肾小管损伤和间质纤维化评估取各组大鼠肾脏组织经固定、脱水、浸蜡、包埋、切片,行PAS及Masson染色。肾小管间质损伤指数评分标准参照文献[10]。肾小管间质纤维化分级标准参照文献[11],由2名观察者采用双盲法独立进行评价。
3.4 RT-PCR检测FUT8 mRNA的表达 Trizol法提取各组肾组织总RNA,取RNA 1 μg,按RNA PCR Kit 3.0试剂盒说明书进行反转录,大鼠FUT8和βactin引物序列来自PrimerBank。反应条件为:30℃10 min,42 ℃ 30 min,99 ℃ 5 min,5 ℃ 5 min。取出5 μL反转录产物,在20 μL PCR反应体系中进行FUT8 cDNA的扩增,反应条件为:96℃ 5 min,96℃45 s,60 ℃ 45 s,72 ℃ 90 s,35 个循环,72 ℃ 7 min。PCR产物经1%琼脂糖凝胶电泳后,使用凝胶成像分析系统进行mRNA水平半定量分析,以FUT8与内参照β-actin的比值作为FUT8的相对含量值,引物序列见表1。

表1 引物序列Table 1.Sequences for primers
3.5 Western印迹法检测FUT8蛋白的表达 各组取等量蛋白样品(100 μg)上样,经10%聚丙烯酰胺凝胶电泳后,电转移至PVDF膜,5%脱脂奶粉室温封闭1 h,加入Ⅰ抗(1∶100)4℃孵育过夜,洗膜后孵育Ⅱ抗(1∶3 000)1 h,用ECL试剂曝光、显影。以β-actin作内参照,应用图像分析软件对特异性条带作吸光度定量分析,以反映蛋白相对表达量。
3.6 免疫荧光法检测FUT8和ALK5的表达 将肾皮质组织切成3 μm的冰冻切片,室温封闭1 h,Ⅰ抗(1∶100)4℃孵育过夜。Ⅱ抗(1∶300)室温避光孵育0.5 h。DAPI染核并封片,于Leica荧光显微镜下观察。使用Image-Pro Plus 6.0图像分析系统对结果进行半定量分析,每张切片随机选取10个视野,计算每个视野内染色区域的平均吸光度值,以均值计算每个标本的IA值,最后以每组的IA值进行比较。
3.7 免疫组化检测FN、Col I和α-SMA的表达石蜡包埋的组织切片常规脱蜡至水,3%过氧化氢室温孵育15 min,经微波加热修复抗原后,每片加10%山羊血清室温孵育15 min,滴加Ⅰ抗(1∶100)4℃孵育过夜,再依次加入生物素标记Ⅱ抗和辣根过氧化物酶标记的链酶卵白素工作液,室温孵育30 min,在显微镜观察下DAB显色,苏木素复染。PBS缓冲液代替Ⅰ抗作阴性对照。结果为蛋白的阳性表达部位呈棕黄色深染,每例切片随机观察10个视野,以Imagetools软件计算阳性表达部位染色面积总和与视野内肾小管间质总面积(除去肾小管管腔面积),以两者的比值并取平均值作为每只实验大鼠的实际检测值并记录结果。
4 统计学处理
结 果
1 各组大鼠肾组织病理变化
PAS与Masson染色显示,UUO术后第7 d时肾小管扩张明显,肾间质可见大量炎症细胞浸润。第14 d可见皮质及近髓萎缩肾小管较多,间质纤维化较明显,见图1。

Figure 1.PAS and Masson staining of the renal tissue sections from different groups(×400).图1 各组大鼠肾脏组织病理改变
2 各组大鼠肾功能检测
UUO组血肌酐及尿素氮自术后3 d出现升高(P <0.05),在第21 d达到最高值(P <0.01),见表2。
表2 各组大鼠不同时点血肌酐及尿素氮的比较Table 2.The changes of serum creatinine and urea nitrogen levels in different groups(±s.n=6)
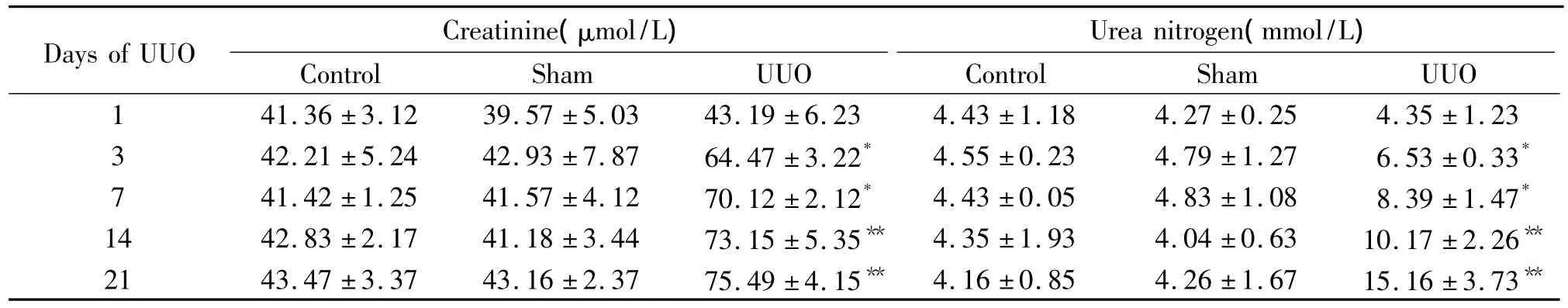
表2 各组大鼠不同时点血肌酐及尿素氮的比较Table 2.The changes of serum creatinine and urea nitrogen levels in different groups(±s.n=6)
*P <0.05,**P <0.01 vs control group.
Days of UUO Creatinine(μmol/L)Urea nitrogen(mmol/L)Control Sham UUO Control Sham UUO 1 41.36 ±3.12 39.57 ±5.03 43.19 ±6.23 4.43 ±1.18 4.27 ±0.25 4.35 ±1.23 3 42.21 ±5.24 42.93 ±7.87 64.47 ±3.22* 4.55 ±0.23 4.79 ±1.27 6.53 ±0.33*41.42 ±1.25 41.57 ±4.12 70.12 ±2.12* 4.43 ±0.05 4.83 ±1.08 8.39 ±1.47*14 42.83 ±2.17 41.18 ±3.44 73.15 ±5.35** 4.35 ±1.93 4.04 ±0.63 10.17 ±2.26**21 43.47 ±3.37 43.16 ±2.37 75.49 ±4.15** 4.16 ±0.85 4.26 ±1.67 15.16 ±3.73 7**
3 肾间质损伤指数
UUO组肾间质损伤指数于术后1 d开始升高(P <0.05),并持续至 21 d(P <0.01),sham 组与control组表达无显著差异(P>0.05),见表3。
表3 各组大鼠肾小管间质损伤指数比较Table 3.The changes of tubulointerstitial damage index in different groups(±s.n=6)

表3 各组大鼠肾小管间质损伤指数比较Table 3.The changes of tubulointerstitial damage index in different groups(±s.n=6)
*P <0.05,**P <0.01 vs control group.
*3 0.43 ±0.54 0.44 ±0.05 1.95 ±0.25*7 0.34 ±0.27 0.38 ±0.16 4.35 ±0.17**14 0.47 ±0.19 0.53 ±0.08 5.18 ±0.39**21 0.45 ±0.32 0.47 ±0.07 6.47 ±0.14**
4 RT-PCR结果
与control组相比,UUO术后第3 d FUT8mRNA的表达开始增加,随着梗阻时间的递增,在第14 d达到最高(P <0.05),见图2。
5 Western印迹法与免疫荧光法结果
与control组相比,UUO术后第3 d起,肾脏FUT8蛋白表达增加,随时间递增,术后第14 d达到高峰(P <0.01),见图3。
与 control组相比,UUO术后第7 d起,肾脏FUT8和ALK5在肾小管上皮细胞共表达区域增强,随时间递增,术后第14 d达到高峰(P<0.05),见图4,且表达呈正相关(r=0.87,P <0.05),见表4。
6 免疫组化结果
与control组相比,UUO术后第7 d起,肾脏α-SMA、ColⅠ、FN在肾小管间质表达增加,随时间递增,术后第14 d达到高峰(P<0.01),且表达呈正相关(r=0.89,r=0.76,r=0.80,P < 0.05),见图 5、表5。
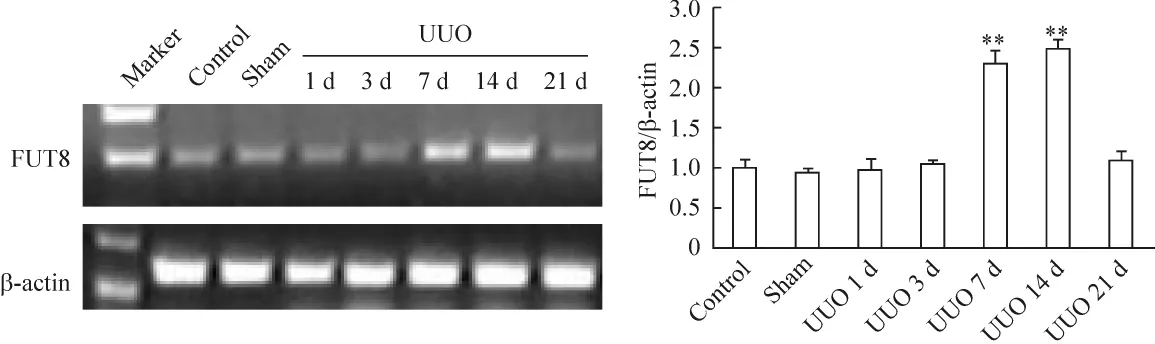
Figure 2.Expression of FUT8 mRNA in the renal tissues from different groups(RT-PCR).±s.n=6.**P<0.01 vs control group.图2 各组大鼠肾组织FUT8 mRNA的表达

Figure 3.Expression of FUT8 protein in the rat renal tissues from different groups(Western blotting).±s.n=6.*P<0.05,**P<0.01 vs control group.图3 各组大鼠肾组织FUT8蛋白的表达

Figure 4.Expression of FUT8 and ALK5 proteins in the tubulointerstitium of different groups(immunofluorescence,×400).图4 各组大鼠肾组织FUT8和ALK5蛋白在肾小管间质的表达
表4 各组大鼠免疫荧光阳性染色面积Table 4.The positive staining areas of FUT8 and ALK5 in the tubulointerstitium in different groups(IA.±s.n=10)

表4 各组大鼠免疫荧光阳性染色面积Table 4.The positive staining areas of FUT8 and ALK5 in the tubulointerstitium in different groups(IA.±s.n=10)
*P <0.05 vs control group.
Control 1.80 ±0.15 1.44 ±0.46 UUO 7 d 5.93 ±0.28* 5.15 ±0.48*UUO 14 d 8.38 ±0.34* 7.59 ±0.39*
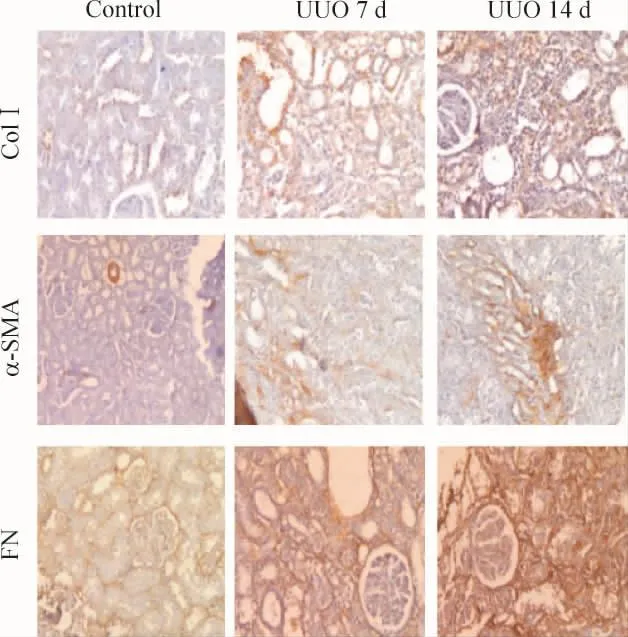
Figure 5.Expression of col I,α - SMA and FN proteins in the tubulointerstitium of different groups(immunohistochemistry,×200).图5 各组大鼠肾组织Col I、α-SMA和FN蛋白在肾小管间质的表达
表5 各组大鼠α-SMA、Col I、FN阳性染色面积Table 5.The positive staining areas of α - SMA,Col I and FN in the tubulointerstitium in different groups(IA.±s.n=10)
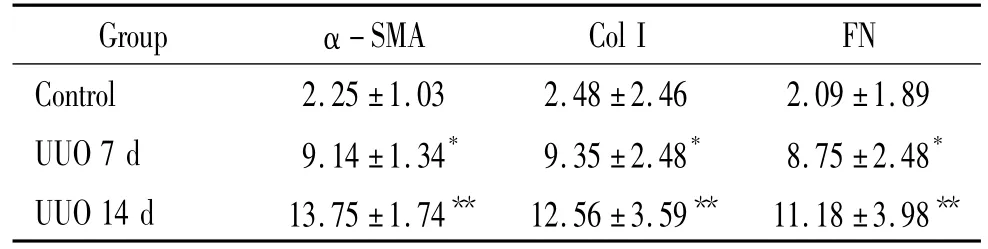
表5 各组大鼠α-SMA、Col I、FN阳性染色面积Table 5.The positive staining areas of α - SMA,Col I and FN in the tubulointerstitium in different groups(IA.±s.n=10)
*P <0.05,**P <0.01 vs control group.
Group α -SMA Col I FN Control 2.25 ±1.03 2.48 ±2.46 2.09 ±1.89 UUO 7 d 9.14 ±1.34* 9.35 ±2.48* 8.75 ±2.48*UUO 14 d 13.75 ±1.74** 12.56 ±3.59** 11.18 ±3.98**
讨 论
TGF-β是促进肾间质纤维化发生发展的关键因子,阻断TGF-β信号转导通路激活可以延缓肾间质纤维化的病理进程,以往有针对于阻断该通路活化的方法是通过下调通路中关键因子或受体的表达。然而随着功能蛋白质组学研究的深入,发现许多蛋白质发挥功能不仅和其表达水平相关,与其翻译后修饰也有着密切联系,后者常是其发挥生物学功能所必需的[12-13]。糖基化修饰是一种重要的蛋白翻译后修饰方式,参与了靶蛋白反应的多种重要生理及病理过程:如细胞转移、增殖、信号转导等过程,而上述过程与肾间质纤维化发生发展过程密切相关[14]。TGF-β发挥作用是通过它的受体来完成的,ALK5是TGF-β通路的关键始动受体,其表达和活化是TGF-β通路活化的必备条件。FUT8是催化ALK5糖基化修饰的关键酶。但目前尚不清楚UUO大鼠在肾间质纤维化过程中FUT8表达的变化。
肾间质纤维化有2个主要的病理特征:一是肾小管上皮细胞-肌成纤维细胞转分化,一是细胞外基质过度集聚[15]。α-SMA被认为是肾小管上皮细胞转化和肾间质纤维化程度的重要指标[16]。本实验选用α-SMA作为评估EMT的指标,选用ECM的主要成分Ⅰ型胶原和FN作为评估ECM集聚的指标[17]。
我们选用UUO大鼠作为肾间质纤维化的模型,首次发现和证实在肾间质纤维化形成过程中肾小管上皮细胞 FUT8表达升高,在 UUO组中 FUT8与ALK5的表达定位在肾间质及小管上皮细胞同一区域并且同步增加,与梗阻的时间及肾间质纤维化的程度密切相关。我们推测TGF-β信号转导通路在肾间质纤维化的发生进程中,由FUT8所催化的TGF-βRⅡ糖基化修饰增加,通过与配体相结合从而进一步促使TGF-βⅠ型受体ALK5表达增加,作用于其下游信号分子从而激活其所调节的与纤维化相关联靶基因的转录,最终参与介导了肾小管间质纤维化的进程。FUT8与ALK5的表达具有时空一致性,其表达与α-SMA、ECM成分及肾间质小管损伤指数均呈正相关,与肾纤维化的发展密切相关。实验结果提示在肾间质纤维化进程中,TGF-β受体糖基化修饰发生改变,这种改变可能参与TGF-β信号通路的转导过程,为TGF-β在肾间质纤维化中作用机制补充了新内容。
综上所述,本研究表明在肾间质纤维化的进展中,FUT8与ALK5表达呈时空一致性升高,可能与肾间质纤维化程度密切相关。这为探索肾小管上皮细胞EMT的发生机制提供了新视角,同时也为临床上寻找治疗肾脏间质纤维化发生新靶点提供了实验基础。
[1]Liu N,Tolbert E,Pang M,et al.Suramin inhibits renal fibrosis in chronic kidney disease[J].J Am Soc Nephrol,2011,22(6):1064 -1075.
[2]Yeh YC,Wei WC,Wang YK,et al.Transforming growth factor- β1induces Smad3 - dependent β1integrin gene expression in epithelial-to-mesenchymal transition during chronic tubulointerstitial fibrosis[J].Am J Pathol,2010,177(4):1743 -1754.
[3]张海燕,李幼姬,杜 勇,等.结缔组织生长因子在转化生长因子β诱导的肾小管上皮细胞转分化中的作用[J].中国病理生理杂志,2005,21(1):179 -183.
[4]Yuan Q,Wang R,Peng Y,et al.Fluorofenidone attenuates tubulointerstitial fibrosis by inhibiting TGF-β1-induced fibroblast activation[J].Am J Nephrol,2011,34(2):181-194.
[5]Kushibiki T,Nagata- Nakajima N,Sugai M,et al.Enhanced anti-fibrotic activity of plasmid DNA expressing small interference RNA for TGF-β type II receptor for a mouse model of obstructive nephropathy by cationized gelatin prepared from different amine compounds[J].J Control Release,2006,110(3):610 -617.
[6]Wang X,Inoue S,Gu J,et al.Dysregulation of TGF - β1receptor activation leads to abnormal lung development and emphysema-like phenotype in core fucose-deficient mice[J].Proc Natl Acad Sci U S A,2005,102(44):15791-15796.
[7]王大鹏,林洪丽,沈 楠,等.阻断核心岩藻糖基化修饰抑制肾小管上皮细胞的间充质转化[J].中国病理生理杂志,2011,27(7):1382-1388.
[8]Chevalier RL,Forbes MS,Thornhill BA.Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy[J].Kidney Int,2009,75(11):1145-1152.
[9]林洪丽,陈香美,程庆砾,等.单侧输尿管梗阻后小鼠肾脏环氧化酶-2的表达及其意义[J].中国病理生理杂志,1999,15(10):945-947.
[10]Radford MG Jr,Donadio JV Jr,Bergstralh EJ,et al.Predicting renal outcome in IgA nephropathy[J].J Am Soc Nephrol,1997,8(2):199 -207.
[11]王伟铭,陈 楠,董德长.肾组织核心蛋白聚糖和转化生长因子-β1的表达与肾间质纤维化的关系[J].肾脏病与透析肾移植杂志,2002,2(2):124-128.
[12]Lin H,Wang D,Wu T,et al.Blocking core fucosylation of TGF-β1receptors downregulates their functions and attenuates the epithelial-mesenchymal transition of renal tubular cells[J].Am J Physiol Renal Physiol,2011,300(4):F1017-F1025.
[13]Zhao YY,Takahashi M,Gu JG,et al.Functional roles of N-glycans in cell signaling and cell adhesion in cancer[J].Cancer Sci,2008,99(7):1304 -1310.
[14]Kondo A,Li W,Nakagawa T,et al.From glycomics to functional glycomics of sugar chains:identification of target proteins with functional changes using gene targeting mice and knock down cells of FUT8 as examples[J].Biochim Biophys Acta,2006,1764(12):1881 -1889.
[15]Shi Y,Tu Z,Wang W,et al.Homologous peptide of connective tissue growth factor ameliorates epithelial to mesenchymal transition of tubular epithelial cells[J].Cytokine,2006,36(1 -2):35 -44.
[16]Ina K,Kitamura H,Tatsukawa S,et al.Significance of α-SMA in myofibroblasts emerging in renal tubulointerstitial fibrosis[J].Kidney Int,2009,75(11):1145 - 1152.
[17]You GQ,Fu P,Xie XS,et al.Effects of piperazine ferulate on TGF-β1-induced renal interstitial fibroblast activation[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2008,39(5):736 -739,762.
