iNOS-GC-cGMP信号活化参与了内毒素血症大鼠血管低反应性的发生机制*
2012-01-30王海华闵志雪戚仁斌张根葆包鹏举1胡钱国1
王海华, 闵志雪, 戚仁斌, 张根葆, 包鹏举1,, 胡钱国1,, 孙 瑶
(皖南医学院1生理教研室,2蛇毒研究所,安徽芜湖241002;3暨南大学医学院病理生理教研室,广东 广州510632)
脓毒症是临床上严重烧伤、休克及手术后患者重要并发症之一,脓毒症休克是重症监护病房(intensive care unit,ICU)患者死亡的主要原因,病死率高达30%~45%,严重的低血压和血管麻痹导致一个或多个器官功能障碍[1-2]。研究表明,一氧化氮(nitric oxide,NO)的过量生成是导致败血症休克全身不可逆性低血压的主要原因[3-4]。内源性一氧化氮主要是由一氧化氮合酶(nitric oxide synthase,NOS)催化L-精氨酸生成的。给实验动物注射纯化的脂多糖(lipopolysaccharide,LPS)来模拟败血症休克是近年来国际上比较通用的有效手段[5-6],LPS进入体内能刺激多种组织因子及血管活性物质过量表达,从而导致心血管功能障碍,但LPS引起的心血管功能障碍的机制至今尚未完全阐明。
临床发现大多数抗生素对内毒素引起的炎症无作用,多黏菌素B(polymyxin B,PMX-B)作为脂多糖的抑制剂,具有显著抗内毒素作用[7]。本研究通过腹腔注射纯化的LPS诱导大鼠内毒素血症模型,探讨LPS引发的内毒素血症大鼠血管低反应性与诱导型NOS(inducible NOS,iNOS)-鸟苷酸环化酶(guanylate cyclase,GC)-环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)信号活化的相关性,同时阐明PMXB在内毒素血症大鼠血管低反应性的可能作用机制。
材料和方法
1 药品和试剂
脂多糖(lipopolysaccharide,LPS)、氨基胍(aminoguanidine,AMG)、乙酰胆碱(acetylcholine,Ach)和亚甲蓝(methylene blue,MB)均购自Sigma。去氧肾上腺素(phenylephrine,Phe)由上海禾丰制药有限公司生产。TNF-α、NO和iNOS检测试剂盒均由南京建成生物工程研究所提供。其余试剂均为国产分析纯。
2 内毒素血症大鼠模型复制
健康SD雄性大鼠(浙江省实验动物中心提供)24只,动物质量合格证SCXK(浙)20080033,体重(220±20)g,适应性喂养1周,LPS(10 mg/kg,ip)建立内毒素血症大鼠模型,腹腔注射LPS 2 h后,动物即表现出盘索成团、萎靡不振、腹泻、活动度低下并伴有发绀、震颤等症状;4 h后血压明显下降,但动物没有死亡,说明内毒素血症模型复制成功。
3 实验分组及处理
3.1 实验分组 大鼠随机分为4组:LPS组,LPS(10 mg/kg,ip,4 h);LPS+PMX -B 组(LPS+PMX -B 组),LPS(10 mg/kg,ip,3.5 h)后从尾静脉注射PMX-B(0.2 mg/kg),余同 LPS组;PMX -B 组,腹腔注射生理盐水3.5 h后从尾静脉注射PMX-B(0.2 mg/kg),余同LPS组;sham组,同时点均注射生理盐水。1 h后进行大鼠血压测定。
3.2 大鼠血压测定 20%乌拉坦(5 mL·kg-1)腹腔注射麻醉大鼠后,取仰卧位固定于实验台,行颈总动脉插管术,通过压力传感器连接MedLab系统记录平均动脉血压(mean arterial blood pressure,MABP),监测时先稳定20 min,再观测30 min。然后颈总动脉采血2 mL,低温超速离心后取上清液-20℃保存,留作后续生化指标检测。
3.3 离体主动脉血管环标本的制备 采血后,迅速打开大鼠胸腔,取出胸腹段主动脉,置于4℃氧饱和的Krebs液中,清除血块和血管周围结缔组织,Krebs液的成分为(mmol·L-1):NaCl 118.4,KCl 4.7,KH2PO41.18,MgSO4·7H2O 1.1,NaHCO34.5,CaCl22.25,glucose 11.1,pH 7.2 ~7.4。将血管均匀剪成约3 mm长的血管环,套入上下平行的2个不锈钢钩,通过张力换能器连接MedLab系统记录张力变化。整个动脉环置入盛有10 mL Krebs液的37℃恒温浴槽内,持续通以95%O2+5%CO2混和气。先以0 g张力起步,平衡30 min后,逐步调节至最适初始张力1.5 g并平衡1 h,每15 min换液1次。以KCl 60 mmol·L-1收缩动脉环3次,直至收缩稳定,以激发主动脉血管环最佳活性,当主动脉血管环对连续2次同样的KCl刺激所引起的收缩幅度差别<10%时,开始正式实验。
3.4 主动脉血管环收缩与舒张功能的测定 采用累积给药法,观察间隔5 min累积给予1×10-8~1×10-5mol·L-1Phe诱导的主动脉血管环的收缩反应和1×10-8~1×10-4mol·L-1ACh诱导的主动脉血管环的舒张反应;分别用特异性iNOS抑制剂AMG(1×10-4mol·L-1)及 GC 抑制剂 MB(1 ×10-5mol·L-1)预处理主动脉血管环20 min后,观察间隔5 min累积给予浓度为1 ×10-8~1 ×10-5mol·L-1Phe诱导的主动脉血管环的收缩反应。记录主动脉血管环收缩幅度,并计算血管收缩率(vascular contraction rate,VCR)。血管收缩率(%)=(累加 Phe后的主动脉血管环收缩张力-最适初始张力)/空白组最大收缩张力平均值×100%。血管舒张率(%)=(加Phe后的主动脉血管环收缩张力-累加ACh后的血管张力)/(加Phe后的血管最大收缩张力-基础血管张力)×100%。以上每一轮实验完成后用K-H液反复冲洗3~5次,直至主动脉血管环张力恢复到实验前的基础水平才可以开始下一轮实验。
3.5 生化指标检测 使用UV-3200PCS紫外分光光度计检测血浆中NO和iNOS;使用Model-680型酶标仪测定血清中TNF-α水平。
4 统计学处理
结 果
1 各组大鼠MABP变化
如图1所示,同sham组相比,LPS组大鼠MABP显著降低(P<0.01),PMX-B组大鼠MABP无明显改变(P>0.05);而LPS+PMX-B组大鼠MABP与LPS组相比显著改善(P<0.05)。
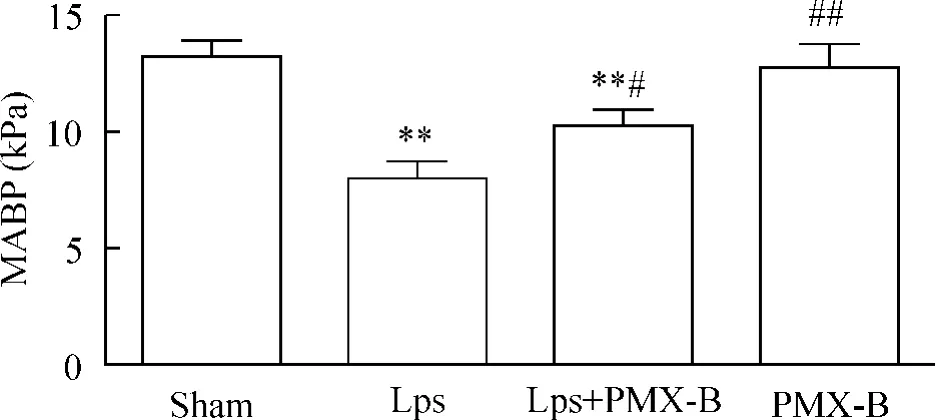
Figure 1.Changes of mean arterial blood pressure(MABP)in rats from different groups.±s.n=6.**P<0.01 vs sham group;#P <0.05,##P <0.01 vs LPS group.图1 各组大鼠平均动脉血压的改变
2 离体主动脉血管环灌流实验结果
2.1 主动脉血管环对Phe刺激的收缩反应和对ACh刺激的舒张反应 如图2、3所示,同sham组相比,LPS组大鼠离体主动脉血管环对Phe刺激的收缩反应以及对ACh刺激的舒张反应均显著降低(P<0.01),而PMX-B组无明显变化(P>0.05);同LPS组相比,LPS+PMX-B组大鼠离体主动脉血管环对Phe引起的收缩反应和ACh引起的最大舒张反应均显著改善,只是部分恢复,仍低于 sham组(P<0.05)。
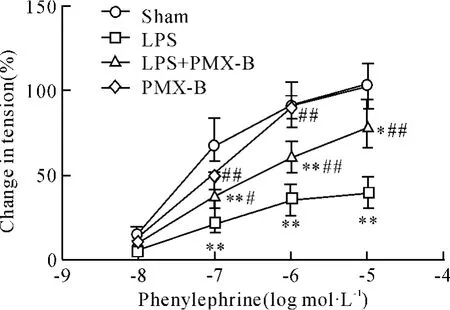
Figure 2.Effects of phenylephrine on tension of the aorta rings of rats.±s.n=6.*P<0.05,**P<0.01 vs sham group;#P <0.05,##P <0.01 vs LPS group.图2 各组大鼠主动脉血管环对Phe刺激的收缩反应
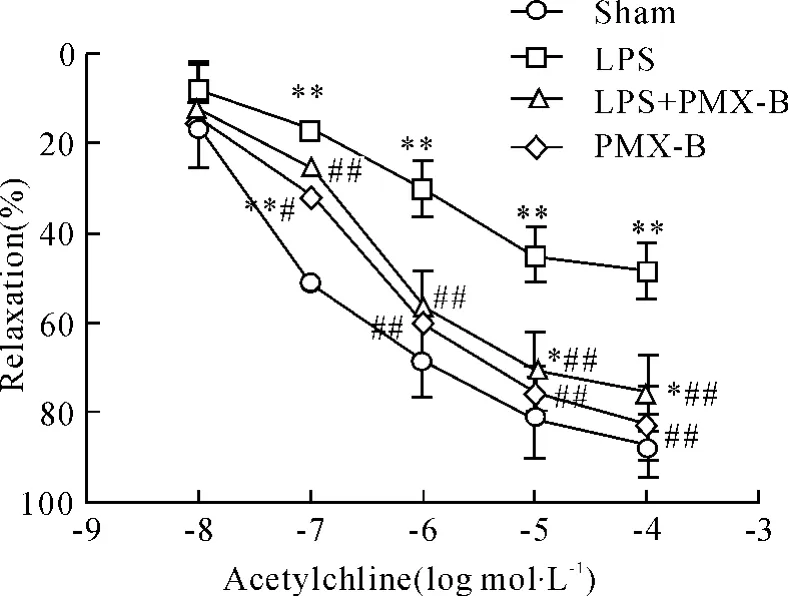
Figure 3.Effects of acetylcholine on relaxation of the aorta rings of rats.±s.n=6.*P<0.05,**P<0.01 vs sham group;#P <0.05,##P <0.01 vs LPS group.图3 各组大鼠主动脉血管环对ACh刺激的舒张反应
2.2 用AMG(1×10-4mol·L-1)预处理后主动脉血管环对Phe刺激后张力的变化 表1显示:通过AMG(1×10-4mol·L-1)预处理后相比较,各组主动脉血管环对1×10-7~1×10-5mol·L-1Phe诱导的收缩幅度均有升高;尤其在AMG预处理20 min前后LPS组大鼠主动脉血管环对1×10-5mol/L Phe引起的最大收缩幅度的差值 (54.17% ±7.92%),明显高于sham组和LPS+PMX-B组(P<0.01);LPS+PMX-B组大鼠预处理前后差值与LPS组相比则明显降低(P<0.01);PMX-B组与sham组相 比无统计学意义(P>0.01)。
表1 主动脉血管环经AMG预处理前后对Phe刺激的收缩反应Table 1.Effects of phenylephrine(10-8~10-5mol·L-1)on tension of the aorta rings of rat after pretreatment with AMG(1 ×10-4 mol·L-1)(%.±s.n=6)
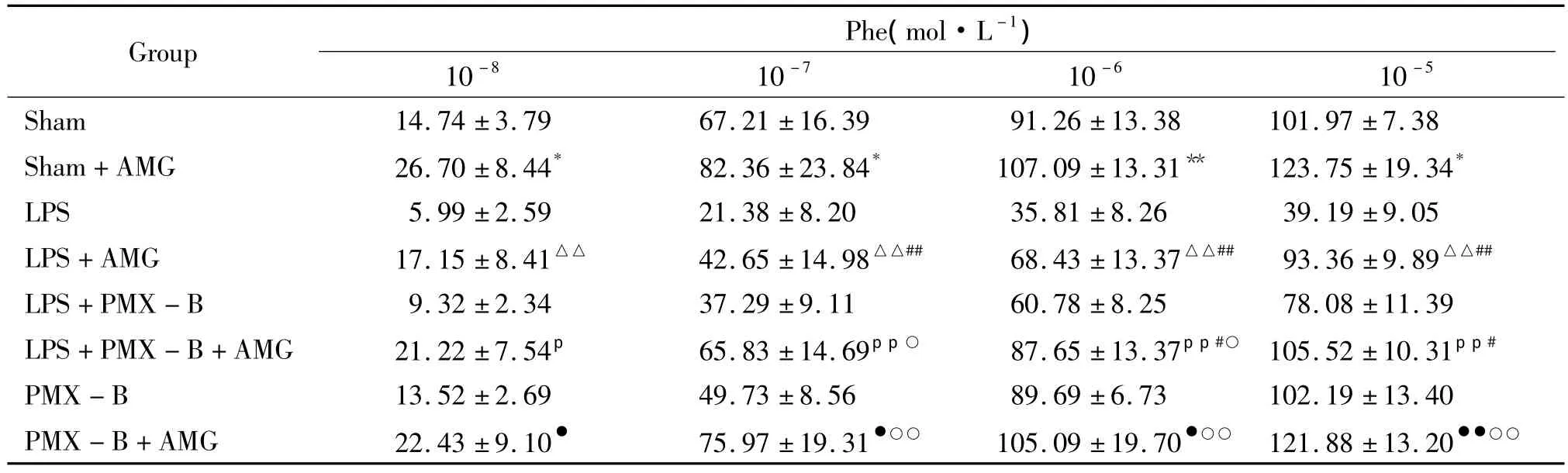
表1 主动脉血管环经AMG预处理前后对Phe刺激的收缩反应Table 1.Effects of phenylephrine(10-8~10-5mol·L-1)on tension of the aorta rings of rat after pretreatment with AMG(1 ×10-4 mol·L-1)(%.±s.n=6)
*P <0.05,**P <0.01 vs sham;△△P <0.01 vs LPS;pP <0.05,ppP <0.01 vs LPS+PMX -B;●P <0.05,●●P <0.01 vs PMX -B;#P <0.05,##P <0.01 vs sham+AMG;○P <0.05,○○P <0.01 vs LPS+AMG.
Phe(mol·L-1)10 -8 10-7 10 -6 10-5 Sham 14.74 ±3.79 67.21 ±16.39 91.26 ±13.38 101 Group.97 ±7.38 Sham+AMG 26.70 ±8.44* 82.36 ±23.84* 107.09 ±13.31** 123.75 ±19.34*LPS 5.99 ±2.59 21.38 ±8.20 35.81 ±8.26 39.19 ±9.05 LPS+AMG 17.15 ±8.41△△ 42.65 ±14.98△△## 68.43 ±13.37△△## 93.36 ±9.89△△##LPS+PMX - B 9.32 ±2.34 37.29 ±9.11 60.78 ±8.25 78.08 ±11.39 LPS+PMX - B+AMG 21.22 ±7.54p 65.83 ±14.69pp○ 87.65 ±13.37pp#○ 105.52 ±10.31pp#PMX - B 13.52 ±2.69 49.73 ±8.56 89.69 ±6.73 102.19 ±13.40 PMX -B+AMG 22.43 ±9.10● 75.97 ±19.31●○○ 105.09 ±19.70●○○ 121.88 ±13.20●●○○
2.3 用 MB(1 ×10-5mol·L-1)预处理后主动脉血管环对Phe刺激后张力的变化 表2显示:通过MB(1 ×10-5mol·L-1)预处理 20 min 后相比较,各组主动脉血管环对 1×10-7~1×10-5mol·L-1Phe诱导的收缩幅度均有升高;从MB预处理前后比较,LPS+PMX-B组主动脉血管环对1×10-5mol/L Phe引起的最大收缩幅度的差值与sham组无显著差异,均明显低于LPS组(P<0.01);PMX-B组与sham组相比无统计学意义(P>0.05)。
表2 主动脉血管环经MB预处理前后对Phe刺激的收缩反应Table 2.Effects of phenylephrine(10-8~10-5mol·L-1)on tension of the aorta rings of rat after pretreatment with MB(1 ×10-5mol·L-1)(%.±s.n=6)
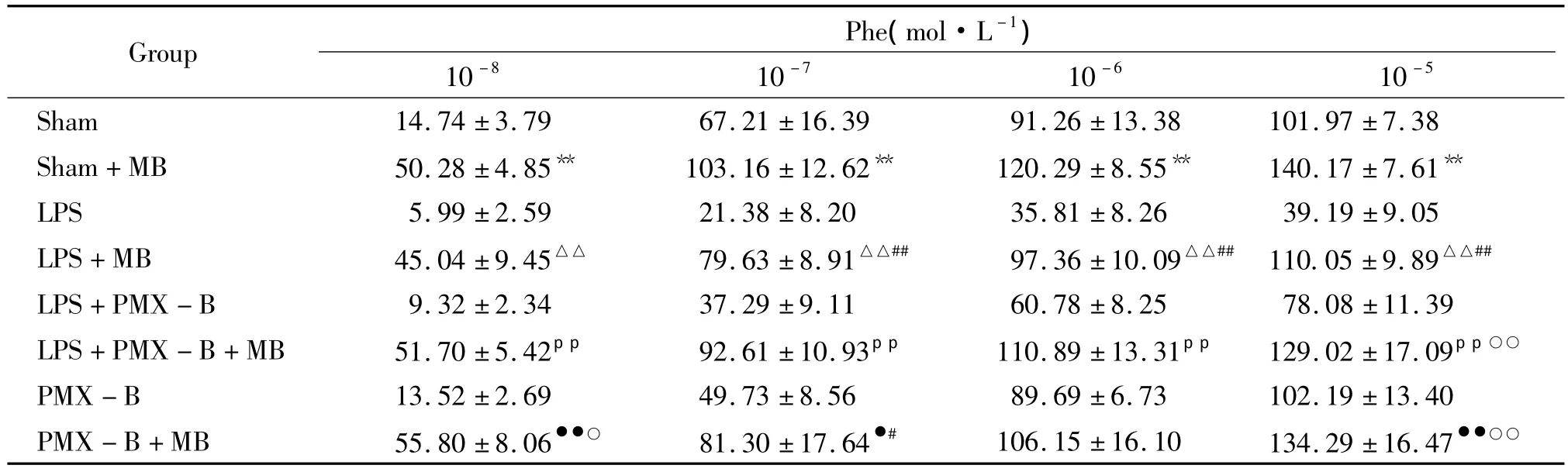
表2 主动脉血管环经MB预处理前后对Phe刺激的收缩反应Table 2.Effects of phenylephrine(10-8~10-5mol·L-1)on tension of the aorta rings of rat after pretreatment with MB(1 ×10-5mol·L-1)(%.±s.n=6)
**P <0.01 vs sham;△△P <0.01 vs LPS;ppP <0.01 vs LPS+PMX -B;●P <0.05,●●P <0.01 vs PMX -B;#P <0.05.##P <0.01 vs sham+MB;○P <0.05,○○P <0.01 vs LPS+MB.
Phe(mol·L-1)10 -8 10-7 10 -6 10-5 Sham 14.74 ±3.79 67.21 ±16.39 91.26 ±13.38 101 Group.97 ±7.38 Sham+MB 50.28 ±4.85** 103.16 ±12.62** 120.29 ±8.55** 140.17 ±7.61**LPS 5.99 ±2.59 21.38 ±8.20 35.81 ±8.26 39.19 ±9.05 LPS+MB 45.04 ±9.45△△ 79.63 ±8.91△△## 97.36 ±10.09△△## 110.05 ±9.89△△##LPS+PMX - B 9.32 ±2.34 37.29 ±9.11 60.78 ±8.25 78.08 ±11.39 LPS+PMX - B+MB 51.70 ±5.42pp 92.61 ±10.93pp 110.89 ±13.31pp 129.02 ±17.09pp○○PMX - B 13.52 ±2.69 49.73 ±8.56 89.69 ±6.73 102.19 ±13.40 PMX -B+MB 55.80 ±8.06●●○ 81.30 ±17.64●# 106.15 ±16.10 134.29 ±16.47●●○○
3 生化指标检测
表3显示,LPS组大鼠血浆中iNOS浓度、NO含量及TNF-α水平较sham组明显增高(P<0.01);LPS+PMX-B组较LPS组降低明显(P<0.01);而PMX-B组与sham组相比差异无统计学意义(P>0.05)。
讨 论
败血症休克的主要特征之一是全身不可逆性低血压。给实验动物注射纯化的LPS来模拟败血症休克是近年来国际上比较通用的有效手段[5-6],LPS进入体内能刺激多种组织因子及血管活性物质过量表达,从而导致心血管功能障碍,表现为体循环血管舒张和对血管收缩剂反应性降低。NO的过量生成是导致败血症休克全身不可逆性低血压的主要原因[3-4]。内源性NO主要是由一氧化氮合酶(NOS)催化L-精氨酸生成的。NO在败血症休克中起“双刃剑”作用,适量的NO可引起血管舒张,降低血流阻力,抑制血小板聚集,防止小血管栓塞,增加心、脑等重要脏器的血流量,对机体有保护意义;但是NO过量产生会导致血管过度扩张,血管平滑肌对缩血管物质的反应性降低,造成全身不可逆性低血压和循环衰竭。NO进入细胞后激活可溶性GC,使GTP转变为cGMP,激活蛋白激酶 G的活性增加[8],而cGMP依赖性蛋白激酶使钙内流减少,增加肌浆网钙ATP酶对钙的摄取或直接作用于收缩蛋白去磷酸化,从而产生舒血管作用[9]。NO是自由基,当形成OONO-时具有严重的细胞毒性作用[10]。
表3 大鼠血浆中NO、iNOS和TNF-α水平的变化Table 3.Changes of the plasma levels of NO,iNOS and TNF-α in rats of each group(±s.n=6)
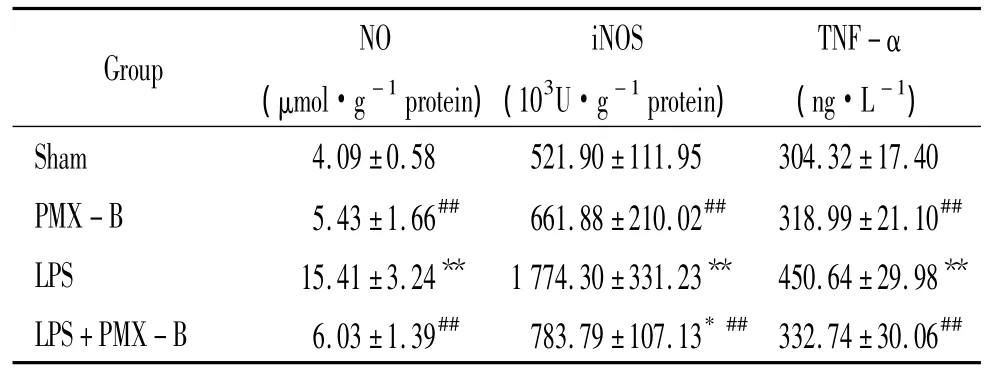
表3 大鼠血浆中NO、iNOS和TNF-α水平的变化Table 3.Changes of the plasma levels of NO,iNOS and TNF-α in rats of each group(±s.n=6)
*P <0.05,**P <0.01 vs sham group;##P <0.01 vs LPS group.
Group NO(μmol·g-1protein)iNOS(103U·g-1protein)TNF-α(ng·L-1)Sham 4.09 ±0.58 521.90±111.95 304.32±17.40 PMX -B 5.43±1.66## 661.88±210.02## 318.99±21.10##LPS 15.41±3.24** 1 774.30±331.23** 450.64±29.98**LPS+PMX -B 6.03±1.39## 783.79±107.13*## 332.74±30.06##
本实验通过腹腔注射LPS复制大鼠内毒素血症模型基础上,整体观察大鼠血压及血清中NO、iNOS和TNF-α水平;同时结合离体血管灌流方法,利用Phe引发血管收缩的原理,旨在探讨LPS诱发的内毒素血症大鼠血管低反应性与iNOS-GC-cGMP信号活化的相关性,同时阐明PMX-B在内毒素血症大鼠血管低反应性的可能作用机制。
多黏菌素(polymyxin)是发现于多黏杆菌(Bacillus polymyxa)培养液中的抗菌性多肽,具有表面活性,含有带阳电荷的游离氨基,能与革兰阴性菌细胞膜的磷脂中带阴电荷的磷酸根结合,使细菌细胞膜面积扩大,通透性增加,细胞内的磷酸盐、核苷酸等成份外漏,导致细菌死亡[11]。PMX-B具有显著抗内毒素作用[7]。
实验结果表明,LPS组大鼠MABP显著降低,而LPS+PMX-B组大鼠MABP则改善明显,与文献报道一致[12];LPS组大鼠血清中NO、iNOS以及TNF-α水平均显著高于sham组;TNF-α是内毒素进入体内诱导机体效应细胞产生炎症反应最重要的细胞因子之一,它与感染的严重程度以及内毒素血症的预后密切相关。离体血管灌流实验血管环张力结果显示,LPS组血管环对Phe刺激的收缩反应量效曲线和对ACh的舒张反应量效曲线均显著低于sham组;而LPS+PMX-B组大鼠血管环对Phe刺激的收缩反应和ACh的舒张反应均明显恢复。研究表明,LPS在大鼠体内可诱导组织、细胞(包括血管内皮细胞和血管平滑肌细胞)产生大量的NO,后者可能通过多种途径削弱血管平滑肌对缩血管物质的反应[4]。
有关Phe刺激血管环的收缩机制,是血管平滑肌细胞内的Ca2+水平升高所致,其主要来源于胞内钙池释放和胞外钙的跨膜内流。胞内钙池主要分为肌醇1,4,5-三磷酸敏感钙池和ryanodine敏感钙池,胞外钙主要通过受体操纵性Ca2+通道(receptor-operated calcium channels,ROCCs)和电压操纵性Ca2+通道(voltage-operated calcium channels,VOCCs)内流。实验分别用特异性iNOS阻断剂AMG和GC抑制剂MB预孵育血管环,结果发现各组大鼠主动脉血管环对Phe引起的收缩反应与孵育前比较均升高,尤其在AMG预处理20 min前后LPS组大鼠主动脉血管环对1×10-5mol/L的Phe引起的最大收缩幅度的差值 (54.17% ±7.92%),明显高于sham组和LPS+PMX-B组;这提示iNOS过量表达产生NO增多为导致血管低反应性的主要原因[13]。而GC抑制剂MB预处理20 min前后,LPS+PMX-B组主动脉血管环对1×10-5mol/L Phe引起的最大收缩幅度的差值与sham组无显著差异,均明显低于LPS组,这也说明PMX-B可能通过抑制iNOS-GC-cGMP信号活化,减少iNOS过量表达,从而改善内毒素血症大鼠的血管低反应性[14]。
综上所述,iNOS-GC-cGMP信号活化参与了内毒素血症大鼠血管低反应性;多黏菌素B可以改善内毒素血症大鼠血管低反应性。多黏菌素B对内毒素有灭活作用,从而使大鼠血清TNF-α水平降低,改善内毒素血症大鼠血管的低反应性,抑制iNOS-GC-cGMP信号活化,减少iNOS过量表达,减少NO过量生成,从而改善内毒素血症大鼠的血管低反应性;至于是否还有其它机制参与尚需进一步的深入研究。
[1]Opal SM.Endotoxins and other sepsis triggers[J].Contrib Nephrol,2010,167:14 -24.
[2]王吉耀.脓毒性休克[M]∥王吉耀.内科学.第2版.北京:人民卫生出版社,2010:1214-1215.
[3]Scott JA,Machoun M,McCormack DG.Inducible nitric oxide synthase and vascular reactivity in rat thoracic aorta:effect of aminoguanidine[J].J Appl Physiol,1996,80(1):271-277.
[4]Shan Q,Bourreau J.Cardiac and vascular effects of nitric oxide synthase inhibition in lipopolysaccharide-treated rats[J].Eur J Pharmacol,2000,406(2):257 - 264.
[5]Tu J,Shan Q,Jin H,et al.Endothelin-1-mediated coronary vasoconstriction deteriorates myocardial depression in hearts isolated from lipopolysaccharide-treated rats:interaction with nitric oxide[J].Clin Exp Pharmacol Physiol,2004,31(9):571 -574.
[6]Yao H,Tu J,Shan QX,et al.Endothelin -1 and nitric oxide mediated the lipopolysaccharide-induced cardiac negative inotropic role[J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2009,25(2):228 -232.
[7]戚仁斌,陆大祥,颜 亮,等.甘氨酸和多黏菌素B拮抗内毒素活性及机制的研究[J].中国病理生理杂志,1999,15(8):1078 -1082.
[8]郭 君,王学敏,支建明,等.选择性阻断cGMP依赖性蛋白激酶对内毒素孵育的大鼠血管环收缩功能的影响[J].上海交通大学学报:医学版,2011,31(6):764 -768.
[9]Nickl CK,Raidas SK,Zhao H,et al.(D)-Amino acid analogues of DT-2 as highly selective and superior inhibitors of cGMP - dependent protein kinase Iα[J].Biochim Biophys Acta,2010,1804(3):524 -532.
[10]Titheradge MA.Nitric oxide in septic shock[J].Biochim Biophys Acta,1999,1411(2 -3):437 -455.
[11]周颖杰,施耀国.多黏菌素B治疗耐多药病原菌研究进展[J].国家药学研究杂志,2008,35(4):291 -294.
[12]邵 阳,王 翔,蔡绍皙,等.多黏菌素B对内毒素血症大鼠血流动力学作用[J].重庆大学学报:自然科学版,2002,25(4):84-86.
[13]Kandasamy K,Prawez S,Choudhury S,et al.Atorvastatin prevents vascular hyporeactivity to norepinephrine in sepsis:role of nitric oxide and α1- adrenoceptor mRNA expression[J].Shock,2011,36(1):76 -82.
[14]Korkmaz B,Buharalioglu K,Sahan-Firat S,et al.Activation of MEK1/ERK1/2/iNOS/sGC/PKG pathway associated with peroxynitrite formation contributes to hypotension and vascular hyporeactivity in endotoxemic rats[J].Nitric Oxide,2011,24(3):160-172.
