妊娠晚期腹腔注射酸性磷酸缓冲液对两个近交系小鼠繁育生理影响的对比分析
2012-01-30戴丽军黄月玲周敏仪安胜利劳淑贞高蔚樱朴金松谭小军
戴丽军,黄月玲,周敏仪,安胜利,任 韵,劳淑贞,高蔚樱,朴金松,谭小军,侯 敏
(1.广州医学院实验动物中心,广州 510182;3.南方医科大学公共卫生与热带医学学院生物统计学系,广州 510515;
2.广州医学院附属肿瘤医院、肿瘤研究所,4.病理科,广州 510095)
SPF级C57BL/6J(B6)和BALB/c(B/c)是较早培育出的实验小鼠近交品系,被广泛应用于生理学、遗传学、免疫学和肿瘤学等领域的研究中,是目前国际上用量最大的实验动物之一[1]。在广州医学院2011年开展的科研类小鼠动物实验中,B6和B/c的使用量占95%以上,这其中又有50%是用于生殖或以生殖为基础的实验研究(内部统计资料),由此可见,繁殖育种是实验过程中经常会涉及到的问题,提高雌性受孕率、准确判断孕龄、掌握动物生长规律是提高实验效率和保证实验效果的重要手段。
我们在实验性小鼠肺腺癌的科研工作中不仅使用了SPF级B6和B/c小鼠,而且实施了限时交配、判断受孕、定时妊娠、妊娠晚期腹腔注射等实验方法(部分工作已发表[2]),对这两个品系的小鼠在交配方式与受孕率的关系以及阴栓阳性、阴性的受孕作了仔细的记录;同时,还对母鼠在妊娠晚期接受腹腔注射缓冲液后的孕期、离乳的子鼠数量以及子鼠早期生长发育情况等方面进行了观察,并就妊娠晚期腹腔注射缓冲液对两个品系小鼠繁育生理的影响做了进一步的分析。本文总结了实验对照组的有关数据,比较分析腹腔注射对两个品系小鼠繁育生理影响的差异,为在实验研究中合理使用这两个品系的小鼠提供更多的背景资料。
1 材料和方法
1.1 实验动物及实验环境
4~6周龄的SPF级B6和B/c小鼠(雄性各20只,雌性各60只)购自广东省医学实验动物中心【生产许可证:SCXK(粤)2008-0002】,在检疫室生活1周后,进入广州医学院实验动物中心SPF级实验室【使用许可证:SYXK(粤)2010-0104】饲养并进行交配实验。实验室条件为:室内温度为20℃ ~26℃,相对湿度为40% ~70%,明暗交替为12h∶12h。动物自由饮用无菌酸化水(pH 2.5~3.0)和食用60Co灭菌的全价营养饲料(广东省医学实验动物中心提供),饮水每周更换1~2次,垫料视每盒小鼠的数量每周更换1~2次,所用物品均通过高温高压灭菌(121℃,30m in),饲养流程严格按照 SPF级实验动物设施 SOP操作。有关实验程序由广州医学院实验动物伦理委员会审核批准,符合中国动物实验的福利伦理准则;所有实验人员经过实验动物相关知识培训,取得合格证。
1.2 仪器与试剂
JJ100电子天平(精确到0.01g,常熟双杰测试仪器厂制造),用于体重测定。
磷酸氢二钠(Na2HPO4)、柠檬酸(citric acid)分别购自广州化学试剂厂及天津市大茂化学试剂厂,腹腔注射用缓冲液为0.2M Na2HPO4/0.1M citric acid(pH 6.0),0.22mm滤器过滤除菌;组织标本由乙醇、多元醇、冰乙酸、磷酸二氢钠、磷酸氢二钠等多种成分组成的复合固定液(上海玺华科贸有限公司)固定。
1.3 动物实验
B6和B/c小鼠鼠龄满10周、雌雄体重分别达到19 g~20g和21g~22g开始交配。交配前48h将雄鼠单独分到一个盒内,交配当天下午17点将雌鼠放入雄鼠盒内,次日上午8点将雄鼠移出交配的盒子,并检查雌鼠阴栓的情况。交配的当天记为妊娠0d,交配后的10d~14d间根据雌鼠增大的腹部和∕或体重确定其是否受孕;雄鼠休息 3d~7 d后,以同样的方式再次用于交配。交配的第1、3次,采取2:1(♀/♂)全同胞兄妹近亲交配方法,其余的采取1:1的方法,交配的方式方法、交配的时间和地点在两个品系均完全匹配。

表1 交配方式与受孕率的关系Tab.1 The correlation between mating method and pregnancy rate
妊娠雌鼠单独饲养,在交配的第17天下午3~4点之间接受腹腔注射缓冲液,剂量为10m L/kg体重,记录生产日期(即:孕期);子鼠25日龄离乳,测量其体重,记录雌雄子鼠数量(即:存活子鼠数量),自离乳之日起到满8周龄,每周称子鼠体重1次。离乳之后的母鼠不再用于交配实验,因此,所有子鼠均为母鼠第1胎产生。
1.4 短期动物实验及病理观察
交配的方法如上所述,母鼠在接受腹腔注射缓冲液后24h被处死,立即取出子宫,观察胚胎的存活情况和数量,并将母鼠的肝、右肾、脾和肺脏以及每一只胚胎去头尾后固定,进行常规病理石蜡标本的处理,4μm切片,HE染色,镜下观察。
1.5 统计学方法
2 结果
2.1 不同交配方式下B6和B/c小鼠受孕率的比较
我们首先观察到不同交配方式下两个品系小鼠的受孕率有所不同(表1),总的情况是B6较B/c为高,特别是在2雌1雄的交配方式下,B6每次都有1只雄鼠同时使2只雌性受孕,而B/c一次都没有;两组受孕率的差异无统计学意义,这主要是由于数据的变异度较大、样本量不够所致检验效能较低而引起(power<0.146)。此外,B/c每次的受孕率相对稳定(标准差较小),而B6的受孕率变异较大,表明B6的交配和受孕可能容易受到种种外在和内在因素的干扰。
2.2 阴栓与受孕的关系
观察结果显示,阴栓阳性的受孕率在B6和B/c不同(表2),分别为37.3%和63.6%,具有显著差异(P=0.010),由此可见,即使在仅15h的限时交配条件下,用阴栓来判断小鼠是否发生交配和受孕不是很好的指标,特别是在不同的品系中应用,差别可能会较大。

表2 阴栓与受孕有关系Tab.2 The correlation between vaginal plug and pregnancy
2.3 腹腔注射对孕期及子鼠数量的影响
自注射缓冲液之日起,每天上午11点和下午4点观察B6和B/c孕鼠的生产情况,并规定11点之前生产的记为整天,11点之后、4点之前生产的加0.5d,如此记录孕期,同时还尽可能记录产仔数量。我们观察到,B6的孕期稍长于B/c的,具有统计学差异(表3,P=0.036);离乳的较出生的子鼠数量为少,B/c较B6存活的子鼠量为多,差异之处在于B6所失去的主要为雄性子鼠,但品系间的差别均没有统计学意义(表3)。
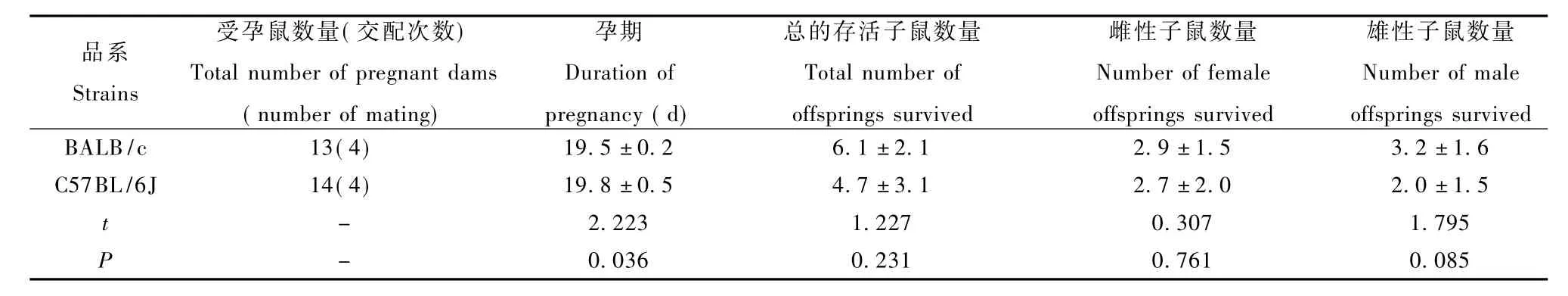
表3 腹腔注射对B6和B/c受孕鼠孕期及离乳子鼠数量的影响Tab.3 Impact of intraperitoneal injection on the duration of pregnancy of B6and B/c dams and number of weaned offsprings

表4 C57B6/6J和BALB/c第一胎E18.5天胚胎的数量及体重Tab.4 The number and body weight of E18.5d fetuses from primigravid of C57BL/6J and BALB/c
2.4 腹腔注射对孕鼠主要器官及胚胎的影响
由于离乳子鼠数量的减少,我们补充了短期动物实验,以明确腹腔注射缓冲液对孕鼠和子鼠所产生的影响,小鼠来源和鼠龄以及交配的环境、方式完全相同,腹腔注射后24h(也就是孕期达到18.5d、母鼠生产前)处死母鼠,对母鼠腹腔和其主要器官及胚胎进行病理观察。结果显示,母鼠腹膜光滑,腹腔内无渗出,所观察的器官和胚胎中没有明显的急性病变(结果未显示);每只受孕鼠的胚胎数3~11只不等,平均为7.8个(表4);一窝胚胎的体重相近,数量少的体重可能会大一点,B6平均的胚胎体重较B/c的为大,差异具有显著性(表4,P= 0.000);此外,38只B/c胚胎中有一只为死胎,而31只B6胚胎均为活的。这些结果说明,腹腔注射对母鼠及胚胎的直接影响均比较小。
2.5 子鼠早期生长发育状况的比较
从离乳到第8周的体重所体现的子鼠早期生长发育情况(图1)表明,除了第5周之外,无论是雄性还是雌性,每一观察点的体重B6的均显著低于B/c的(P均<0.05),显然,B/c子鼠的生长在8周时达到了平台,而B6子鼠的体重却还在缓慢地增长(图1),二者早期的生长趋势确实不同(重复测量方差分析的交互效应显示P=0.000)。
3 讨论
用定时交配(timed-mating)的方法来产生定时妊娠(timed-pregnancy)小鼠是许多研究所必需的,如作者的实验要在妊娠的第17天腹腔注射致癌剂就是一个例子,因此,产生受孕鼠成为提高实验效率的前提条件,包括两个方面:一是使更多的雌鼠受孕,二是能够准确判断雌鼠受孕。使雌鼠受孕的方法基本为1雄1雌或1雄2(多)雌的交配方式,从我们的结果来看,1雄1雌的方式较好,品系间存在的差异(表1)即使没有统计学意义,由于每一只受孕鼠都能产生一定量的子鼠,因而客观实际效果明显;1雄2(多)雌并不能提高受孕率,原因恐怕有许多,其中一个重要的原因可能是雄鼠再次发情需要一定的时间,而定时交配在时间上要求严格,对于费时、费钱的动物实验,选准交配方式可以节省很多。

图1 C57BL/6J和BALB/c子鼠生长曲线注:利用“重复测量方差分析”的方法比较两品系、同性别小鼠在各观察点的体重及其增长趋势,结果为:雌性:周主效应F=904.464,P=0.000,品系主效应F=11794.651,P=0.000,交互效应F=27.768,P=0.000;雄性:周主效应F=2016.379,P=0.000,品系主效应F=18211.617,P=0.000,交互效应F=11.248,P=0.000;单纯效应:除了第5周之外,所有其他观察点组间比较均有显著性差异,P<0.05。Fig.1 The growth curve of C57BL/6J and BALB/c offspringsNote:Repeated measurement analysis was employed to analyze the body weight at each observation time point and the trend of body weight gain with time.The results were as follows:Female:Week F=904.464,P=0.000,strain F=11794.651,P=0.000,interactive effect F=27.768,P=0.000;Male:Week F=2016.379,P=0.000,strain F=18211.617,P=0.000,interactive effectF=11.248,P=0.000;Simple effect:P<0.05at all time points except Week 5.
判断受孕的方法有:阴栓判断法[3]、阴道涂片法[4]、体重检测法[5,6]、腹部增大观察法[7]及技术要求较高的血清检测、监测法[5]和超声检测法[8]等。这些方法各有优缺点,阴道涂片法虽简单,但需连续观察数天才能确切判断,有一定的工作量,并对母鼠的操作较多;阴栓判断法因简单易行而被广泛采用,而我们的研究发现阴栓阳性的受孕率实际上并不高,品系间的差异也较大(表1),效率有限;比较而言,体重检测法和腹部增大观察法判断受孕的准确率较高,但对只有2、3只胚胎的妊娠可能会漏判,且需10~14d左右,对需要在妊娠早期进行的实验不适用,而在此基础上改良的体重增加百分率或交配后1周体重与交配时基础体重的差别可能是判断受孕最易、最省、最准、又能较为早期判断受孕的方法[5,6]。无论选择怎样的方法,关键在于结合具体的实验要求和符合花费-效果(cost-effect)的原则。
我们的结果显示,妊娠晚期腹腔注射酸性缓冲液对母鼠和胚胎的直接影响都比较小,但是,实际离乳的子鼠数量却在两个品系都有减少,以B6减少更为明显(从预期的7.8个到实际的4.7个,表3、4),这一减少似乎与孕期没有直接的联系,因为孕期是由基因决定的[9],而 B6的孕期又较 B/c的显著延长(表3,P=0.036),并且我们观察到子鼠多是在出生后3d之内被母鼠食掉的。因此,我们认为,腹腔注射对母鼠繁育生理的影响可能是多方面的:操作和酸性缓冲液对腹膜的刺激所产生的疼痛对继而发生的生产有负性作用,尽管这些疼痛可能不强,也比较短暂,不足以导致早产的发生,却足以激惹母鼠,导致母鼠母性较差,发生食仔现象;还有,操作和疼痛可能客观上对初期乳汁的产生有负性作用,从而导致乳汁量不够,少数新生鼠发生死亡,然后被母鼠清除,所不同的是,B/c可能要比B6小鼠的耐受性好些,受到的影响小些。有关妊娠期间操作对母鼠及子鼠的影响文献中有报道,慢性的、重复的操作可以与同时给予的药物产生叠加作用,导致永久的损伤[10],我们目前还不能很好解释为什么B6品系失去更多的为雄性子鼠,样本量不足可能是一个原因。
由体重监测的子鼠早期生长发育的状况进一步阐明了腹腔注射和酸性缓冲液对母鼠繁育生理的影响,B6小鼠18.5d的胚胎平均体重要比 B/c的为大(表4),离乳时的体重反而较 B/c的为小(图1),二者均具有统计学差异(P =0.000),说明腹腔注射可能对 B6的哺乳过程影响较大,因为在其每窝新生鼠平均数量少的情况下,似乎这些新生鼠没有茁壮成长;从整体上看,B6子鼠离乳后,短期内快速生长(thrive),到第5周时达到了他们应有的体重(catch-up),而5周之后的生长曲线可能才是真正反映B6品系的生长发育趋势。我们比较了文献报道的B6小鼠从离奶(21d)到10周的体重[11],5~8周的数据与本实验的十分接近,所存在的微小差异可能来自饲料,我们用的是60Co灭菌的全营养维持饲料,而文献中用的是高压灭菌饲料;另外,我们的数据标准差较大,而文献中的甚小。
总之,实验动物近交品系在长期严格近交繁育的过程中,形成了各自的遗传特性,在繁殖生理和生长特性等方面,品系间具明显差异[12-14],对各品系繁殖方法、繁育特性和生长发育的跟踪分析,可以为合理设计动物实验提供科学数据和理论基础[14];受孕鼠在妊娠期间对各种微小操作都可能极为敏感,操作容易产生负性作用,影响繁育生理过程,对这些负性作用的充分认识,有助于课题的合理设计和实验结果的可重复性。
[1]邹移海,徐志伟,苏钢强.实验动物学[M].北京:科学出版社,2004:75-76.
[2]侯敏,戴丽军,谭小军,等.小鼠肺腺癌模型的建立及肿瘤病理分析[J].中国实验动物学报,2012,20(4):75-79.
[3]高雅,林自力,张鸿波,等.自然发情与诱导发情小鼠子宫内膜中雌激素受体 α表达的比较[J].中国实验动物学报,2010,18(2):168-171.
[4]宋波,武柏林,孙素菊,等.孕期及哺乳期钙及维生素 D3干预对铅暴露小鼠骨骼铅动员影响的析因设计研究[J].环境与健康杂志,2011,28(10):877-880.
[5]Hau J,Skovgaard Jensen HJ.Diagnosis and monitoring of pregnancy in mice:correlations between maternal weight,fetal and placental mass and the maternal serum levels of progesterone,pregnancy-associated murine protein-2 and alpha-fetoprotein[J].Lab Anim,1987,21(4):306-310.
[6]Mader SL,Libal NL,Pritchett-Corning K,et al,Refining timed pregnancies in two strains of genetically engineered m ice[J].Lab Anim(NY),2009,38(9):305-310.
[7]Silver LM.Mouse genetics:concepts and applications[M].New York:Oxford University Press,1995,Vol.1,Chap.4,62-75.
[8]Brown SD,Zurakowski D,Rodriguez DP,et al.Ultrasound diagnosis of mouse pregnancy and gestational staging[J].Comp Med,2006,56:262-271.
[9]Murray SA,Morgan J L,Kane C,et al.Mouse gestation length is genetically determined [J]. PLoS One, 2010, 5(8):e12418.
[10]Morales-Otal A,Olayo-Lortia J,Fernandez-Soto C,et al.The mild stress of chronic prenatal injections may have additive effects on drugs administered during pregnancy to alter brain sexual differentiation[J].Neuro Endocrinol Lett,2010,31(5):708-716.
[11]吴清洪,顾为望,张嘉宁,等.SPF级C57BL/6J小鼠生长发育和繁殖性能指标的测定[J].中国比较医学杂志,2006,16(10):606-607,614.
[12]任连生,白喜花,闫磊,等.SX1近交系小鼠生长繁育主要指标的测定[J].中国比较医学杂志,2007,17(8):470-472.
[13]戴丽军,叶炳飞,黄月玲,等.Fm r1基因敲除对小鼠生理发育和繁殖性能的影响[J].中国比较医学杂志,2011,21(1):64-66.
[14]Nagasawa H,Koshimizu U.Difference in reproductivity and offspring growth between litter numbers in four strains of mice[J].Lab Anim,1989,23(4):357-360.
