泛昔洛韦缓释胶囊的体外释放度研究
2012-01-30吴起娟王亚娜郭骥宇
吴起娟 王亚娜 郭骥宇
(丽珠医药集团丽珠研究所,广东 珠海 519000)
泛昔洛韦(Famciclovir,FCV)是为改善喷昔洛韦(penciclovir,PCV)的生物利用度而研制的前药,为喷昔洛韦的6-脱氧衍生物的二乙基酰脂。其口服吸收好,生物利用度高,临床上用于抗孢疹病毒,治疗带状孢疹和生殖器孢疹。泛昔洛韦片每天需服药三次,且有胃肠道反应,为了减少服药次数,提高疗效,降低不良反应的发生,开发了泛昔洛韦缓释胶囊[1]。笔者主要对泛昔洛韦缓释胶囊体外释放度进行研究,现报道如下。
1 仪器与试药
1.1 仪器
ZRS-8G、RCZ-5A智能型药物溶出仪(天津大学精密仪器厂),UV-160A型、UV2401型紫外分光光度计(日本岛津)。
1.2 试药
泛昔洛韦缓释胶囊(100509、100517、100519三批,丽珠制药厂提供,规格每粒125mg);泛昔洛韦对照品(四川抗菌素工业研究院,含量按干燥品计为99.50%)
2 方法与结果
2.1 释放度测定方法
取本品,照释放度测定法(中国药典2010年版二部附录XD第一法),采用转篮法,以0.1mol/L盐酸溶液750mL为溶剂,转速为100rpm/min,温度为(37±0.5)℃,依法操作,经1.5h,加入37℃的0.2mol/L磷酸钠溶液调pH至(6.8±0.05)250mL,于1.5、3、8h取液10mL(及时补充10mL溶出介质),过滤,取续滤液5mL用溶出介质定容至25mL,作为供试溶液。另取对照品25mg,精密称定后,分别用0.1mol/L盐酸溶液和0.2mol/L磷酸钠溶液(调pH至6.8±0.05)溶解并稀释成每毫升含25μg的溶液,作为对照溶液。取以上供试溶液和对照溶液,照紫外分光光度法(中国药典2010年版二部附录IVA),在305nm波长处测定吸光度,计算每粒胶囊在不同时间的释放量,本品每粒在1.5、3与8h的释放量应分别为标示量的10%~30%、30%~70%与70%以上,均应符合规定。
2.2 检测波长的选择
取泛昔洛韦对照品适量,分别用0.1mol/L盐酸溶液和0.2mol/L磷酸钠溶液(调pH至6.8±0.05)配制成25μg/mL的溶液,采用紫外风光光度法,于200~400nm波长范围内扫描,结果泛昔洛韦的0.1mol/L盐酸溶液在224nm、248nm、314nm处有吸收峰,泛昔洛韦的0.2mol/L磷酸钠溶液(调pH至6.8±0.05)在221nm、243nm、305nm处有吸收峰,因在305nm处有最大吸收,且泛昔洛韦的0.1 mol/L盐酸溶液在305nm处和314nm处吸收值相近,因此选择305nm为检测波长。
2.3 标准曲线的制备
精密称取泛昔洛韦对照品25mg,加0.1mol/L盐酸溶液定容至100mL容量瓶中备用,作为储备液。分别精密吸取上述溶液2.0、4.0、6.0、8.0、10.0mL,加0.1mol/L盐酸溶液定容至50mL容量瓶。以0.1mol/L盐酸溶液为空白,在305nm处测定吸光度,以吸光度A对浓度C(μg/mL)进行线性回归,得到标准曲线方程A=0.0214C+0.0032,r=1.0000。结果说明在10~50μg/mL范围内线性关系良好。换0.2mol/L磷酸钠溶液调pH至(6.8±0.05)溶剂,同上法测定,得到标准曲线方程A=10.606C+0.0017,r=0.9999.结果说明在10~50μg/mL范围内线性关系良好。
2.4 回收率试验
以0.1mol/L盐酸溶液为溶剂,配制成高、中、低浓度(15、25、35μg)的泛昔洛韦对照品溶液,测定吸光度,计算回收率。结果三个浓度平均回收率为100.9%、99.8%、100.7%,RSD为0.99%、0.47%、0.75%(n=3),可信限为±1.13、±0.53、±0.86。换0.2mol/L磷酸钠溶液(调pH至6.8±0.05)溶剂,同上法测定,结果三个浓度平均回收率为100.9%、100.5%、100.8%,RSD为0.64%、0.11%、0.20%(n=3),可信限为±0.74、±0.13、±0.23,均符合标准。
2.5 精密度试验
精密称取2.3项下的储备液5mL,加0.1mol/L盐酸溶液定容至50mL容量瓶中,在305波长处连续测定吸光度6次,结果RSD=0.15%(n=6),可信限为±0.0003。换0.2mol/L磷酸钠溶液(调pH至6.8±0.05)溶剂,同上法测定,结果RSD=0.13%(n=6),可信限为±0.0006。中间精密度试验(更换试验人员和仪器)结果仍与上一致,均符合标准。
2.6 稳定性试验
将2.5项下溶液,放置4、8、12h后测定,结果在0.1mol/L盐酸溶剂和0.2mol/L磷酸钠溶剂调pH至(6.8±0.05)下,RSD分别为0.66%和0.36%,说明本品在12h内稳定,本方法具有良好的稳定性。
2.7 释放度的测定
照2.1项方法,测定泛昔洛韦缓释胶囊三批(100509、100517、100519批)的释放度,带入2.3项下回归方程中计算,结果见表1和图1。

表1 泛昔洛韦缓释胶囊三批累积释放度
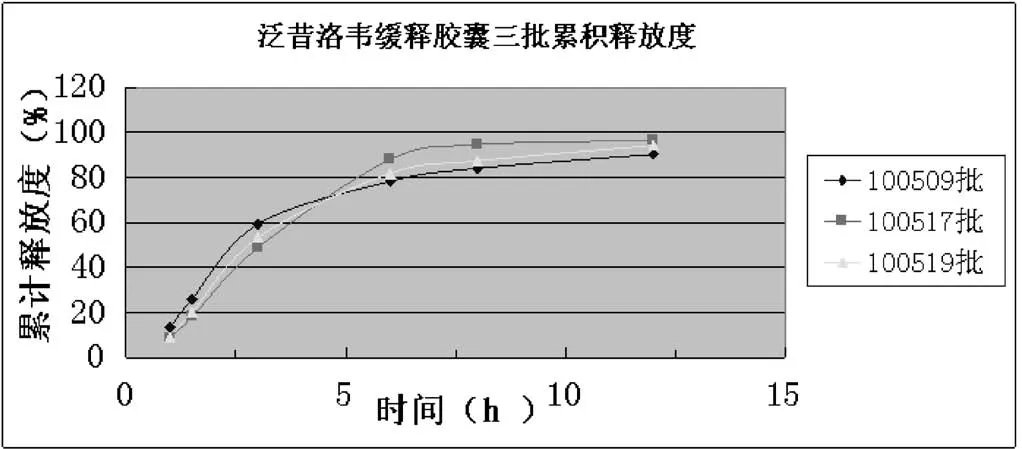
图1 泛昔洛韦缓释胶囊三批累积释放度
2.8 释药模型拟合
根据2.7项下的三批泛昔洛韦缓释胶囊释放度结果,分别用零级方程、一级方程和Higuchi方程进行拟合,结果一级方程相关系数r最大,均方误差MSE最小,故确定本品释药模型为一级释放,三批样品模拟方程k值平均为-0.354,拟合方程为ln(1-Q)=-0.354t+0.2188。
3 讨 论
3.1 在释放介质的选择方面,0.1mol/L盐酸溶液为模拟胃液情况,0.2mol/L磷酸钠溶剂调pH至(6.8±0.05)为模拟肠液情况,且泛昔洛韦在此两种介质中释放良好。选择在1.5h时加入0.2mol/L磷酸钠溶剂调pH至(6.8±0.05)为模拟药物在人体内释放过程,据文献报道,小丸在胃内停留时间为1.5h左右,而泛昔洛韦缓释胶囊内容物即为小丸[2]。
3.2 该缓释胶囊在1.5h内累积释放<30%,突释现象控制较好,3h内累积释放在50%左右,释放速度平稳,8h内累积释放达到90%左右,释放完全[3]。符合规定的释放量,符合药典中《缓释、控释和迟释制剂指导原则》。
[1]国家药典委员会.泛昔洛韦胶囊.中国药典2010年版二部[M].北京:中国医药科技出版社,2010:375.
[2]胡海棠,谭志刚,王晓丹,等.泛昔洛韦缓释胶囊的人体药代动力学研究及其特征分析[J].中国临床药理学与治疗学,2008,12(6).679-683.
[3]张锦.泛昔洛韦制剂含量测定方法研究[J].中国药业,2008,17(10):35-36.
