高效液相色谱-串联质谱测定奶粉中3种苯并咪唑类药物残留
2012-01-29陈惠兰沈崇钰
汤 娟,吴 斌,景 苏,蒋 原,陈惠兰,丁 涛,沈崇钰
(1.南京工业大学理学院,江苏 南京 210009;2.江苏出入境检验检疫局动植物与食品检测中心,江苏 南京 210001)
苯并咪唑类驱虫剂是一类化学合成的抗蠕虫药物,它具有驱虫广谱、驱虫效果好、毒性低等特点,不仅对成虫,而且对幼虫也有效。目前已经商品化的苯并咪唑类驱虫药有阿苯达唑(Albendazole,AB)、奥芬达唑(Oxfendazole,OF)、芬苯达唑等(Fenbendazole,FB),其结构式示于图1。虽然苯并咪唑类药物毒性较低,但有文献报道,阿苯达唑和奥芬达唑高剂量或长时间使用会对多种动物体的胎儿有致畸作用和胚胎毒性。世界卫生组织,中国和欧盟规定了动物源性食品中苯并咪唑类驱虫药的最大残留限量。国际食品法典委员会规定其在牛奶中的残留限量为:阿苯达唑,芬苯达唑和奥芬达唑均为100μg/kg;欧盟规定的残留限量为:阿苯达唑100μg/kg,芬苯达唑10μg/kg,奥芬达唑10μg/kg;我国农业部规定的残留限量与国际食品法典委员会的规定相同[1]。
目前,测定苯并咪唑类药物的方法包括高效液相色谱-紫外检测法[2-3]、气相色谱-质谱联用法和高效液相色谱-质谱联用法[4-5]等,由于液质联用法具有定性准确、检测限低和无须衍生化等特点,是苯并咪唑类药物的首选检测方法。针对血液基 质[6-9],生 物 组 织 样 品[10-12]和 禽 肉 类 产品[13-14],使用有机溶剂直接提取或缓冲溶液稀释反相固相萃取净化的方法不能完全适用于奶粉基质。本研究针对奶粉基质中含有大量蛋白和脂肪干扰物的特点,利用1%乙酸的甲醇作为提取溶液,正己烷和阳离子固相萃取两步净化,有效去除全脂奶粉中的抑制干扰物,取得了良好的效果。
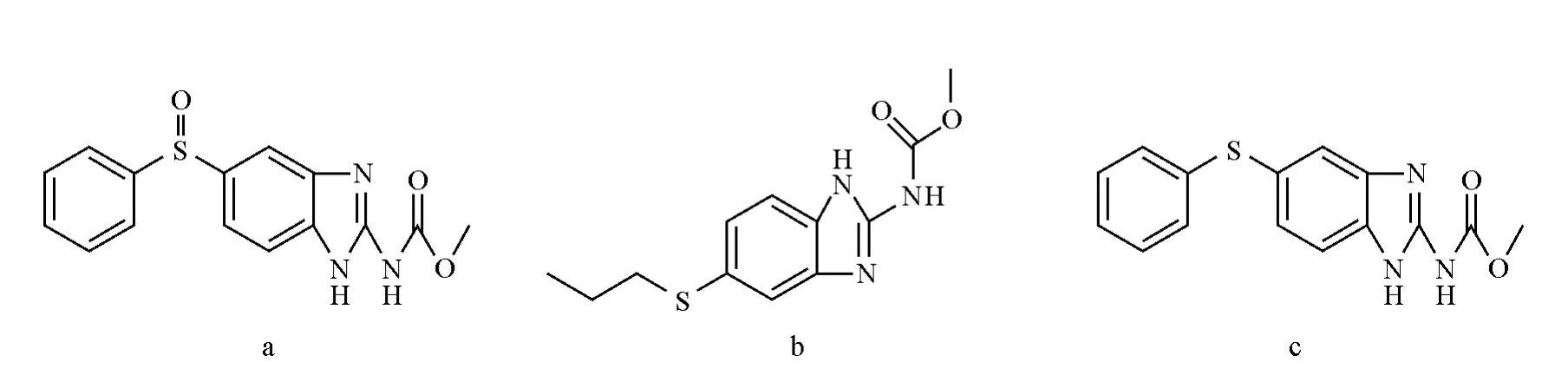
图1 奥芬达唑(a),阿苯达唑(b)和芬苯达唑(c)化学结构式Fig.1 Chemical structure of Oxfendazole(a),Albendazole(b)and Fenbendazole(c)
1 实验部分
1.1 仪器与试剂
Agilent 1200液相色谱系统:美国Agilent公司产品;API 4000Q-Trap串联质谱仪:美国AB Sciex公司产品;甲酸和乙酸(分析纯):南京化学试剂有限公司产品;甲醇和乙腈(色谱纯):德国Merck公司产品;水为去离子水;奥芬达唑,芬苯达唑和阿芬达唑(98%)标准品:德国Dr.Eh-renstorfer GmbH 产品;阳离子固相萃取柱(PCX,60mg/3mL):美国 Agela公司产品。
标准储备液:分别称取适量奥芬达唑,芬苯达唑和阿苯达唑的标准物,用含1%甲酸的甲醇溶液作为溶剂溶解上述3种标准物质,并配制成100mg/L单标储备液,置于-4℃避光保存。
1.2 仪器条件
1.2.1 色谱条件 色谱柱:Phenomenex Kinetex(100mm×4.6mm×2.7μm);流动相:A为含0.5mmol/L醋酸铵和0.1%甲酸的水溶液,B为乙腈;梯度洗脱程序:0~3.0min,10%B;3.0~4.0min,10%~90%B;4.0~9.0min,90%B;9.0~9.5min,90%~10%B;9.5~12 min,10%B。流速:600μL/min;柱温:35℃;进样体积:5μL;分析时间:12min。
1.2.2 质谱条件 离子源:电喷雾离子化源(ESI);扫描模式:正离子扫描;检测方式:多反应监测;电喷雾电压:5 000V;雾化气压力(GS1):320kPa;气帘气压力(CUR):160kPa;辅助 气 流 速 (GS2):310kPa;离 子 源 温 度(TEM):500℃;3种苯并咪唑类化合物的相关检测信息列于表1。

表1 3种苯并咪唑类化合物的质谱测定参数Table 1 Mass parameters of Oxfendazole,Albendazole and Fenbendazole
1.3 样品前处理
1.3.1 提取 称取1.0g(精确到0.01g)样品于50mL塑料具塞离心管中,加入15mL含1%乙酸的甲醇溶液,涡旋1min,50℃水浴超声10min,以8 000r/min高速离心,通过滤纸(中速定性)过滤。重复上述提取步骤,合并提取液于200mL玻璃圆底烧瓶中,加入30mL正己烷,振荡10min,静置待完全分层,去除上层正己烷后,静置过夜沉淀。将静置过夜后的溶液过滤,于40℃水浴旋转蒸发至干,加入20mL水溶解残渣(pH 约2.5)。
1.3.2 净化 分别用3mL甲醇和水先后活化PCX小柱,将滤液过柱,并用水和甲醇先后淋洗小柱,最后用6mL含5%氨水的甲醇溶液洗脱,洗脱液氮气吹干,用1.0mL V(乙腈)∶V(水)=2∶8的溶液定容,过0.22μm膜,供高效液相色谱-串联质谱分析。
2 结果与讨论
2.1 样品前处理
2.1.1 提取溶液的选择 由于奥芬达唑、芬苯达唑和阿苯达唑均含有碱性疏水基团,所以它们相对易溶于极性有机溶液。由于甲醇和乙腈均有一定的蛋白沉淀效果,具有碱性基团的奥芬达唑、芬苯达唑和阿苯达唑在适当的酸性条件下有更好的溶解性。在空白脱脂奶粉和全脂奶粉中分别添加浓度为10μg/kg奥芬达唑、芬苯达唑和阿苯达唑的标准溶液,比较了4种提取溶液,即乙腈、甲醇、含1%乙酸的乙腈溶液和含1%乙酸的甲醇溶液的提取回收率,结果列于表2。
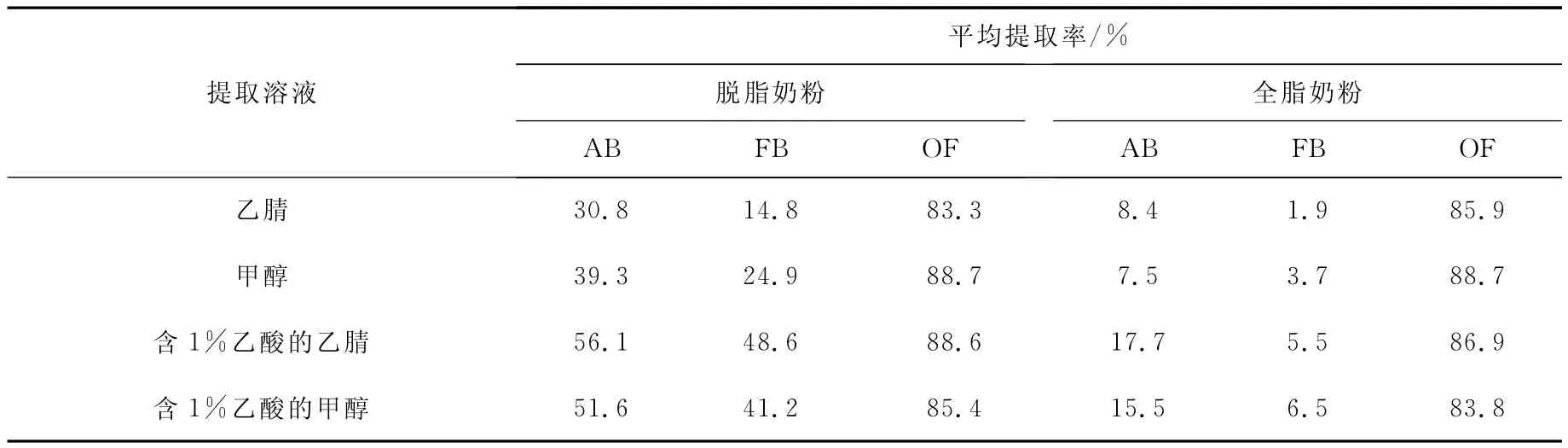
表2 不同提取溶液的回收率(n=6)Table 2 Recoveries of different extraction solutions(n=6)
以乙腈和甲醇作为提取溶液时,阿苯达唑和芬苯达唑的回收率均很低,而使用另外两种酸性提取溶液时,提取率有所提高,说明少量酸可以提高这3种苯并咪唑类药物的提取效率。含1%乙酸的乙腈溶液与含1%乙酸的甲醇溶液的提取效率相差不大,但含1%乙酸的乙腈提取溶液的重复性和重现性相对较差,因此最终选择含1%乙酸的甲醇为提取溶液。阿苯达唑和芬苯达唑在全脂和脱脂奶粉中的回收率较低,尤其在全脂奶粉基质中,可能存在基质抑制效应。
2.1.2 样品基质对阿苯达唑和芬苯达唑抑制效应的确定和去除 奶粉成分较为复杂,其中包括蛋白质、脂肪、糖类、矿物质和维生素等,脱脂奶粉与全脂奶粉相比,只是脂肪含量较低,其他成分差别不大。以空白全脂奶粉为样品,通过两步除基质干扰过程确定可能存在的基质抑制效应,即加入正己烷和阳离子交换柱(PCX)净化。向分离出的正己烷层和含1%乙酸的甲醇提取液中分别加入一定质量的3种混合标准溶液,浓缩近干后定容测定。在正己烷层中阿苯达唑和芬苯达唑中被测物被抑制了约49%和38%;而在含1%乙酸的甲醇提取液中,阿苯达唑和芬苯达唑的回收率约为68%和45%,表明存在基质抑制效应,而正己烷能够除去部分基质抑制物,且对待测物几乎没有影响。由于在3种苯并咪唑类药物结构中都含有伯胺基团,属弱碱性物质,PCX固相萃取柱具有阳离子交换和反相保留混合机理,通过PCX柱进一步净化后,阿苯达唑和芬苯达唑的回收率可提高到70%以上。
2.2 标准曲线的建立
配制浓度为2~100μg/L的6点混合标准溶液,进样5μL,绘制标准曲线。奥芬达唑,阿苯达唑和芬苯达唑的线性回归方程分别为:y=43 700x-25 200,y=136 000x-87 600,y=14 100x+344;线性方程系数(r)分别为:0.999 9,0.999 9和0.997 3。
2.3 检测限、回收率和精密度
在阴性脱脂奶粉和全脂奶粉基质中添加奥芬达唑、阿苯达唑和芬苯达唑的混合标准工作液,添加水平分别为10、50和100μg/kg,重复测定6次,计算回收率和精密度,结果列于表3,谱图示于图2和图3。在10μg/kg添加水平上,3种苯并咪唑类化合物的信噪比(S/N)大于10,该方法的检测限至少可达到10μg/kg。
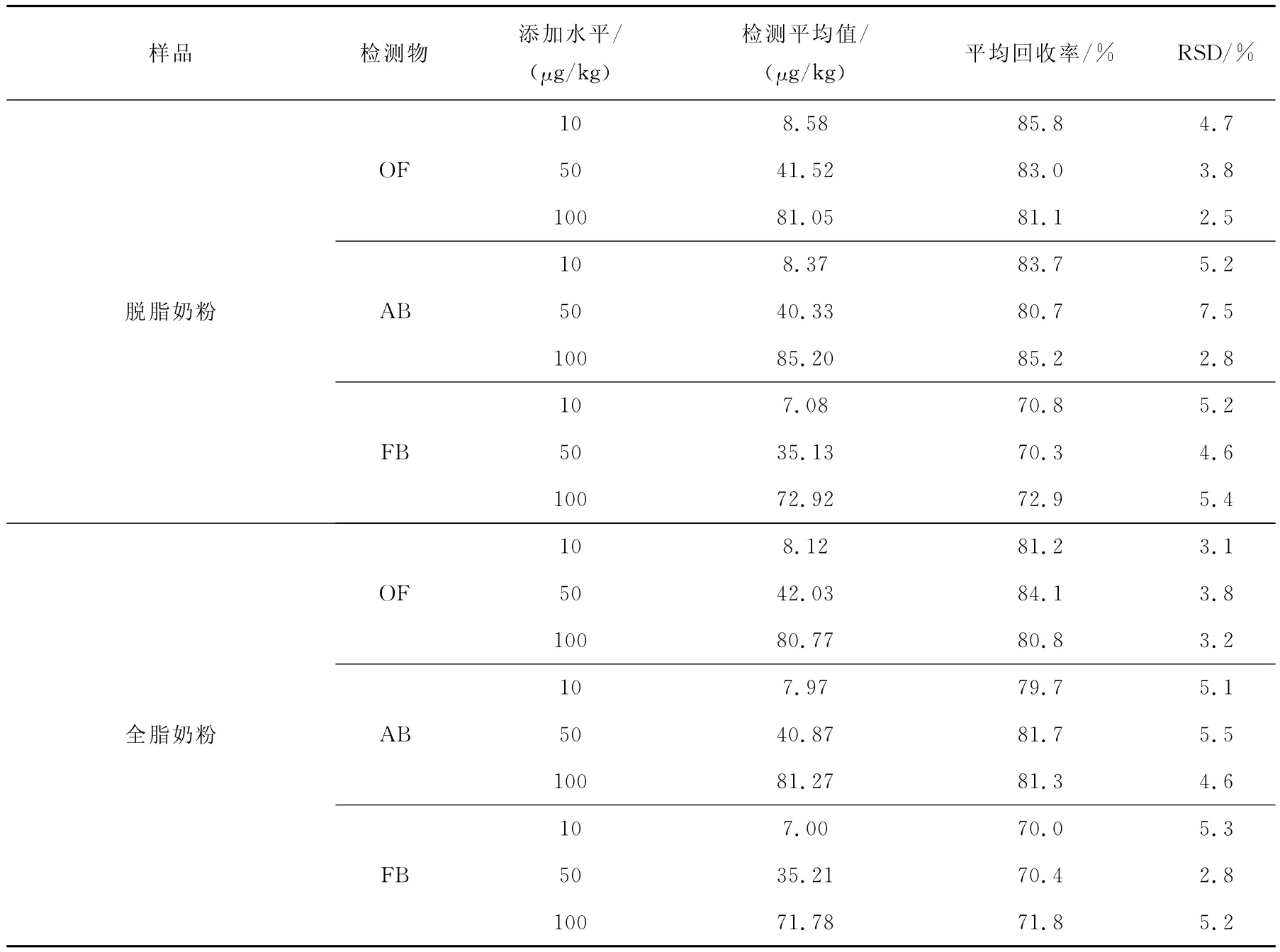
表3 脱脂奶粉和全脂奶粉的加标回收率(n=6)Table 3 Recoveries in skim milk powder and whole milk powder(n=6)
3 结论
本研究建立了采用高效液相色谱-串联质谱测定奶粉中3种驱虫剂(奥芬达唑、阿苯达唑和芬苯达唑)的检测方法。样品经含1%乙酸的甲醇提取,正己烷和阳离子交换柱两步净化,通过高效液相色谱-串联质谱法检测,该方法的回收率、精密度和检测限都能满足现有各国检测要求。
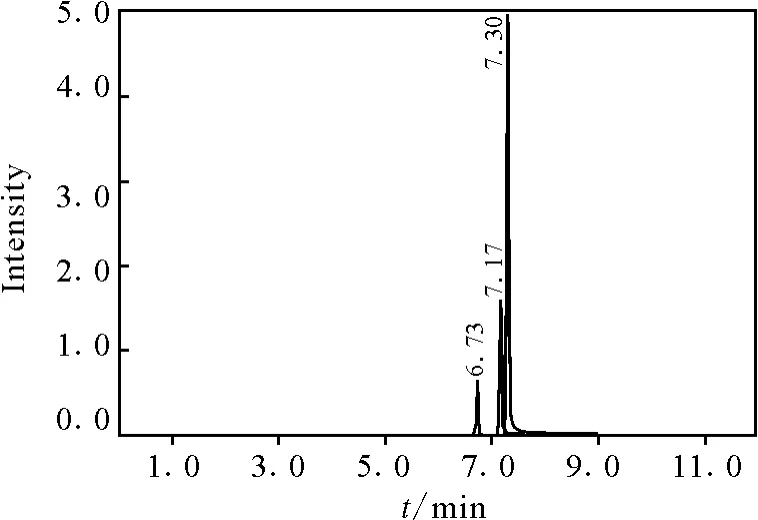
图2 10μg/L标准品的色谱图Fig.2 Chromatograms of 10μg/L standard Oxfendazole(tR=6.73min),Albendazole(tR=7.17min),Fenbendazole(tR=7.30min)

图3 脱脂奶粉(a)和全脂奶粉(b)加标色谱图Fig.3 Chromatograms of spiked in skim milk powder(a)and whole milk powder(b)
[1]岳振峰.食品中兽药残留检测指南[M].北京:中国标准出版社,2010:476-497.
[2]CHIAP P,EVRARD B,BINAZUBUT M,et al.Determination of albendazole and its main metabolites in ovine plasma by liquid chromatography with dialysis as an integrated sample preparation technique[J].J Chromatogr A,2000,870:121-134.
[3]GARCÁIA J,BOLÁS-FERNÁNDEZ F,TORRADO J.Quantitative determination of albendazole and its main metabolites in plasma[J].J Chromatogr B,1999,723:265-271.
[4]MOROVJÁN G,CSOKÁN P,MAKRANSZKI L,et al.Determination of fenbendazole,praziquantel and pyrantel pamoate in dog plasma by high-performance liquid chromatography[J].J Chromatogr A,1998,97:237-244.
[5]LANCHOTE L,MARQUES M,TAKAYANAGUI O,et al.Simultaneous determination of albendazole sulfoxide enantiomers and albendazole sulfone in plasma[J].J Chromatogr B,1998,709:273-279.
[6]刘 琪,朱馨乐,孙 雷,等.高效液相色谱-串联质谱法检测猪肝中苯并咪唑类药物及其代谢物的残留量[J].中国兽药杂志,2010,44(2):1-6.
[7]林永辉,李耀平,陈祥明,等.固相萃取法和凝胶渗透色谱法测定鳗鱼中苯并咪唑类药物残留[J].食品科学,2009,30(8):177-181.
[8]张英宣.高效液相色谱法测定牛肌肉中苯并咪唑类药物残留的研究[J].畜禽业,2006,198(5):6-7.
[9]GABOR.Determination of benzimidazole residues using liquid chromatography and tandem mass spectrometry[J].J Chromatogr B,1999,727:167-177.
[10]郭德华,邓晓军,赵善贞,等.固相萃取-高效液相色谱/串联质谱同时检测动物源性食品中76种兽药残留[J].分 析化学,2010,38(3):318-324.
[11]JI Y H,LIU X Y,JIANG X M,et al.Oxidized multiwalled carbon nanotubes as an SPME fiber coating for rapid LC-UV analysis of benzimidazole fungicides in water[J].Chromatographia,2009,70:753-759.
[12]陈毓芳,彭肖颜.反相高效液相色谱法同时测定动物组织中苯并咪唑类兽药残留量[J].光谱实验室,2001,18(5):674-678.
[13]MENEZES FILHO A,DOS SANTOS F N,DE PAULA PEREIRA P A.Development,validation and application of a methodology based on solid-phase micro extraction followed by gas chromatography coupled to mass spectrometry(SPME/GC-MS)for the determination of pesticide residues in mangoes[J].Talanta,2010,81:346-354.
[14]RAGNO G,RISOLI A,IOELE G,et al.Photoand thermal-stability studies on benzimidazole anthelmintics by HPLC and GC-MS[J].Chem Pharm Bull,2006,54(6):802-806.
