姜黄素单羰基类似物的体外稳定性研究
2012-01-26杨苹隋思博张敏梁广梁方李校堃
杨苹,隋思博,张敏,3,梁广,梁方,李校堃,3,*
(1.吉林农业大学,吉林长春130118;2.吉林省食品药品检验所,吉林长春130033;3.南京理工大学,江苏南京210094;4.温州医学院,浙江温州325035;5.大连理工大学,辽宁大连116024)
姜黄素是从中药姜黄Curcuma LongaL根茎中提取的一种黄色酸性酚类物质,是中药姜黄发挥药理作用的主要活性成分,具有抗炎、抗菌、抗氧化、抗肿瘤、保肝、降血脂等多种药理作用[1-3]。近年来关于姜黄素药理作用方面的报道较多,但其在临床应用方面的报道却很少,其原因是姜黄素溶液稳定性差,在碱性溶液中易降解[4]、溶解度低、半衰期短等药代缺陷,限制了姜黄素在临床上的推广应用;姜黄素的不稳定是因其结构中含有不稳定的β-二酮基团(见图1)。因此,我们以提高稳定性、改善药代缺陷为前提,以姜黄素为先导物,设计合成了一种去除β-二酮基团的姜黄素单羰基类似物(见图2)。本实验对合成的姜黄素单羰基类似物在不同条件下的降解速率常数进行了测定,并与相同条件下的姜黄素进行比较,对合成化合物的稳定性进行研究。

图1 姜黄素的化学结构图
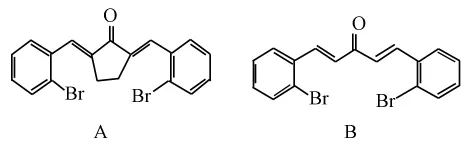
图2 姜黄素单羰基类似物A、B的化学结构图
1 仪器与试药
高效液相色谱仪(日本岛津公司,型号:LC-20);Hypersil ODS2 C18(日本岛津公司,5 μm,4.6 mm×200 mm);数控超声波清洗器(昆山市超声仪器有限公司,型号:KQ-250DB);电子天平(瑞士METTLER TOLEDO公司,型号:Seven Easy);漩涡混合仪(苏州江东精密仪器有限公司,型号:XW-80A);酸度计(瑞士METTLER TOLEDO公司,型号:AB265-S);色谱纯甲醇、色谱纯乙腈购自Fisher公司;1640培养基购自GIBICO公司;胎牛血清FBS购自Hyclone公司;人血浆取自医院健康自愿者采血;鼠血浆取自健康SD大鼠。姜黄素对照品为国药集团上海化学试剂公司产品、姜黄素单羰基类似物A 2,5-双(2-溴苯基)环戊酮、姜黄素单羰基类似物B 1,5-双(2-溴苯基)-1,4-戊二烯-3酮由温州医学院药学院梁广教授合成;其余试剂均为国产分析纯。
2 方法和结果
2.1 对照品溶液的制备精密称取姜黄素对照品适量,加入1%的羧甲基纤维素钠溶液(助溶),配制终质量浓度为50 mg/mL的混悬液,漩涡混合,使其充分溶解,4℃冰箱贮存备用。
2.2 供试品溶液的制备精密称取受测化合物A、B各适量,加入1%的羧甲基纤维素钠溶液(助溶),配制终质量浓度为50 mg/mL的混悬液,漩涡混合,使其充分溶解,4℃冰箱贮存备用。
2.3 缓冲溶液的配制参照文献中的方法[5]配制,以磷酸二氢钠-氢氧化钠(pH=6.0、7.0)、碳酸-氢氧化钠(pH=8.0、9.0、10)为缓冲体系,缓冲溶液的浓度为0.1 mmol/L,pH值分别为6.00、7.00、8.00、9.00、10.00的缓冲溶液,用酸度计进行校正。
2.4 色谱条件及色谱图流动相姜黄素:乙腈-水(体积比45∶55),含1%(体积分数)乙酸;姜黄素类似物:乙腈-水(体积比70∶30),含1%(体积分数)乙酸;检测波长:姜黄素最大吸收波长为420 nm、姜黄素类似物最大吸收波长为361 nm;体积流量:1.0 mL/min;柱温:30℃;进样量为20 μL;在上述色谱条件下,进行HPLC分析,色谱图见图3。
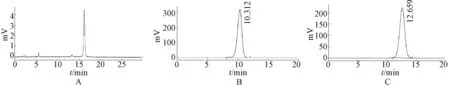
图3 姜黄素及其单羰基类似物的HPLC图
2.5 标准曲线精密称取姜黄素及受测化合物A、B适量,加入甲醇溶液溶解并定容,配制终质量浓度为10 mg/m L的甲醇溶液,混匀,备用。分别精密吸取不同体积的姜黄素及受测化合物A、B的甲醇溶液,加入甲醇稀释,使其终质量浓度分别为:100 μg/mL、50 μg/mL、25 μg/mL、5 μg/mL、0.5 μg/mL、0.25 μg/mL;过滤,取20 μL进样,测定其色谱峰面积,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,结果:姜黄素的回归方程为:Y=215.9X-22.7,r=0.999 4,在0.25~100 μg/mL范围内,其线性关系良好;化合物A的回归方程为:Y=130.2X+24.6,r=0.999 2,在0.25~100μg/m L范围内,其线性关系良好;化合物B的回归方程为:Y=166.3X-47.5,r=0.999 6,在0.25~100 μg/mL范围内,其线性关系良好。
2.6 光照实验将配制的姜黄素溶液及受测化合物溶液分别置于不同光照条件下(室外自然光照100 000lx、室内光照2 000lx、光照箱4 500lx),定时取样,处理样品(取100 μL溶液加入900 μL的甲醇溶液定容,过滤),20 μL进样,HPLC分析,分别测定其浓度,并计算出姜黄素及合成化合物A、B溶液在不同光照条件下的降解速率方程、降解速率常数k、半衰期t1/2;结果见表1,由表1可知:姜黄素及化合物溶液在室内光照条件下最为稳定,在光照箱中稳定性也较好,降解较慢,但姜黄素、化合物B在室外光照的条件下,其降解速率显著加快,而相同条件下的化合物A在室外光照条件下的稳定性较优于化合物B及先导物姜黄素。

表1 光照对姜黄素及合成化合物稳定性的影响(n=3)
2.7 高温试验将配制的姜黄素溶液及受测化合物溶液分别放入40℃、60℃的恒温水浴锅中保温,定时取样,处理样品(样品处理方法同2.4项所述),20 μL进样,HPLC分析,分别测定其浓度,并计算出姜黄素及合成化合物A、B溶液在不同温度下的降解速率方程、降解速率常数k、半衰期t1/2;结果见表2,由表2可知:姜黄素及合成化合物在温度为40℃的环境中最为稳定,在温度为60℃的环境中降解较快,半衰期最短;说明在高温条件下对姜黄素及合成化合物的稳定性存在一定的影响。
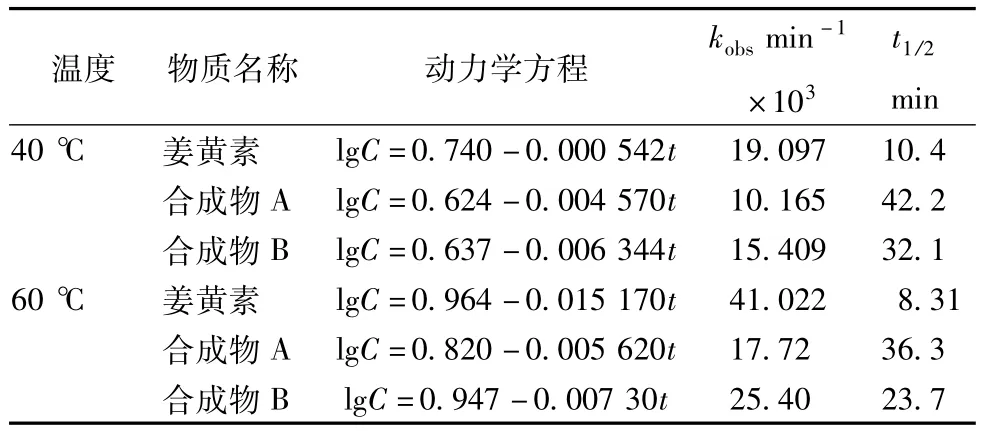
表2 温度对姜黄素及合成化合物稳定性的影响(n=3)
2.8 缓冲溶液pH对姜黄素及化合物A、B稳定性的影响
分别精密吸取配制好的姜黄素对照品及化合物A、B 5 mmol/L的甲醇溶液20 μL,加入到980 μL的不同pH的缓冲溶液中,37℃避光放置;定时取样,处理样品(样品处理方法同2.4项所述),20 μL进样,HPLC分析,分别测定其浓度,计算姜黄素及化合物A、B溶液在37℃不同pH条件下的降解速率方程、降解速率常数k、半衰期t1/2。结果表明:姜黄素及化合物呈pH依赖性,随着缓冲溶液pH的升高,其降解速率加快;半衰期明显缩短,其中化合物A的稳定性较强,化合物B的稳定性较弱,合成化合物A、B在碱性溶液中的稳定性高于相同条件下的对照品姜黄素。分析结果见表3。
2.9 不同生物介质对姜黄素及化合物A、B稳定性的影响
分别精密吸取配制好的姜黄素对照品及化合物A、B 5 mmol/L的甲醇溶液20 μL,加入980 μL的不同生物介质中(0.1 mol/L pH7.0磷酸盐溶液、1640细胞培养基、1640培养基+10%胎牛血清、鼠血浆、人血浆),37℃避光放置;定时取样,处理样品(前3个生物介质的处理方法同2.4项所述;鼠血浆及人血浆的处理方法如下:取0.1mL混合液加入0.5 mL乙酸乙酯-三氯甲烷(9∶1V/V)处理液中,漩涡混匀,分离上层有机相,重复萃取一次,合并有机相,真空干燥,残渣加入100 μL的甲醇溶解,过滤),取20 μL进样,HPLC分析,分别测定其浓度,以时间为横坐标,浓度为纵坐标作图(以0 h的峰面积为100%计算);分析结果见图4,结果表明:姜黄素及合成物A、B溶液在0.1 mol/L pH7.0磷酸盐溶液、无血清的1640细胞培养基中降解较快,在含10%胎牛血清的1640细胞培养基、鼠血浆、人血浆中降解较慢;在相同条件下受测化合物的降解率均低于先导物姜黄素。
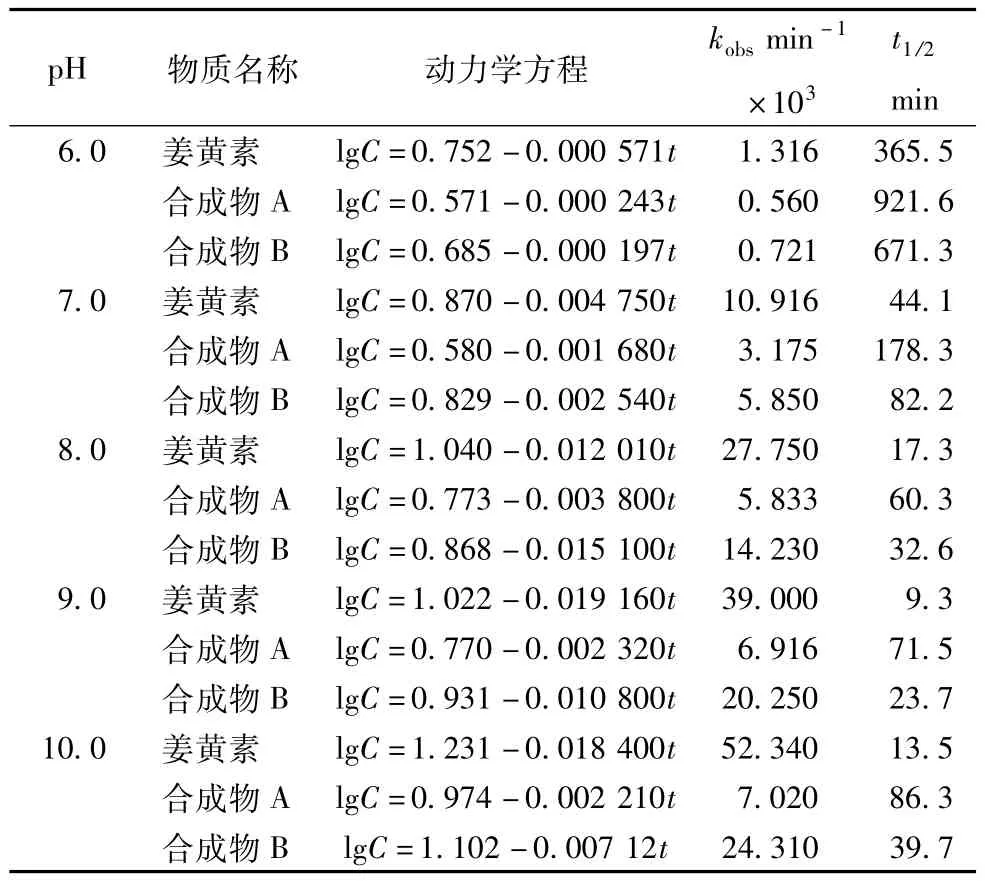
表3 pH值对姜黄素及合成化合物稳定性的影响(n=3)
3 讨论
已有多篇文献报道[6-8]姜黄素溶液稳定性差,在临床前、临床研究中表现出来的最大不足也是其药代学上的缺点,如半衰期短、血药浓度低、代谢过快、生物利用度低等;本实验研究了光照、温度、pH值及不同生物介质对姜黄素及合成化合物稳定性的影响,实验证实了姜黄素及化合物在室内光照度为2 000lx,温度为40℃条件下最为稳定。
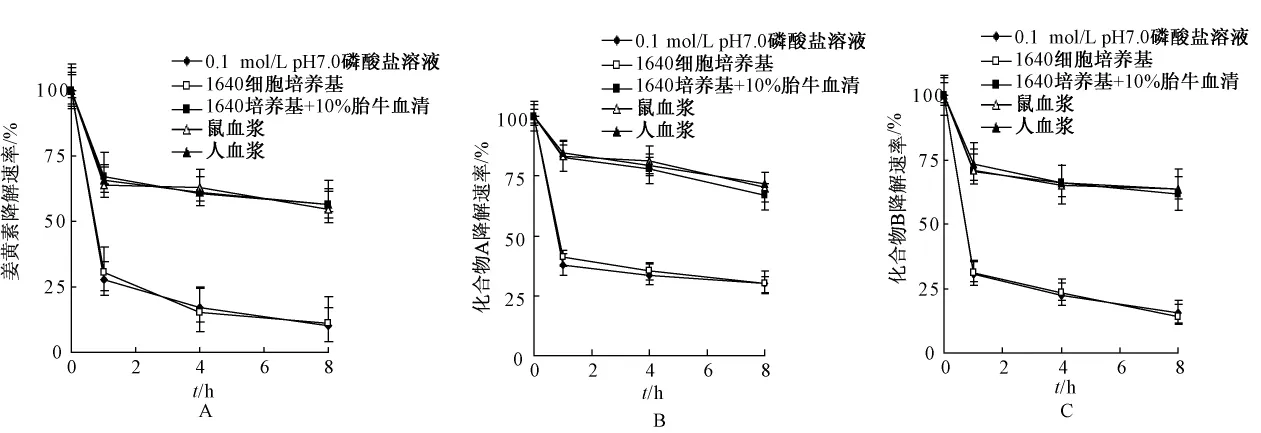
图4 姜黄素及合成化合物在不同生物介质中的降解曲线(n=3)
同时,实验还证实了姜黄素单羰基类似物在溶液中呈pH依赖性,在酸性溶液及中性溶液中较为稳定,但其在碱性溶液中极不稳定,随着pH值的升高,其降解速率明显加快,半衰期缩短;同时,不同的生物介质对其的影响也是不同的,姜黄素在0.1 mol/L pH7.0磷酸盐溶液、无血清的1640细胞培养基中降解较快,在含10%胎牛血清的1640细胞培养基、鼠血浆、人血浆中降解较慢,说明其在体外与血浆的结合率较低,在人体内吸收较少,而合成化合物的降解均优于先导物姜黄素,其中化合物A在鼠血浆、人血浆的降解最低,在实验1 h内,降解约为80%,说明其与血浆的结合率较高(还未得到进一步的证实);可能是由于化合物B与姜黄素在结构上的类似,而使其具有与姜黄素相近的稳定性,而化合物A可能是由于其中间连接链戊环产生位阻而使其稳定性增加,具体的机制还有待进一步研究。
本实验中对合成的姜黄素单羰基类似物A、B进行了初步的体外稳定性实验,在其药理活性方面作用广泛,如抗氧化、抗炎、抗菌等[9-15],但合成化合物的药理作用及其在动物体内代谢实验、安全性评价实验还未得到验证,其应用于临床还有很长一段路要走,希望不久的将来,姜黄素单羰基类似物可以应用于临床,用于疾病的治疗,为人类造福!
[1]崔晶,翟光喜,娄红祥.姜黄素的研究进展[J].中南药学杂志,2005,3(2):108-111.
[2]曲建全,范春雷.姜黄素现代药理研究进展[J].现代生物医学进展,2008,8(11):2149-2151.
[3]韩刚,王晓雁,王雁楠,等.中药姜黄不同提取部位对姜黄素稳定作用的研究[J].中国中药杂志,2007,32(9):21-23.
[4]韩刚,霍文,李秋影,等.姜黄素的稳定性研究[J],中成药,2007,29(2):291-293.
[5]Wang Y J,Pan M H,Cheng A L,et al.Stability of curcumin in buffer solutions and characterization of its degradation products[J].J Pharm Biomedi Anal,1997,15(12):1867-1876.
[6]谭俊,蔡卓凡,王诗明.姜黄素制剂稳定性实验研究[J].中药材,2002,25(8):585-586.
[7]Mahattanadul S,Reanmongkol W,Yano S,et al.Preventive and curative effects of curcumin on the development of gastric inflammatory diseases in rats[J].J Nat Med,2006,60(3):191-197.
[8]Hsu C H,Cheng A L.Clinical studies with curcumin[J].Adv Exp Med Biol,2007,595:471-480.
[9]周刚,王继峰,牛建昭,等.姜黄素抗肺纤维化大鼠细胞外基质过度形成的实验研究[J].中国中药杂志,2006,31(7):570-573.
[10]Mrudula T,Suryanarayanna P,Srinivas P N,et al.Effect of curcumin on hyperglycemia induced vascular endothelial growth factor expression in streptozotocin-induced diabetic rat retina[J].Biochem Biophys Res Commum,2007,361(2):528-532.
[11]王岩,张博,李建华.姜黄素对肾脏保护作用机制的研究进展[J].中国现代医生,2009,47(35):23-26.
[12]郑加荔,言君凯,蔡美琴.姜黄素抗肿瘤作用的研究进展[J].中华临床营养杂志,2009,17(4):23-26.
[13]Williams B L,Hornig M,Yaddanapudi K,et al.Hippocampal poly(ADP-Ribose)polymerase 1 and caspase 3 activation in neonatal bornavirus infection[J].J Virol,2008,82:1748-1758.
[14]蔡九妹,廖伟.姜黄素在心血管疾病中应用的研究进展[J].陕西医学杂志,2009,38(12):1677-1679.
[15]刘全未,黄维义.姜黄素抗动脉粥样硬化作用研究进展[J].心血管病学进展,2009,30(1):176-179.
