鱼腥草素钠对铜绿假单胞菌生物被膜的清除作用
2012-01-26程惠娟汪长中胡跃龙卢文波高磊李露天
程惠娟,汪长中,胡跃龙,卢文波,高磊,李露天
(安徽中医学院,安徽合肥230038)
铜绿假单胞菌Pseudomonas aeruginosa是呼吸道重要的生物被膜菌,生物被膜菌最显著的特征是高度的耐药性。因此,常引起难治性呼吸道生物被膜病。寻找抗细菌生物膜的药物,防治细菌生物膜病已成为全球关注的重大难题,是目前研究的前沿和热点。中药有效成分鱼腥草素钠在临床治疗慢性支气管炎及其他上呼吸道感染性疾病中有较好疗效,其机理未明。本课题研究鱼腥草素钠对铜绿假单胞菌早期生物被膜及成熟期生物被膜的清除作用,以进一步阐明鱼腥草素钠的疗效机制,为临床治疗提供依据。
1 材料
1.1 菌株和药物标准菌株ATCC27853(中国药品生物制品检定所),鱼腥草素钠标准品(中国药品生物制品检定所批号100247-199601)。
1.2 主要试剂和仪器LB培养基、胰酶大豆肉汤培养基(TSB,杭州微生物试剂有限公司);四甲基偶氮唑盐(MTT,Sigma公司);二甲基亚砜(DMSO,天津市光复精细化工研究所,分析纯);自配pH7.4的PBS溶液。318酶标仪(上海三科仪器有限公司);96孔微量培养板(杭州生友生物技术有限公司);DPH—9162型电热恒温培养箱(上海一恒科技有限公司);CX21型光学显微镜(日本Olympus公司);Sirion200型场扫描电镜(美国FEI公司)。
2 方法
2.1 铜绿假单胞菌生物被膜形成的观察挑选过夜培养的菌落4个接种于LB肉汤培养基中37℃孵育6 h,培养液经离心、无菌生理盐水洗涤后,比浊到0.5麦氏浊度标准(1.5×108cfu/mL),再经TSB液体培养基稀释200倍加入到96孔平底微量培养板每孔200 μL,37℃孵育。根据Sauer K等[1]报道,设3 d、7 d两个时间点,作为早期生物被膜阶段、成熟期生物被膜阶段的观察,每个时间点4个复孔,并设不含菌培养基作为空白对照,每隔24 h弃培养基,用PBS清洗浮游菌,重新加入新鲜培养基。各时间点取出培养板,MTT法,即50 μL的MTT溶液(贮存液含5 mg/mL PBS,临用前用预温的0.15 mol/L PBS按1∶5稀释)加入每孔中,37℃孵育5 h。弃去含MTT的培养基,PBS洗3遍,加入DMSO 100 μL,振荡5 min,在酶标仪492 nm波长下检测吸光度。
2.2 鱼腥草素钠对铜绿假单胞菌生物被膜的清除作用菌液制备同生物被膜形成的观察。将菌液加入到96孔平底微量培养板1~11列各孔中,每孔100 μL,37℃孵育3 d、7 d作为早期生物被膜和成熟期生物被膜的清除作用观察。到观察时间点后弃去培养液,用PBS多次清洗未吸附菌。鱼腥草素钠经吐温80和甘油溶解后,用TSB液体培养基对倍稀释10个最终质量浓度500、250、125、62.5、31.25、15.6、7.8、3.9、1.95、0.98 mg/L,各质量浓度分别加入1~10列孔中,每孔100 μL,每个质量浓度设4个复孔,11、12列各孔中加入不含药培养基,分别作为阴性和培养基对照。给药1 d后,MTT法,在酶标仪492 nm波长下检测吸光度,吸光度在阴性对照孔50%为SMEC50。
2.3 鱼腥草素钠对受试菌生物被膜的形态结构影响盖玻片经高压灭菌后置入无菌6孔平底培养板中每孔1片,加入2 mL TSB培养基,将200 μL的1×104cfu/mL铜绿假单胞菌的菌体混悬液加入六孔板中,37℃孵育3 d、7 d作为早期生物被膜和成熟期生物被膜的清除作用的形态观察,同时设不加药物的阴性对照组,在两个时间点取出盖玻片用15 mL PBS 3次充分清洗后重新置入6孔平底培养板中,实验组加入2 mL含药物质量浓度为250 mg/L TSB液体培养基,阴性对照组加不含药培养基,37℃继续孵育24 h后取出盖玻片,PBS清洗后镀银染色,扫描电镜下观察形态结构变化。
2.4 数据处理采用SPSS11.0 for Windows软件处理,用两独立样本方差分析对相关数据进行统计,以均数(x±s)表示。
3 结果
3.1 铜绿假单胞菌生物被膜形成的过程见图1。
从图1观察到细菌培养3 d形成早期生物被膜,在这过程中生物被膜产量最高,从早期到成熟生物被膜过程中生物被膜仅有少量增多。
3.2 鱼腥草素钠对铜绿假单胞菌生物被膜的清除作用见图2、图3。图2、图3显示鱼腥草素钠同样药物质量浓度对早期生物被膜的作用强于成熟生物被膜,清除作用随药物质量浓度增加而加强。SMEC50早期生物被膜为15.6 mg/L、成熟期生物被膜为250 mg/L,与对照组相比差异显著,P=0.01和P=0.000,早期生物被膜发展到成熟生物被膜过程中SMEC50都为250 mg/L。见图4。
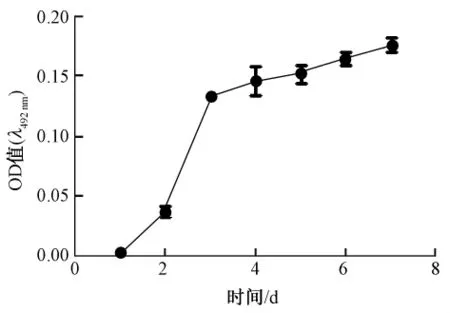
图1 铜绿假单胞菌生物被膜形成的动态过程(n=4,±s)Fig.1 Dynam ic process of Psedomonas aeruginosa biofilm formation(n=4,±s)
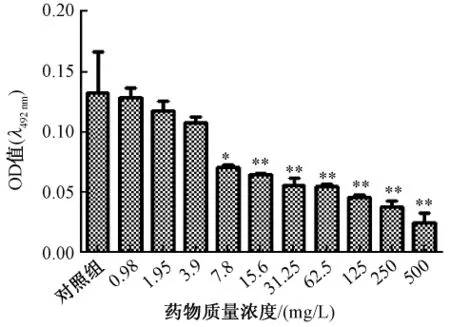
图2 各质量浓度鱼腥草素钠对铜绿假单胞菌早期生物被膜作用的比较(n=4,±s)Fig.2 Com parison of different houttuyfonate sodium concentrations on eradicating initial Psedomonas aeruginosa biofilm s(n=4,±s)
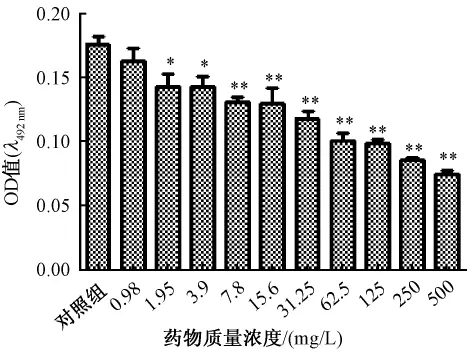
图3 各质量浓度鱼腥草素钠对铜绿假单胞菌成熟期生物被膜作用的比较(n=4,±s)Fig.3 Com parison of different houttuyfonate sodium concentrations on eradicating mature Psedomonas aeruginosa biofilms(n=4,±s)
3.3 鱼腥草素钠对受试菌生物被膜的形态结构影响见图5。
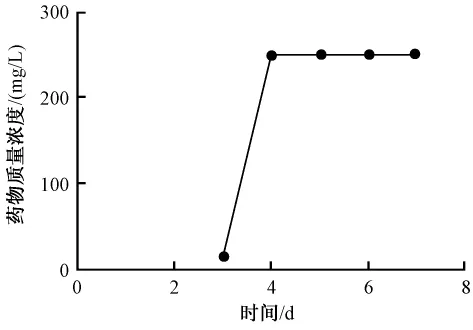
图4 鱼腥草素钠对铜绿假单胞菌生物被膜形成各阶段SMEC50Fig.4 MEC50 of houttuyfonate sodium for Psedomonas aeruginosa biofilms formed at different phases

图5 扫描电镜下观察鱼腥草素清除铜绿假单胞菌生物被膜的作用(×10 000)Fig.5 Effects of houttuyfonate sodium d on eradicating Psedomonas aeruginosa biofilms observed by SEM(×10 000)
扫描电镜下观察到铜绿假单胞菌早期的生物被膜,由密集的胞外基质形成黏液层,大部分细菌已被包裹在有胞外基质形成的黏液层下,少量细菌镶嵌在黏液层之间,成熟期的生物被膜黏液层明显增厚如蘑菇状形态,其内部有相互交织的孔道,细菌被胞外基质完全覆盖。而由250 mg/L药物质量浓度作用过的载体,早期生物被膜形成阶段和成熟生物被膜阶段,均未观察到明显的生物被膜结构,仅见载体上存在散在的黏液,分布着少量的细菌,早期生物被膜阶段的细菌菌体光滑,成熟期生物被膜阶段的细菌,菌体表面较粗糙,药物作用过的载体上细菌形态发生变异,由杆状变成球杆状。
4 讨论
鱼腥草素钠是天然植物三白草蕺菜属植物鱼腥草的主要有效成分和亚硫酸氢钠加成物,具有消肿,抗化脓感染的功效。以往的研究只表明该药仅具微弱的抗菌作用,据临床报道治疗呼吸道肺系疾病有很好的疗效[2-5]。本研究发现,鱼腥草素钠对铜绿假单胞菌生物被膜有清除作用。铜绿假单胞菌是最典型的生物被膜菌,实验中观察到铜绿假单胞菌在建立早期生物被膜过程中生物被膜产量显著增多,从早期生物被膜发育到成熟生物被膜过程中膜产量增加不显著。从理论上分析细菌在生物被膜形成前生长代谢活跃,当被生物膜包裹后就进入休眠期,因此产膜也不活跃,实验结果和理论分析一致。扫描电镜下生物被膜形态观察可印证此过程,早期生物被膜由胞外基质形成膜状结构,成熟期的生物被膜表现为膜的增厚,该结果与Sauer K等[1]报道相符。鱼腥草素钠对铜绿假单胞菌生物被膜的清除实验中,分别在形成早期生物被膜和成熟期生物被膜后药物作用24 h测定生物被膜的清除作用,SMEC50早期生物被膜15 mg/L、成熟生物被膜250 mg/L,鱼腥草素钠的铜绿假单胞菌的早期生物被膜清除作用明显强于对成熟期的生物被膜的清除作用,从图1和图5观察分析与铜绿假单胞菌生物被膜的产量有关,随着生物被膜产量的增多,SMEC50也随之增大。这提示临床治疗相关感染应该早期用药,早期用药可能有预防和消除生物被膜病的疗效。
自然界大部分细菌以生物被膜状态存在,生物被膜是由细菌通过产生多糖、蛋白质、脂类、DNA组成胞外基质形成,细菌将自己包裹在膜内[6]。生物被膜很难清除[7-8],人类80%的感染由生物被膜引起[9]。生物被膜基质阻隔了免疫细胞和抗体的作用[10-11]。膜内细菌因得不到充分的营养,代谢降低导致对大多数抗生素的不敏感[12],吸附在生物被膜表面的细菌相对于其浮游状态对抗生素的耐受性更强[12]。目前常规应用的抗生素只能杀灭浮游菌,膜内菌得到生物被膜的屏障保护而长期存活,释放时又会引起新的感染,从而使感染反复发作。因此,以生物被膜为靶向的治疗是解决生物被膜菌引起的慢性感染重要的策略。本实验结果显示,鱼腥草素钠的临床疗效与其抗生物被膜的作用有关,生物被膜的屏障作用被消除后可增强细菌对药物的敏感性以及免疫因素对细菌的清除。已有报道14元环或15元环大环内酯类抗生素有一定的抗生物被膜作用[13],但是长期应用抗生素会引起新的临床问题。鱼腥草是药食两用的天然植物,具有长期服用对人体无毒副作用,不形成耐药两大优势。本实验显示鱼腥草素钠的抗生物被膜作用,表明其在抗感染治疗中有良好的前景。
[1]Sauer K,Camper A K,Ehrlich G D,et al.Pseudomon asaeruginosadisplaysmultiple phenotypes during development as a biofilm[J].Bicteral,2002,184(4):1140-1154.
[2]李京鹤,李志成,陈雯.鱼腥草注射液治疗急性上呼吸道感染196例疗效观察[J].时珍国医国药,2006,17(3):404.
[3]苏慧岚.加味华盖散合鱼腥草注射液治疗慢性支气管炎急性发作36例[J].现代中西医结合杂志,2003,12(3):251.
[4]胡静,何燕.新鱼腥草素钠注射液佐治毛细支气管炎疗效观察[J].现代中西医结合杂志,2006,15(5):578-154.
[5]李冰昱,万启南.鱼腥草注射液治疗老年人肺炎的临床观察[J].国际中医中药杂志,2006,28(3):151.
[6]Flemming H C,Wingender J.The biofilm matrix[J].Nat Rev Microbiol,2010,8(9):623-633.
[7]Walker J T,Bradshaw D J,Bennett A M,et al.Microbial biofilm formation and contamination of dental-unit water systems in general dental practice[J].Appl Environ Microbiol,2000,66(8):3363-3370.
[8]Kaplan J B.Biofilm dispersal:mechanisms,clinical implications,and potential therapeutic uses[J].Dent Res,2010,89(3):205-223.
[9]Ma Q,Zhang G,Wood T K.Escherichia coli BdcA controls biofilm dispersal inPseudomonas aeruginosaandRhizobium meliloti[J].BMC Res Notes,2011,26(4):447-457.
[10]Bjarnsholt T,Jensen P,Burmølle M,et al.Pseudomonas aeruginosatolerance to tobramycin,hydrogen peroxide and polymorphonuclear leukocytes is quorum-sensing dependent[J].Microbiology,2005,151(Pt 2):373-383.
[11]Hentzer M,Teitzel G M,Balzer G J,et al.Alginate over production affectsPseudomonas aeruginosabiofilm structure and function[J].Bacteriol,2001,183(18):5395-5401.
[12]Mah TF,Pitts B,Pellock B,et al.A genetic basis forPseudomonas aeruginosabiofilm antibiotic resistance[J].Nature,2003,426(6964):306-310.
[13]Pérez-Martínez I,Haas D.Azithromycin inhibits expression of the GacA-dependent small RNAs RsmY and RsmZ inPseudomonas aeruginosa[J].Antimicrob Agents Chemother,2011,55(7):3399-3405.
