响应面法优化蚬壳花椒果皮多糖提取工艺
2012-01-25杨林邵文斌于爱红束长宇朱家君东建丽兰州理工大学生命科学与工程学院甘肃兰州730050
杨林,邵文斌,于爱红,束长宇,朱家君,东建丽(兰州理工大学生命科学与工程学院,甘肃兰州730050)
蚬壳花椒Zanthoxylum dissitumHemsl.,又名单面针、山枇杷、大叶花椒、麻疯刺、九牛藤、公麒麟、蚌壳花椒等[1],属芸香科花椒属攀援藤本植物[2],在我国主要分布于甘肃、陕西、四川、贵州、广西、广东、湖南及湖北等省区[4]。根、茎及叶均可入药,有祛风活络、散瘀止痛、解毒消肿之功效,民间用于治疗腰腿、关节疼痛、跌打损伤等症[4]。传统中药主要以水煎剂入药,蚬壳花椒中水溶性多糖可能是药物有效成分之一,而多糖类化合物是一种免疫调节剂,它能激活免疫受体,提高机体的免疫功能,在用于癌症的辅助治疗中,具有毒副作用小、安全性高、抑瘤效果好等优点[5]。
近年来,对蚬壳花椒的研究报道较少,王丽萍等[6]、马英姿等[7-12]、王平等[13-14]及王海霞等[15]对蚬壳花椒组织培养及生物学特性进行了一系列研究,并发现蚬壳花椒资源日趋贫乏[7]。汤俊等[16]、韦瑀龙等[17]从蚬壳花椒干燥茎中分别得到8个化合物和6个生物碱类化合物,马英姿等[18]从蚬壳花椒中性亲脂性成分中分离得到6个化合物并具有多种生物活性,未见蚬壳花椒果皮多糖的相关报道。本实验应用响应面分析法对蚬壳花椒果皮总多糖提取工艺进行优化,为蚬壳花椒果皮多糖的开发利用提供数据参考。
1 材料与方法
1.1 材料与仪器
1.1.1 药材蚬壳花椒(采自甘肃省文县碧峰沟,晾干,粉碎)。
1.1.2 试剂葡萄糖(分析纯,天津市百世化工有限公司),苯酚(分析纯,天津市凯通化学试剂有限公司),浓硫酸(分析纯,白银良友化学试剂有限公司),石油醚(分析纯,天津市凯通化学试剂有限公司),乙醇(分析纯,天津市百世化工有限公司)。
1.1.3 仪器AB-105N电子天平(Mettler Toledo Group),紫外分光光度计(Varian Australia RTY LTD);SHB-ⅢA循环水式多用真空泵(郑州长城科工贸有限公司);DZF-6020型真空干燥箱(上海博迅实业有限公司医疗设备厂)。
1.2 实验方法
1.2.1 水提醇沉法提取蚬壳花椒总多糖工艺流程原料粉碎→石油醚回流提取(100 mL/g)→过滤→滤渣→95%乙醇回流提取(100 mL/g)→过滤→烘干滤渣→热水浸提→离心→上清液→浓缩→sevage法除蛋白→80%乙醇醇析→离心→干燥沉淀→粗多糖。
1.2.2 蚬壳花椒果皮多糖提取率的测定
1.2.2.1 标准溶液的制备精密称取105℃下干燥至恒质量的葡萄糖对照品0.100 0 g,加蒸馏水溶解,定容于250 mL量瓶中,配成0.4 mg/mL的葡萄糖标准溶液。精密吸取标准溶液1、2、3、4、5 mL分别置于10 mL量瓶中,以蒸馏水定容,得系列对照品溶液。
1.2.2.2 标准曲线的制备精密吸取上述系列对照品溶液1.0 mL,分别置于10 mL比色管中,将比色管置于冰水中,分别向比色管加入1 mL苯酚试剂,再加入浓硫酸4 mL,待各管加完后同时摇匀,沸水加热10 min,冷却,定容至刻度,于490 nm测定吸光度值。另精密吸取蒸馏水1.0 mL,同法操作,作为空白对照。以吸光度为纵坐标,质量浓度为横坐标绘制标准曲线,得回归方程:y=2.767 6x+0.006 9(r=0.999 4),线性范围为0~0.2 mg/mL。
1.2.3 多糖提取率的测定精密称取脱脂并干燥的蚬壳花椒果皮粉末2.000 0 g热水浸提,过滤,滤液定容至500 mL量瓶中,得供试品溶液。用苯酚-硫酸法测定多糖含有量,精密吸取1 mL供试品溶液于10 mL比色管中,按标准曲线的制备步骤操作,测得的吸光度值代入标准曲线方程计算其浓度,并得出多糖提取率。
1.2.4 单因素试验
1.2.4.1 提取温度对多糖提取率的影响精密称取脱脂干燥蚬壳花椒果皮2.000 0 g,分别在温度为60、70、80、90、100℃,液料比为60∶1(mL/g)的条件下提取120 min,提取两次,过滤,滤液冷却后,每组实验重复3次,下同,按多糖提取率的测定方法计算总多糖提取率。
1.2.4.2 液料比对多糖提取率的影响精密称取脱脂干燥蚬壳花椒果皮2.000 0 g,根据提取温度筛选结果,以最佳提取温度,液料比分别为20∶1、40∶1、60∶1、80∶1、100∶1的条件下提取120 min,提取两次,过滤,滤液冷却后,按多糖提取率的测定方法计算总多糖提取率。
1.2.4.3 提取时间对多糖提取率的影响精密称取脱脂干燥蚬壳花椒果皮2.000 0 g,根据提取温度及液料比筛选结果,分别以最佳提取温度及液料比条件下提取60、90、120、150、180 min,提取两次,过滤,滤液冷却后,按多糖提取率的测定方法计算总多糖提取率。
1.2.4.4 提取次数对多糖提取率的影响精确称取脱脂干燥蚬壳花椒果皮2.000 0 g,根据提取温度、液料比及提取时间筛选结果,以最佳提取温度、液料比及提取时间条件下分别提取1、2、3、4次,过滤,滤液冷却后,按多糖提取率的测定方法计算总多糖提取率。
1.2.5 响应面分析法对提取工艺的优化综合单因素试验结果,根据Box-benhken的中心组合设计原理[19-20],采用响应面法对蚬壳花椒果皮多糖的提取工艺进行优化。
2 结果与讨论
2.1 单因素试验
2.1.1 提取温度对多糖提取率的影响试验数据表明,多糖提取率随着提取温度的升高而增加,至温度在90℃时提取率最高,之后提取率随着温度的升高而下降,因此选择最佳提取温度为90℃,见图1。
2.1.2 液料比对多糖提取率的影响试验数据表明,多糖提取率随着液料比的增大而增加,但在液料比80∶1之后提取率有下降趋势,因此,选择液料比为80∶1,见图2。
2.1.3 提取时间对多糖提取率的影响试验数据表明,多糖提取率随着提取时间的增长有所增加,在150 min之后趋于平缓。考虑到时间越长,能耗越大,因此,选择最佳提取时间为150 min,见图3。
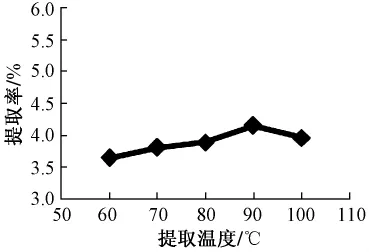
图1 提取温度对提取率的影响

图2 液料比对提取率的影响
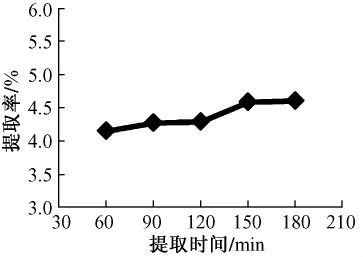
图3 提取时间对提取率的影响
2.1.4 提取次数对提取率的影响试验数据表明,提取次数对提取率的影响比较小,提取两次后,提取率趋于平缓,考虑到提取次数越多,能耗也越大,因此,选择最佳提取次数为2次,见图4。
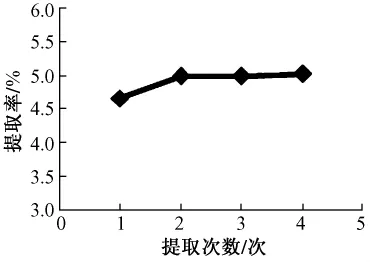
图4 提取次数对提取率的影响
由以上试验结果表明,蚬壳花椒果皮多糖各单因素最佳提取条件为:提取温度为90℃,液料比为80∶1,提取时间为150 min,提取2次。
2.2 采用响应面分析法对蚬壳花椒多糖提取工艺的优化在单因素试验结果基础上,选择对提取率影响较为显著的提取温度(X1)、液料比(X2)、提取时间(X3)3个因素做响应面分析,以X1=(Z1-90)/5、X2=(Z2-80)/10、X3=(Z3-150)/15为自变量,以多糖提取率(Y)为响应值,进行响应面分析试验,试验因素与水平设计见表1,具体试验方案及试验结果见表2。

表1 响应面分析因素与水平

表2 BOX-Benhnken试验设计及结果
表2中实验序号1~12为析因试验,实验序号13~17为中心试验。17个试验点分为析因点和零点,其中析因点为自变量取值在X1、X2、X3所构成的三维顶点,零点为区域的中心点,零点试验重复5次,用以估计试验误差。采用Design-Expert软件对所得数据进行多元回归拟合,得到回归方程:Y=5.00+0.090X1+0.057X2-0.021X3+0.011X1X2-0.032X1X3-0.056X2X3-0.33X21-0.23X22-0.12X23。
回归方程中X1、X2、X21、X22和X23对蚬壳花椒果皮多糖提取率影响极显著,X2X3对提取率影响高度显著,其他不显著,表明各实验因素对响应面值的影响不是简单的线性关系。失拟项反映的是实验数据与模型不相符情况,F检验结果为不显著,因此模型选择正确。模型的F检验结果为极显著,复相关系数R2=0.993 3,表明该回归方程模型拟合程度非常好。CV=0.64%,数据较低,表明实验操作可信,以上回归分析表明可以用此模型来分析和预测蚬壳花椒果皮多糖最佳提取工艺条件。见表3,表4。
根据回归方程作响应面图,如图5~7。在描述任意两因素间的关系时,当固定其中一个因素不变,试验初期随另一因素的增大多糖提取率提高,但达到一定程度后多糖提取率反而降低,响应面试验规律与单因素试验基本一致。图5~7所示,温度和液料比对多糖提取率的影响均显著,变化幅度较大,提取时间的曲线较平缓,表明其对多糖提取率的影响较小。从等高线图可以看出,三个因素两两交互作用对多糖提取率影响大小,与方差分析结果一致。
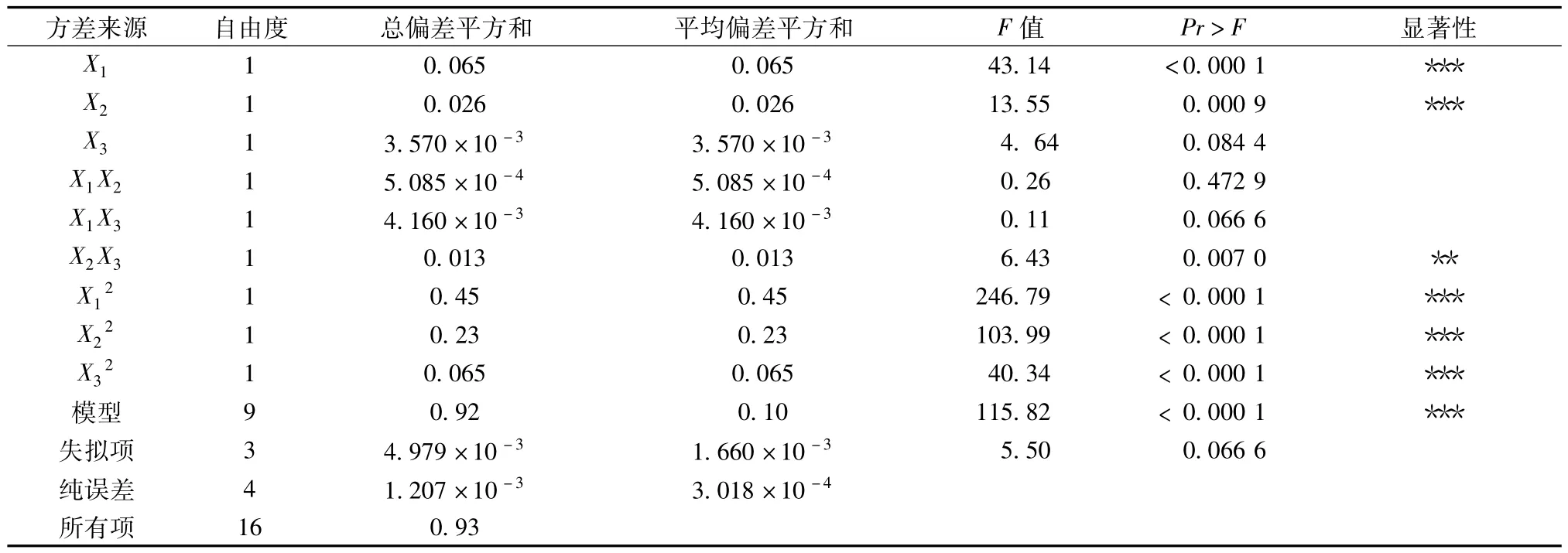
表3 回归方程的方差分析

表4 模型的可信度分析
2.3 模型的验证有响应面法分析可知,热水浸提蚬壳花椒果皮多糖的最佳工艺为:提取温度为94.28℃,液料比为81.72∶1,提取时间为146.48 min,在此条件下的多糖提取率为4.85%。为了验证响应面法的可靠性,采用上述最优提取条件进行蚬壳花椒果皮多糖的提取试验,同时考虑到实际情况,将提取工艺参数修正为:提取温度为94℃,液料比为82∶1,提取时间为146 min,提取2次,在此条件下做三组平行试验,测得平均提取率为4.99%,与理论预测值相比,其误差约为2.87%,在可接受范围内。

图5 提取温度(X1)与液料比(X2)对提取率(Y)的响应面与等值线
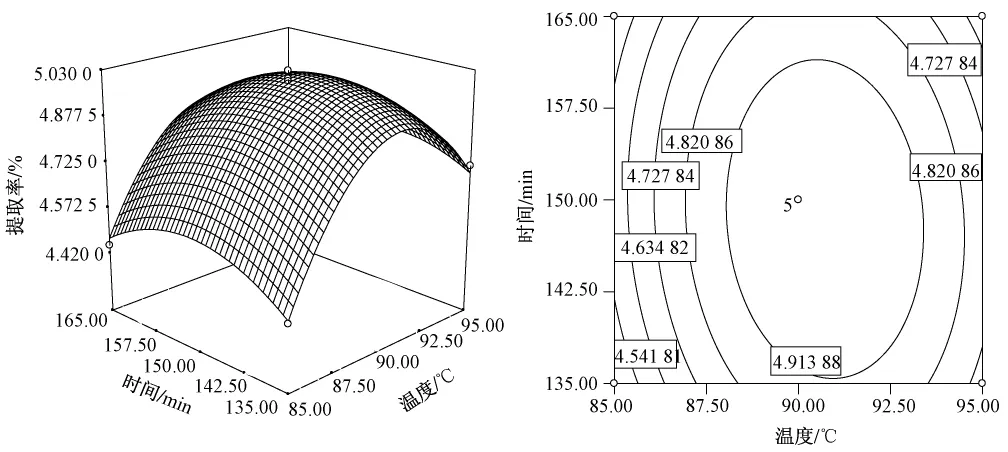
图6 提取温度(X1)与提取时间(X3)对提取率(Y)的响应面与等值线
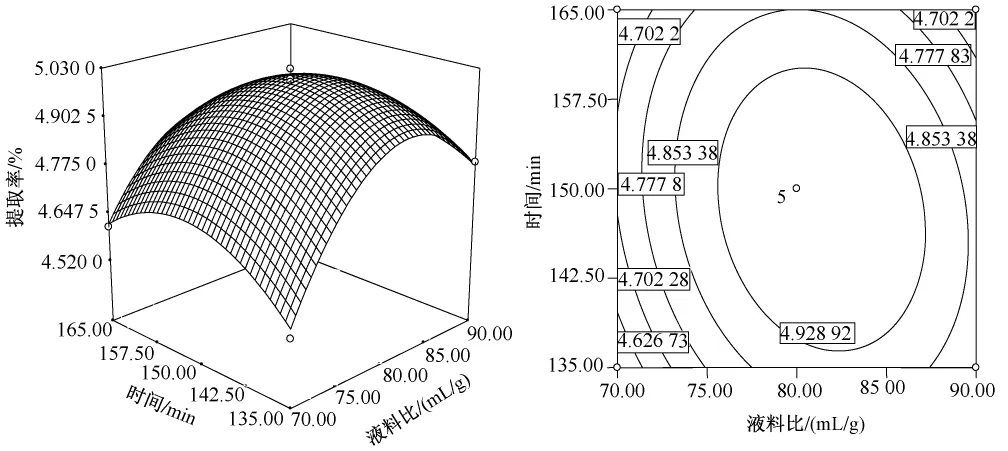
图7 液料比(X2)与提取时间(X3)对提取率(Y)的响应面与等值线
3 结论
采用水提醇沉法提取蚬壳花椒果皮总多糖,利用实验设计软件Design-Expert,通过响应面法对多糖提取工艺进行优化研究,使蚬壳花椒多糖的提取率最大化。经模型分析并修正后,蚬壳花椒果皮多糖的最佳提取工艺为:提取温度为94℃,液料比为82∶1,提取时间为146 min,提取2次,得出蚬壳花椒多糖平均提取率高达4.99%。采用响应面法分析提取工艺,不但可优化出最佳工艺,而且可以对提取率进行预测,其数据处理更加简便、科学。
[1]南京中医药大学.中华本草(第4册10-12卷)[M].上海:上海科学技术出版社,1999:986-987.
[2]南京中医药大学.中药大辞典(上册)[M].2版.上海:上海科学技术出版社,2006:183.
[3]《全国中草药汇编》编写组.全国中草药汇编(下册)[M].北京:人民卫生出版社,1996:1586.
[4]中国科学院中国植物志编辑委员会.中国植物志(第43卷第2册)[M].北京:科学出版社,2004:26-28.
[5]王建,龚兴国,多糖的抗肿瘤及免疫调节研究进展[J].中国生化药物杂志,2001,22(1):52-54.
[6]王丽萍,王平,王晓明,等.蚬壳花椒组培苗的生根试验[J].经济林研究,2007,25(1):34-37.
[7]马英姿,王平,梁文斌.药用植物蚬壳花椒的生境及生物学特性调查[J].经济林研究,2007,25(1):25-29.
[8]马英姿,王平,王晓明,等.蚬壳花椒组培苗的增殖研究[J].湖南农业大学学报:自然科学版,2007,33(5):552-555.
[9]马英姿,王平,王海霞.酸碱胁迫对蚬壳花椒组培苗内源激素的影响[J].中南林业科技大学学报,2008,28(5):59-63.
[10]马英姿,王平,王晓明,等.药用植物蚬壳花椒的离体培养及再生体系的建立[J].湖南师范大学:自然科学学报,2009,32(1):106-111.
[11]马英姿,杨波华,王平.药用植物蚬壳花椒种子休眠及萌发特性[J].湖南师范大学:自然科学学报,2009,32(2):98-102.
[12]马英姿,胡忠红,杨波华,等.蚬壳花椒营养器官解剖结构及其生物碱分布[J].湖南农业大学学报:自然科学版,2009,35(3):242-244.
[13]王平,王海霞,马英姿,等.蚬壳花椒叶片不定芽诱导与内源激素的变化规律[J].中草药,2008,39(9):1400-1403.
[14]王海霞,王平,王晓明,等.蚬壳花椒愈伤组织诱导的影响因素[J].湖南农业大学学报:自然科学版,2008,34(2):147-149.
[15]王海霞,王平.蚬壳花椒组培苗移栽技术研究[J].牡丹江师范学院学报:自然科学版,2010(2):37-38.
[16]汤俊,朱卫,屠治本.蚬壳花椒化学成分的研究[J].中草药,1995,26(11):563-565.
[17]韦瑀龙,张翠仙,林朝展,等.蚬壳花椒中生物碱成分的研究[J].中药新药与临床药理,2009,20(5):471-474.
[18]马英姿,王平,袁园,等.蚬壳花椒中性亲脂性成分的抑菌活性及其化学成分[J].林业科学,2010,46(2):162-165.
[19]Box G E P,Hunter W G.Statistics for Experiments:An Introduction to Design,Data Analysis and Model Building[M].New York:Wiley,1990.
[20]费荣昌.试验设计与数据处理[M].4版.无锡:江南大学出版社,2001:59-63.
