参葛颗粒质量标准研究
2012-01-25骆慧琳谢燕李国文张彤高月求
骆慧琳,谢燕*,李国文,张彤,高月求
(1.上海中医药大学,上海201203;2.上海中医药大学附属曙光医院,上海201203)
参葛颗粒是由丹参、葛根、片姜黄等六味中药组成的中药复方制剂,具有健脾祛湿,化瘀消痰的功效,药理实验和临床研究[1]表明对非酒精性脂肪肝病(Alcoholic Fatty Liver Disease,NAFLD)有较好的疗效。为了控制该制剂的质量,保证临床用药安全有效,通过实验研究及调阅文献[2-4],采用薄层色谱鉴别方法对女贞子、片姜黄、葛根、丹参进行定性鉴别,以葛根中葛根素和丹参中丹酚酸B作为定量测定的指标成分,并建立定量测定方法,所建立的方法能客观反映参葛颗粒的品质,对其质量进行有效控制。
1 仪器与试药
1.1 仪器Agilent 1100高效液相色谱仪(安捷伦科技有限公司);Kromasil 100-5C18色谱柱(AKZO NOBEL公司);CAMAG ATS4全自动点样仪、CAMAG Reprostar 3数码成像系统(瑞士卡玛公司);Sartorius CPA225D电子天平(赛多利斯公司)。
1.2 试药参葛颗粒(自制,批号:110901、110902、110903),齐墩果酸对照品(批号:110709-200505),片姜黄对照药材(批号:121006-200903),丹参对照药材(批号:120923-200912),葛根对照药材(批号:121551-200902),葛根素对照品(批号:110752-200912),丹酚酸B对照品(批号:111562-200908)均购于中国药品生物制品检定所。硅胶G、GF254(青岛海洋化工厂分厂),甲醇(色谱级,霍尼韦尔公司),纯化水,其余试剂均为分析纯。
2 方法与结果
2.1 薄层鉴别
2.1.1 女贞子薄层鉴别取本品研至细粉状,称取4 g,加50 mL三氯甲烷,超声30 min,抽滤,滤液至蒸发皿中低温蒸发有机溶剂至干,残渣加1 mL甲醇溶解,离心,取上层溶液作为供试品溶液。再取按处方比例及工艺制备的缺女贞子阴性对照样品8 g,按上述方法和步骤制成阴性对照溶液;另取适量的齐墩果酸对照品,至10 mL量瓶中,加甲醇超声溶解并稀释至刻度,制成1 mg/mL的齐墩果酸对照品溶液。照薄层色谱法(《中国药典》2010版一部附录VIB)试验,吸取上述溶液各4 μL,用全自动点样仪点于同一硅胶G薄层板上使成条带状,把环己烷-丙酮-乙酸乙酯(5∶2∶1)作为展开剂[5],展开至前沿线,取出,晾干后均匀喷洒10%硫酸乙醇溶液,置加热板上105℃加热至斑点显色清晰,于紫外灯366 nm下观察荧光,结果见图1。阴性对照未见干扰,而供试品与齐墩果酸在相应的位置上,显示相同颜色的荧光斑点。
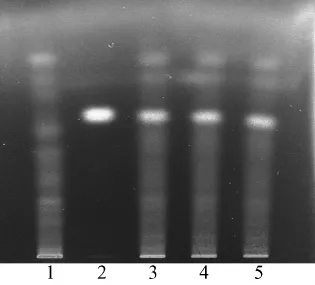
图1 女贞子薄层色谱图Fig.1 TLC chromatogram of Ligustri lucidi Fructus
2.1.2 片姜黄薄层鉴别[6]取本品研至细粉状,称取4 g,加20 mL水超声10 min,滤过,滤液用石油醚(30~60℃)萃取3次,每次20 mL,合并石油醚层,浓缩至0.5 mL,作为供试品溶液。再取按处方比例及工艺制备的缺片姜黄阴性对照样品4 g,按上述方法和步骤制成阴性对照溶液;另取0.4 g片姜黄对照药材,加2 mL石油醚(30~60℃),超声30 min,离心,取上清液,浓缩至0.5 mL,作为对照药材溶液。照薄层色谱法(《中国药典》2010版一部附录VIB)试验,吸取供试品溶液、阴性对照溶液、对照药材溶液1 μL、2 μL、2 μL,用全自动点样仪分别点于同一硅胶G薄层板上使成条带状,把石油醚(30~60℃)-乙酸乙酯(17∶3)作为展开剂,展开至前沿线,取出,晾干后均匀喷洒5%香草醛硫酸溶液显色,置加热板上100℃加热至斑点清晰,白光下检视,结果见图2。阴性对照未见干扰,而供试品与对照药材在相应的位置上,显示相同颜色的斑点。
2.1.3 葛根薄层鉴别取本品研至细粉状,称取0.1 g,加50 mL 25%甲醇超声30 min,滤过,水浴蒸干,残渣加1 mL甲醇溶解,离心,弃去沉淀,取上层液体作为供试品溶液。再取按处方比例及工艺制备的缺葛根阴性样品0.1 g,按上述方法和步骤制成阴性对照溶液;另取0.2 g葛根对照药材,同上述处理制成对照药材溶液。照薄层色谱法(《中国药典》2010版一部附录VIB)试验,吸取上述溶液各1 μL,用全自动点样仪分别点于同一硅胶G薄层板上使成条带状,把环己烷-丙酮-乙酸乙酯(5∶2∶1)作为展开剂,展开至前沿线,取出,晾干,用氨水熏10 min[7-8],在紫外灯254 nm下观察荧光,结果见图3。阴性对照未见干扰,而供试品与对照药材在相应的位置上,显示相同颜色的荧光斑点。

图2 片姜黄薄层色谱图Fig.2 TLC chromatogram of Wenyujin Rhizoma Concisum
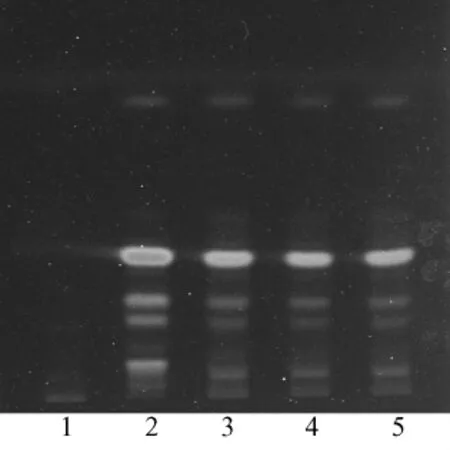
图3 葛根薄层色谱图Fig.3 TLC chromatogram of Puerariae lobatae Radix
2.1.4 丹参薄层鉴别取本品研至细粉状,称取0.2 g,加50 mL 25%甲醇超声30 min,滤过,水浴蒸干,残渣用1 mL甲醇溶解,离心,弃去沉淀,取上层液体作为供试品溶液。再取按处方比例及工艺制备的缺丹参阴性样品0.2 g,按上述方法和步骤制成阴性对照溶液;另取0.2 g丹参对照药材,同法制成对照药材溶液。照薄层色谱法(《中国药典》2010版一部附录VIB)试验,吸取上述溶液各3 μL,用自动点样仪分别点于同一硅胶GF254薄层板上使成条带状,把甲苯-乙酸乙酯-甲酸(8∶5∶0.8)作为展开剂[9],展开至前沿线,取出,晾干后在紫外灯366 nm下观察荧光,结果见图4。阴性对照未见干扰,而供试品与对照药材在相应的位置上,显示相同颜色的荧光斑点。

图4 丹参薄层色谱图Fig.4 TLC chromatogram of Salviae miltiorrhizae Radix et Rhizoma
2.2 定量测定
2.2.1 葛根素
2.2.1.1 色谱条件Kromasil-C18色谱柱(250 mm×4.6 mm,5.0 μm);以甲醇-水(25∶75)为流动相;检测波长为250 nm[10]。理论板数按葛根素峰计算应不低于4 000[11]。
2.2.1.2 对照品溶液的制备取适量葛根素对照品,精密称定,加甲醇制成每1 mL含葛根素100 μg的溶液。
2.2.1.3 供试品溶液的制备取本品粉末约0.1 g,精密称定,置具塞锥形瓶中,精密加入50 mL 25%甲醇,密塞,称定质量,超声10 min,放冷后再称定质量,用25%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.1.4 线性关系考察取适量葛根素对照品精密称定后置于10 mL量瓶中,以甲醇溶解并稀释至刻度,以25%甲醇逐级稀释,分别得到质量浓度为1.82、4.56、9.12、22.81、38.02、47.52 μg/mL的对照品溶液。精密吸取上述葛根素对照品溶液10 μL注入高效液相色谱仪,按2.2.1.1项下色谱条件测定,以葛根素质量浓度(X)为横坐标,以峰面积(Y)为纵坐标,绘制标准曲线,得回归方程Y=43.365X-15.474,r=0.999 8。结果表明葛根素进样量在0.018~0.480 μg范围内与峰面积的线性关系良好。
2.2.1.5 稳定性试验取同一供试品溶液,分别于配制后0、1、2、4、8、12 h重复进样测定。以葛根素峰面积计算,RSD为0.87%,表明供试品溶液在室温下放置12 h基本稳定。
2.2.1.6 重复性试验取同一批号供试品6份,按照正文定量测定方法操作并测定,其含有量的RSD为0.32%,表明本方法重复性较好。
2.2.1.7 精密度试验精密吸取同一对照品溶液(质量浓度为21.50 μg/mL)10 μL,相同条件下重复进样6次,求得葛根素峰面积的RSD为0.56%,结果表明该仪器有良好的精密度。
2.2.1.8 回收率试验精密称取已知葛根素含有量的同一批号样品9份,按相当于参葛颗粒中葛根素量的80%、100%、120%(即低、中、高剂量组)加入葛根素对照品溶液,按2.2.1.3项下方法制备供试品溶液,注入高效液相色谱仪,依法测定,计算回收率。结果见表1。葛根素的平均回收率为103.17%,RSD为2.43%。

表1 葛根素回收率测定结果Tab.1 Results of recovery tests
2.2.1.9 空白试验按照处方的组成和比例,取除葛根以外的其余药味并按照工艺条件制成缺葛根的供试品。按2.2.1.3项下的方法制备成阴性样品溶液。取阴性样品溶液10 μL,按照2.2.1.1项下进行测定,色谱图在葛根素相应的保留时间处没有色谱峰,说明阴性样品溶液无干扰。见图5。
2.2.1.10 样品测定取3批参葛颗粒(批号110901、110902、110903)适量,按2.2.1.3项下方法制备样品,以葛根素对照品质量浓度为横坐标(X),相应的色谱峰峰面积为纵坐标(Y),绘制随行标准曲线,测得样品的峰面积代入随行标准曲线,计算葛根素含量。按2.2.1.1项下色谱条件进行含量测定,结果见表2。

图5 葛根素对照品溶液(A)、供试品溶液(B)和阴性样品溶液(C)HPLC色谱图Fig.5 HPLC chromatograms of puerarin reference substance(A),granules sample(B)and negative sample(C)

表2 参葛颗粒中葛根素的测定结果(n=3)Tab.2 DeterminationresultsofpuerarininShenge Granules(n=3)
2.2.2 丹酚酸B
2.2.2.1 色谱条件Kromasil-C18色谱柱(250 mm×4.6 mm,5.0 μm);以甲醇-乙腈-1.67%甲酸水溶液(27∶10∶63)为流动相;检测波长为286 nm。理论板数按丹酚酸B峰计算应不低于2 000[11]。
2.2.2.2 对照品溶液的制备取适量丹酚酸B对照品,精密称定,加甲醇制成每1 mL含丹酚酸B 40 μg的溶液。
2.2.2.3 供试品溶液制备取本品粉末约0.2 g,精密称定,置具塞锥形瓶中,精密加入50 mL 25%甲醇,密塞,称定质量,超声10 min,放冷后再称定质量,用25%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.2.4 线性关系考察取适量丹酚酸B对照品精密称定后置于10 mL量瓶中,以甲醇溶解并稀释至刻度,以25%甲醇逐级稀释,分别得到质量浓度为201.49、80.60、50.37、30.22、15.11、9.07 μg/mL的对照品溶液。精密吸取上述葛根素对照品溶液10 μL注入高效液相色谱仪,按2.2.2.1项下色谱条件测定,以丹酚酸B质量浓度(X)为横坐标,以峰面积(Y)为纵坐标,绘制标准曲线,得回归方程Y=596.13X-6.350 1,r=0.999 9。结果表明丹酚酸B进样量在0.091~2.015 μg范围内与峰面积的线性关系良好。
2.2.2.5 稳定性试验取同一供试品溶液,分别于配制后0、1、2、4、8、12 h重复进样测定。以丹酚酸B峰面积计算,RSD为1.25%,表明供试品溶液在室温下放置12 h基本稳定。
2.2.2.6 重复性试验取同一批号供试品6份,按照正文定量测定方法操作并测定,其含有量的RSD为0.71%,表明本方法重复性较好。
2.2.2.7 精密度试验精密吸取同一对照品溶液(质量浓度为40.35 μg/mL)10 μL,相同条件下重复进样6次,求得丹酚酸B峰面积的RSD为0.51%,结果表明该仪器有良好的精密度。
2.2.2.8 回收率试验精密称取已知葛根素含有量的同一批号样品9份,按相当于参葛颗粒中丹酚酸B量的80%、100%、120%(即低、中、高剂量组)加入丹酚酸B对照品溶液,按2.2.2.3项下方法制备供试品溶液,注入高效液相色谱仪依法测定,计算回收率。结果见表3。丹酚酸B的平均回收率为101.38%,RSD为2.83%。
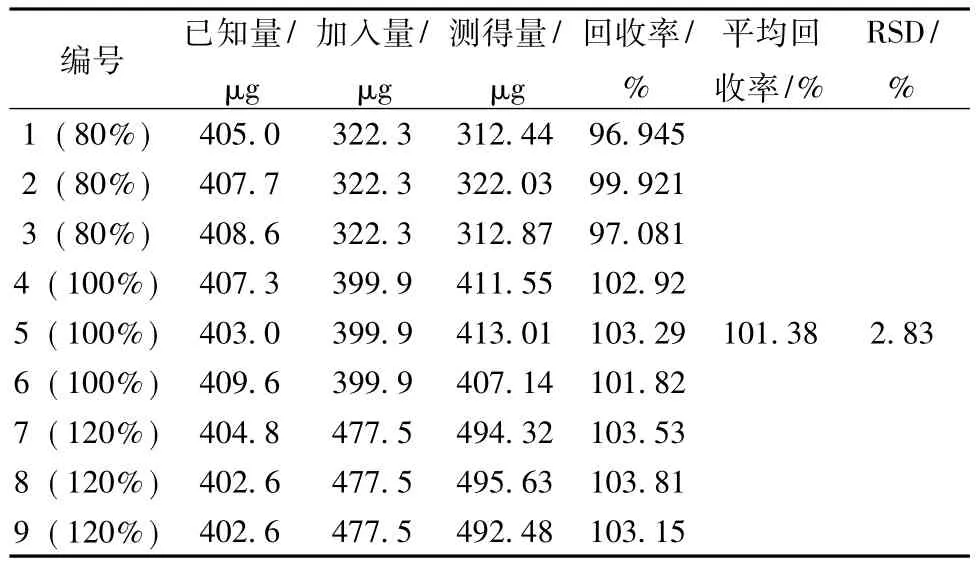
表3 丹酚酸B回收率测定结果Tab.3 Results of recovery tests of salvianolic B
2.2.2.9 空白试验按照处方的组成和比例,取除丹参以外的其余药味并按照工艺条件制成缺丹参的供试品。按2.2.2.3项下的方法制备成阴性样品溶液。取阴性样品溶液10 μL,按照2.2.2.1项下进行测定,色谱图在丹酚酸B相应的保留时间处没有色谱峰,说明阴性样品溶液无干扰。见图6。
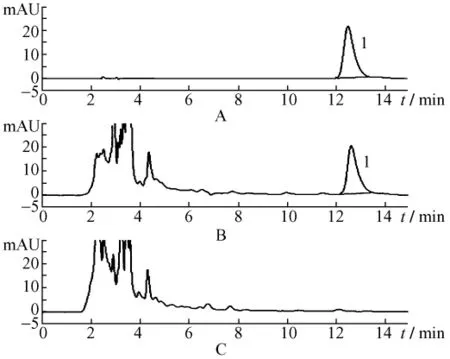
图6 丹酚酸B对照品溶液(A)、供试品溶液(B)和阴性样品溶液(C)HPLC色谱图Fig.6 HPLC chromatograms of salvianolic acid B re-ference substance(A),granules sample(B)and negative reference(C)
2.2.2.10 样品测定取3批参葛颗粒(批号110901、110902、110903)适量,按2.2.2.3项下方法制备样品,按2.2.2.1项下色谱条件进行含有量测定,以丹酚酸B对照品质量浓度为横坐标(X),相应的色谱峰峰面积为纵坐标(Y),绘制随行标准曲线,测得样品峰面积代入随行标准曲线,
计算丹酚酸B含量。结果见表4。

表4 参葛颗粒中丹酚酸B的测定结果(n=3)Tab.4 Determination results of salvianolic acid B in Shenge Granules(n=3)
3 讨论
在对片姜黄进行薄层鉴别中,供试品的处理方法曾经尝试直接用石油醚(30~60℃)提取,但供试品溶液的斑点与对照药材未能很好的对应,考虑到片姜黄的主要成分——挥发油可能由于经过β-环糊精包合,在有机溶剂中很难被提取出来,所以采用先以水提取后再以石油醚(30~60℃)萃取的方法处理样品,结果斑点对应一致。
在葛根的薄层鉴别中,展开晾干后若立即在紫外灯254 nm下观察,斑点很不明显,需放置1~3 h才能使斑点清晰,后改用氨水熏蒸,只需10 min就可使斑点显现。
在参葛方中,丹参为君药,葛根为臣药。丹参中的丹酚酸B具有抑制脂质过氧化反应及抗肝纤维化作用,其机制可能为丹酚酸B能清除氧自由基、抑制脂质过氧化反应,减少MDA的产生,从而减少肝细胞的损伤,抑制TGF-β的产生和HSC的增殖活化,具有抗肝纤维化作用[12]。葛根中的葛根素能明显防治实验性大鼠NAFLD,与辛伐他汀相比,葛根素能更高好地减轻脂类在肝脏中的积聚、降低炎症反应、保护肝细胞[13],两者分别被2010年版《中国药典》一部定为控制丹参、葛根质量的目标成分。故选择丹参中的丹酚酸B和葛根中的葛根素作为控制本品质量的定量指标。
该质量控制方法简便可靠、精密度高、分离效果好,可用于参葛颗粒的质量控制。
[1]陈亨平,姚君,陈招娣,等.参葛方配合饮食及运动疗法干预非酒精性脂肪性肝炎的临床研究[J].中西医结合肝病杂志,2009,19(5):273-275.
[2]王晓莉,刘成松.清瘟解毒分散片质量标准研究[J].中国中医药信息杂志,2012,19(1):60-62.
[3]阎雪梅,贾凡.扶肾颗粒质量标准研究[J].天津中医药大学学报,2011,30(4):234-237.
[4]严红,闫雪梅,张妍,等.粘脂饮质量控制[J].中国医院药学杂志,2009,29(20):1782-1784.
[5]姜宁华,吴素香,宋晓筠.β-环糊精包合五味子挥发油的工艺研究脂肪性肝炎的临床研究[J].浙江中医杂志,2009,44(6):460-461.
[6]杨晓云,王丽,谭晓艳.补肾强身胶囊的质量标准研究[J].黑龙江医药,2009,22(6):807-809.
[7]王苏会,闫荟,王瑞.复聪颗粒质量标准研究[J].中医药导报,2010,16(8):77-79.
[8]袁红英,杨雪萍,张志国,等.利脑心胶囊质量标准的方法学研究[J].实用医药杂志,2010,27(6):519-522.
[9]廖婉,傅超美,贾东艳,等.心可宁胶囊质量标准研究[J].成都医学院学报,2008,3(1):31-34.
[10]陆霄鹤.HPLC法测定两种葛根中葛根素含量[J].内蒙古中医药,2010,29(2):33-34.
[11]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:313.
[12]王迎春,刘炎芳,朱瑞萍.丹酚酸B对大鼠非酒精性脂肪性肝炎的影响[J].中国实用医药,2011,5(33):10-12.
[13]郑培永,马赞颂,柳涛,等.葛根素对非酒精性脂肪肝大鼠肝脏脂质的影响[J].上海中医药杂志,2009,42(1):61-63.
