丹酚酸B对大鼠肾缺血再灌注损伤的保护作用
2012-01-25唐桂毅李靖菲李琳徐成邵力钧周晓棉
唐桂毅,李靖菲,李琳,徐成*,邵力钧,周晓棉
(1.沈阳药科大学,辽宁沈阳110016;2.呼伦贝尔市人民医院药剂科,内蒙古呼伦贝尔021008)
缺血再灌注损伤(Ischemia-reperfusion injury,IRI)是指缺血组织或器官重获血流灌注或氧供应后,对组织或者器官所产生的损伤作用。肾脏为高灌注器官,对缺血及缺血后再灌注均较敏感[1],因此肾缺血-再灌注损伤(Renal ischemia-reperfusion injury,RIRI)在临床上较为常见,其病理生理变化多见于急性失血、中毒性休克、肾血管手术和肾脏移植等过程中。
丹酚酸(salvianolic acid)系丹参的水溶性有效成分,属酚酸类化合物,在丹参的功效作用中占有重要地位。丹酚酸的基本化学结构为丹参素。丹酚酸B由三分子丹参素与一分子咖啡酸缩合而成,是目前研究较多的丹酚酸之一[2]。丹酚酸B具有广泛的药理作用,已有研究表明丹酚酸B对脑损伤、心肌缺血再灌注以及肝纤维化等方面有较好的保护作用[3],但对RIRI的保护作用少见文献报道。本实验研究了丹酚酸B对RIRI大鼠的保护作用,并初步探讨其作用机制。
1 材料
1.1 药物与试剂丹酚酸B(纯度为95%,沈阳药科大学天然药化教研室提供);水合氯醛(天津瑞金特化学品有限公司,批号20071016);超氧化物歧化酶(Superoxide Dismutase,SOD)、丙二醛(Malondialdehyde,MDA)、白介素-6(Interleukin-6,IL-6)、白介素-8(Interleukin-6,IL-8)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、尿蛋白(Proteinuria,PU)定量测试盒(南京建成生物工程研究所,批号20080407),血清肌肝(Creatinine,Cre)、尿素氮(Urea nitrogen,BUN)试剂盒(北京北化康泰临床试剂有限公司,批号20071029)。
1.2 实验动物Wistar雄性大鼠,50只,体质量(250±20)g,由沈阳药科大学实验动物中心提供,合格证号:SCXK(辽)2003-008。
1.3 实验仪器721型分光光度计(上海精密科学仪器有限公司),二氧化碳培养箱(美国Hu Air),Model450自动酶标检测仪(Bio-Rod)。
2 实验方法
2.1 实验分组及给药将50只雄性Wistar大鼠按体质量随机分成5组,每组10只:缺血再灌注组(模型组)、假手术组(对照组)及丹酚酸B治疗组(丹酚酸B 2.5、5.0、10.0 mg/kg组)。丹酚酸B各治疗组分别于术前24 h和术后24 h、48 h腹腔注射同质量分数的丹酚酸B各1次,给药容积为10 mL/kg(模型组和假手术组给予同容积的0.9%氯化钠注射液)。
2.2 动物模型制作大鼠术前禁食不禁水12 h,3.5%水合氯醛10 mL/kg腹腔注射麻醉,腹部备皮,碘伏消毒后,腹部正中切口暴露双侧肾脏,钝性分离双侧肾动脉,保护输尿管,距肾门0.5 cm处用无创动脉夹夹闭双侧肾动脉,夹闭50 min后松开动脉夹恢复灌注,肾脏由暗红色恢复红润表明再灌注成功;如果松开动脉夹5 min未恢复红润,则视为再灌注失败,弃去不用。然后逐层缝合切口。假手术组只暴露双侧肾蒂(不结扎),暴露50 min后再关闭切口,不做肾缺血处理。
2.3 检测指标采集的大鼠血液3 000 r/min离心15 min后取血清分装后-80℃冰箱保存,按检测试剂盒说明书方法分别测定Cre、BUN、MDA、SOD、IL-6、IL-8和TNF-α的水平。术后48~72 h内收集大鼠尿液,用来检测尿中含尿蛋白量。术后72 h处死大鼠,取两侧肾脏置于10%中性甲醛固定以制备石蜡切片,于光镜下观察肾组织形态学变化。
3 实验结果
3.1 血清中BUN、Cre和尿液中尿蛋白的变化情况模型组与假手术组比较,前者大鼠血清中BUN、Cre和尿液中尿蛋白水平明显升高;与模型组比较,治疗组能够剂量依赖性的降低RIRI后血清中BUN、Cre和尿液中尿蛋白水平,其中以丹酚酸B高剂量组(10.0 g/kg)尤为明显。结果见表1。
表1 对RIRI大鼠BUN、Cre和PU的影响(±s,n=10)Tab.1 Effects of salvinolic acid B on contents of BUN,Cre and PU in RIRI rats(±s,n=10)

表1 对RIRI大鼠BUN、Cre和PU的影响(±s,n=10)Tab.1 Effects of salvinolic acid B on contents of BUN,Cre and PU in RIRI rats(±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01。
组别剂量/(mg·kg-1)BUN/(mmol·L-1)Cre/(μmol·L-1)PU/(mg·L-1)28.11±3.96174.69±12.99167.01±8.61假手术组-7.11±2.02**88.87±9.06**6.26±4.23**丹酚酸B组2.524.58±1.92157.54±10.24156.61±9.18丹酚酸B组5.021.22±3.50130.18±9.80*117.05±7.62*丹酚酸B组10.017.10±2.31*111.86±11.04**86.81±8.93模型组-**
3.2 对肾组织病理学的改变肾组织以10%中性甲醛溶液固定,在脱水、透明、浸蜡、包埋后,切成石蜡切片,经HE染色,400倍光镜下观察肾组织损伤情况。光镜下,假手术组肾组织结构未见异常;丹酚酸B 10 mg/kg组肾小球、肾小管结构基本完整,肾间质未见异常;模型组肾小管上皮细胞变性、坏死,少数肾小管腔内有少量蛋白质液积聚,肾小球出现水肿、萎缩。结果见图1。

图1 肾组织在光镜下形态Fig.1 Morphous of kidney under light microscope
3.3 血清中SOD、MDA的变化情况与假手术组比较,模型组大鼠血清中MDA水平明显升高,SOD活性明显下降;与模型组比较,治疗组能够剂量依赖性降低RIRI后血清中MDA水平,升高SOD活性,其中以丹酚酸B高剂量组(10.0 g/kg)作用最显著。结果见表2。
表2 对RIRI大鼠血清中SOD和MDA的影响(±s,n=10)Tab.2 Effects of salvianolic acid B on contents of SOD and MDA in serum in RIRI rats(±s,n=10)
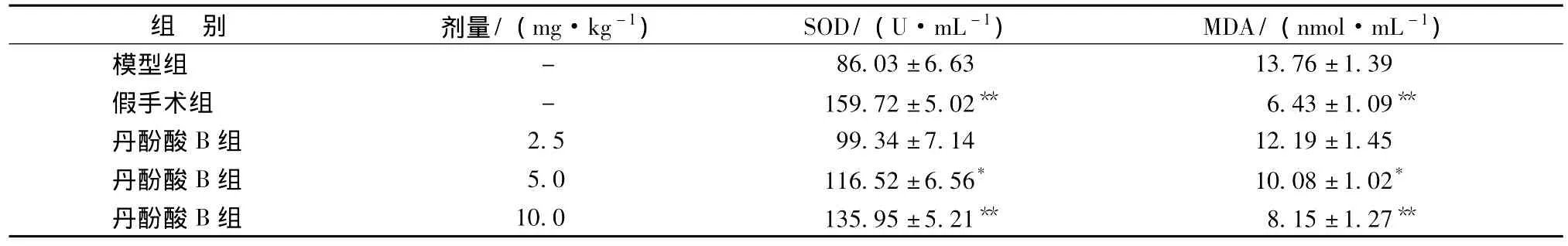
表2 对RIRI大鼠血清中SOD和MDA的影响(±s,n=10)Tab.2 Effects of salvianolic acid B on contents of SOD and MDA in serum in RIRI rats(±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01。
组别剂量/(mg·kg-1)SOD/(U·mL-1)MDA/(nmol·mL-1)86.03±6.6313.76±1.39假手术组-159.72±5.02**6.43±1.09**丹酚酸B组2.599.34±7.1412.19±1.45丹酚酸B组5.0116.52±6.56*10.08±1.02*丹酚酸B组10.0135.95±5.21**8.15±1.27模型组-**
3.4 血清中IL-6、IL-8、TNF-α的变化情况模型组与假手术组比较,前者大鼠血清中IL-6、IL-8、TNF-α水平显著升高;与模型组比较,治疗组能够剂量依赖性降低RIRI后血清中IL-6、IL-8、TNF-α水平,其中以丹酚酸B高剂量组(10.0 g/kg)作用更明显。结果见表3。
表3 对RIRI大鼠血清中IL-6、IL-8和TNF-α的影响±s,n=10)Tab.3 Effects of salvianolic acid B on contents of IL-6,IL-8 and TNF-α in serum in RIRI rats±s,n=10)

表3 对RIRI大鼠血清中IL-6、IL-8和TNF-α的影响±s,n=10)Tab.3 Effects of salvianolic acid B on contents of IL-6,IL-8 and TNF-α in serum in RIRI rats±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01。
组别剂量/(mg·kg-1)IL-6/(pg·mL-1)IL-8/(pg·mL-1)TNF-α/(pg·mL-1)54.64±5.9227.58±2.6085.16±3.63假手术组-15.02±3.66**17.91±1.54**54.12±2.18**丹酚酸B组2.549.96±5.1025.35±2.1881.51±3.77丹酚酸B组5.037.30±5.61*23.31±2.4870.38±2.59*丹酚酸B组10.026.05±4.64**20.37±1.92*61.42±3.67模型组-**
4 讨论
肾缺血再灌注能够造成肾单位的广泛性破坏,包括肾小球滤过率下降,但其通透性增强;肾小管上皮细胞受损,导致肾小管的重吸收作用减弱等。常见临床表现为血清中BUN和Cre升高,同时出现蛋白尿[4-5]等症状。本实验结果显示,丹酚酸B能显著降低血清中BUN、Cre和尿液中尿蛋白的含量,减轻缺血再灌注对肾小球和肾小管的损伤。因此,丹酚酸B对RIRI大鼠有较好的保护作用。
虽然RIRI的发病机制尚未完全清楚。但近年来的研究表明大量氧自由基的产生以及免疫细胞介导的炎症反应在RIRI的发病中起关键作用[6-7],并且存在一定的联系。
RIRI时,大量的氧自由基(Oxygen free radicals,OFR)可通过黄嘌呤氧化酶、线粒体和花生四烯酸等多种途径,由组织血管内皮细胞和中性粒细胞产生。近年大量研究证实,自由基反应是导致肾缺血再灌注损伤的重要原因[8],其损伤机制为:①OFR可直接与生物膜上的不饱和脂肪酸(PUFA)发生脂质过氧化反应,其产物MDA对细胞产生毒性作用;②OFR可破坏蛋白质、核酸以及细胞间基质,从而加剧细胞损伤;③肾脏缺血时,增加的OFR可诱发组织细胞凋亡,进一步加重肾脏损伤;④RIRI时,可促进某些促炎基因产物的表达和生物活性分子的产生,促进白细胞激活和趋化聚集,引起炎症级联反应,加重肾损伤。SOD是超氧阴离子的专一性活化酶,其活性的高低反映了机体抗自由基水平的强弱[9]。由于氧自由基半衰期太短很难直接测定,所以常选择测定SOD的活力;而MDA是脂质过氧化的最终产物,它的含量反映了自由基攻击机体细胞的损伤程度。本实验结果显示,丹酚酸B能够升高RIRI大鼠血清SOD的活性,降低MDA的水平。因此,丹酚酸B对RIRI的保护作用可能是通过抑制脂质过氧化物的形成、提高机体SOD的活性并提高清除自由基能力,从而打破氧自由基介导的细胞损害作用,保护细胞膜结构和功能的完整性来实现的。
文献证明许多炎症因子参与了RIRI的病理生理过程[10],其中TNF-α、IL-6和IL-8是介导炎症反应的重要细胞因子。而TNF-α具有广泛的生物学作用,被认为是重要的促炎因子[11]。在RIRI期间,TNF-α参与RIRI的可能机制[12]是:①TNF-α诱导单核巨噬细胞、中性粒细胞等分泌和释放IL-6、IL-8、OFR和TNF-α本身等炎症介质,启动瀑布式炎症级联反应,使炎症反应放大[13-14];②炎症时,炎症介质诱导细胞产生iNOS,并合成大量NO,高浓度的NO具有潜在的有害作用,一方面引起持续的血管扩张,使血压下降,导致肾脏进一步缺血,炎症损伤加重;另一方面,NO可产生细胞毒性物质,如过氧亚硝酸盐及其不稳定过程中分解的羟自由基,进而引起肾脏损伤;③TNF-α可上调血管内皮细胞表达黏附分子,增加中性粒细胞、嗜酸性粒细胞与血管内皮细胞黏连,有助于白细胞炎症渗出及其它炎症细胞迁移至炎症区;同时这种黏连能堵塞微循环,最终导致再灌注后无复流现象[15];④IL-8激活中性粒细胞,促进中性粒细胞介导的呼吸爆发,引起酶的外释和OFR的增加,加强致炎反应,对肾脏造成损伤。本实验结果显示,丹酚酸B组能够降低RIRI后血清中IL-6、IL-8、TNF-α水平,从而减轻肾I/R损伤程度。因此,丹酚酸B抗大鼠RIRI的机制可能与抑制炎症反应有关。
Bonventre等[16]以及Chien等[17]证明在RIRI中,OFR的产生与早期凋亡及炎症反应相关联,说明OFR参与了炎症反应。发生炎症反应时,炎症细胞可以释放大量细胞因子如TNF-α、IL-6、IL-8等,使白细胞呼吸爆发,又产生大量的OFR,结果造成严重的氧化应激,导致一种恶性循环。因此,丹酚酸B的作用机制可能是:①通过减少肾缺血再灌注损伤后自由基的产生,从而间接的减轻肾缺血再灌注损伤后的炎症反应;②直接降低OFR对中性粒细胞、内皮细胞、巨噬细胞内核蛋白因子(nuclear factor kappa,NF-κB)的活化作用,来减少炎性因子基因的转录和表达,缓解了炎症反应。
综上所述,丹酚酸B对RIRI大鼠具有较好的保护作用,其作用机制可能是通过减轻RIRI后氧自由基的损伤以及缓解炎症反应来实现的。
[1]薛福平,李荣山.中华眼镜蛇毒抑制肾缺血再灌注损伤的实验研究[J].中华肾脏病杂志,2005,21(8):483-486.
[2]杜冠华,张均田.丹参现代研究概况与进展(续一)[J].医药导报,2004,23(6):35-36.
[3]湛月娥,徐江平.丹酚酸B药理作用的研究进展[J].华南国防医学杂志,2007,21(2):37-39.
[4]宋艳芳,刘健.丙泊酚对大鼠急性肾缺血再灌注损伤的抗氧化机制研究[J].实用医技杂志,2007,14(11):1372.
[5]王新良,黄善生,陈晓玲,等.肾缺血再灌注大鼠蛋白尿的生成及NO的作用[J].中国病理生理杂志,2001,17(4):330-333.
[6]夏安周,邢淑华,张昭辉,等.大鼠肾缺血再灌注过程中脂质过氧化损伤的实验研究[J].徐州医学院学报,2004,24(2):109-111.
[7]雷学成,雷田香,杨晓溪,等.血府逐瘀汤对肾缺血-再灌注损伤大鼠TNF-α、IL-1和IL-6的影响[J].贵阳中医学院学报,2007,29(3):57-58.
[8]Holleyman C R,Larson D F.Apoptosis in the ischemic reperfused myocardium[J].Perfusion,2001,16(6):491-502.
[9]杨舜,裴凌.rhBMP-2对肾缺血再灌注损伤大鼠肾组织的影响及其分子机制[J].药学学报,2009,44(10):1089-1094.
[10]Ramesh G,Reeves W B.Inflammatory cytokines in acute renal failure[J].Kinney Int Suppl,2004(91):56-62.
[11]Segal R,Dayan M,Zinger H,et al.Suppression of experimental systemic lupus erythematosus(SLE)in mice via TNF inhibition by an anti-TNF alpha monoclonal antibody and by pentoxiphylline[J].Lupus,2001,10(1):23-31.
[12]李靖菲.丹酚酸B对大鼠肾缺血再灌注损伤的保护作用研究[D].沈阳:沈阳药科大学,2009.
[13]刘凤,石增立,于小玲,等.肾缺血再灌注损伤时血清及肾组织中促炎症细胞因子的变化与意义[J].中国临床医学,2005,12(1):174-176.
[14]王小梅,甄卓丽,陈小芳,等.丹参注射液对Ⅱ型糖尿病肾病患者血液IL-6、IL-8和TNF-α水平的影响[J].河北医学,2005,11(9):769-772.
[15]刘镇,连俊兰.心肌缺血再灌注炎症损伤机制的研究进展[J].中国心血管病研究杂志,2004,2(11):909-911.
[16]Bonventre J V,Weinberg J M.Recent advances in the pathophysiology of ischemic acute renal failure[J].Am Soc Nephrol,2003,14(8):2199-2210.
[17]Chien C T,Lee P H,Chen C F.De novo demonstration and colocalization of free-radical production and apoptosis formation in rat kidney subjected to ischemia/reperfusion[J].J Am Soc Nephrol,2001,12(5):973-998.
