连接臂对适体与凝血酶相互作用影响的电化学阻抗研究
2012-01-25彭亚鸽
彭亚鸽
(宁夏大学 化学化工学院,宁夏 银川 750021)
适体是利用SELEX体外筛选技术从核酸分子文库中获得的单链DNA或RNA。适体能与氨基酸、蛋白、药物、有机小分子、无机离子等靶物质特异性、高选择性结合[1,2]。适体作为分子识别物质,比大分子的抗体相比较,不仅具有分子量小,结构简单,能保证合成的精确性及易连接其它分子进行修饰等优点,而且还可以变性、复性且速度快,可反复使用、长期保存[3,4]。基于适体的这些优点,将适体作为生物传感器的识别元件,制成的适体生物传感器,具有不可替代的优势。适体生物传感器在蛋白质与DNA的相互作用、药物检测、医学诊断和治疗、分子开关等方面得到广泛应用[5-7]。非标记型电化学适体传感器以其简单、灵敏而倍受研究者的青睐。电化学交流阻抗技术是一种对电极界面性质变化十分敏感而便捷的检测技术,能够提供有关电极界面电子传递电阻,双电层电容等多种界面参数的大量信息。因此,电化学交流阻抗技术己被广泛应用于研究电化学反应过程及电极界面性质变化[8,9]。
凝血酶(Thrombin)是由39个氨基酸残基的轻链和259个氨基酸残基的重链组成的丝氨酸蛋白水解酶[10]。凝血酶的浓度及活性是衡量凝血机制的重要指标,对揭示肿瘤的发生机制,肿瘤细胞的早期诊断、疗效及预后判断等具有重大意义[11]。利用凝血酶适体设计检测凝血酶的电化学适体传感器近年来得到了研究者的关注[12-14]。但是连接臂的不同对适体与凝血酶之间的结合能力有比较大的影响。因此,本研究拟以三条连接臂长度不同的凝血酶适体作为识别分子,将其自组装于金电极上,以凝血酶为研究对象,结合巯基自组装技术,利用电化学交流阻抗技术,研究了连接臂对适体与凝血酶相互作用的影响,以期获得理想的凝血酶适体。
1 实验部分
1.1 仪器和试剂
电化学测量系统为CHI 660电化学工作站(上海辰华仪器公司)。实验采用三电极系统,组装适体传感器或金电极(φ=2 mm)作为工作电极,铂丝作为对极,Ag/AgCl(饱和KCl)作为参比电极。电化学阻抗法(Electrochemical Impedance Spectroscopy,EIS)使用CHI660电化学工作站。所有电位均以该参比电极电位为标准。
巯基己醇(MCH,97%)、Tween-20均购自美国Sigma公司。凝血酶(Human-thrombin Mw=36700 g/mol,pI=7.0~7.6)购自上海 Haematologic公司。铁氰化钾和亚铁氰化钾购自于上海化学试剂厂。所有试剂均为分析纯。所有储备液和缓冲溶液均使用二次去离子超纯水(France)配制。0.10 mol/LPBS磷酸盐缓冲溶液(PBS,pH=7.4)、固定结合缓冲液(Immobilization-Binding Buffer,I-B 缓冲溶液)为0.10 mol/L磷酸缓冲溶液(PB,pH=7.00包含10 mmol/L KCl和2 mmol/L MgCl2)、检测溶液为0.10 mol/L PBS(pH=7.40,包含 10 mmol/L NaCl,10 mmol/LK3[Fe(CN)6]- 10 mmol/LK4[Fe(CN)6])。凝血酶适体(Thrimbin-Binding Aptamer)购自上海生物工程公司。
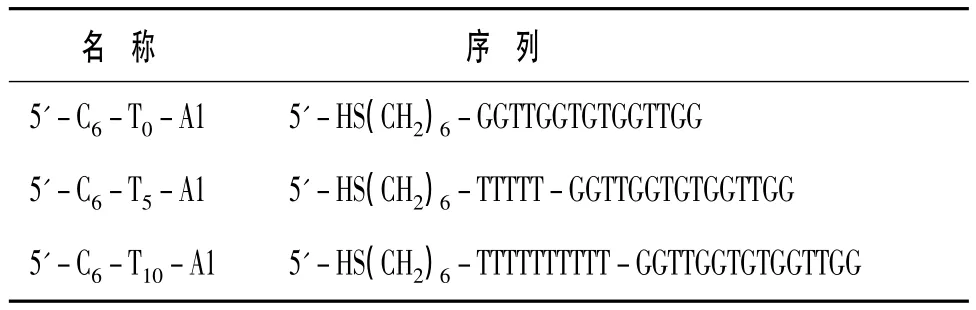
表1 凝血酶适体序列
1.2 电化学适体传感器的制备
金电极的预处理:先将金电极浸泡在Piranha溶液中(30%H2O2∶浓 H2SO4=1∶3 v/v)5 min,取出后用二次水冲洗干净;随后用0.03·μmAl2O3溶胶研磨,然后依次分别用乙醇、二次水超声清洗;再将金电极在0.1 mol/L H2SO4溶液中在电位范围-0.2~1.5 V循环伏安扫描直到得到标准金的还原峰,用二次水冲洗。微量移液器将20 μL预处理后(90℃水浴加热180 s,然后冰浴中迅速冷却,以获得适体的折叠结构)的适体溶液仔细滴涂在处理过的金电极表面(为了避免溶液蒸发使用合适的塑料帽覆盖电极表面),室温下静置适当的时间,电极表面用水冲洗;然后用2.0 μL 1.0×10-3mol/L巯基己醇(MCH)封闭30 min,以封闭电极表面没有被适体占据的空白位点,防止电极表面的非特异性吸附。封闭结束用冲洗缓冲溶液冲洗,得到本工作中的凝血酶适体传感器。
1.3 电化学测量方法
将适体传感器浸入100 μL一定浓度的凝血酶溶液中,室温下放置适当时间后,传感器用大量水冲洗以移走吸附的凝血酶,然后传感器置于含有2.0 mL0.10 mol/LPBS -10 mmol/LK4[Fe(CN)6]- 10 mmol/LK3[Fe(CN)6] - 10 mmol/L NaCl(pH=7.40)溶液的电化学池中进行电化学阻抗(EIS)测定。EIS 测定的偏电位0.226 V,通过[Fe(CN)6]3-/4-平衡电对的式电位来决定,频率范围100 kHz~1.0 Hz,每10倍频采12个点,振幅为5.0 mV。以电子传递电阻△Ret为分析信号,对凝血酶进行定量测定。如果没有特殊说明,电化学实验均在室温下进行(25±1℃)。
2 结果与讨论
2.1 电化学适体传感器的表征
采用电化学阻抗法对适体传感器进行表征。图1 为裸金电极(曲线 1),固定 5'-C6-T5-A1 链的金电极(曲线2),组装的适体传感器(曲线3),适体传感器与凝血酶相互作用50 min后获得的法拉第阻抗图谱(曲线4)。从图1可以看出,裸金电极几乎为一直线,[Fe(CN)6]3-/4-向电极的表面的扩散不存在阻碍。当 5'-C6-T5-A1 链固定在金电极表面上后,阻抗图谱上高频区半圆直径大大增加,电子传递电阻 Ret增大,这是由于 5'-C6-T5-A1 链磷酸骨架上带的负电荷排斥带负电荷的[Fe(CN)6]3-/4-平衡电对,阻碍平衡电对向电极表面传递,使电极表面电子传递电阻 Ret增大,说明 5'-C6-T5-A1 链已经成功的固定在金电极表面。组装好的传感器用巯基已醇(MCH)封闭后,电极在高频区半圆继续增大,原因是MCH为短链的巯基分子,它可以有效地占据没有被适体占据的电极表面的空白位点,减少电极表面非特异性吸附。同时也说明[Fe(CN)6]3-/4-在电极上的电子传递更困难。当适体传感器结合凝血酶分子50 min后,阻抗图谱上表现为高频区半圆继续增大,表明适体传感器与凝血酶结合,使得[Fe(CN)6]3-/4-平衡电对在电极上的电子转移速率常数越小,传感器上电子传递电阻Ret显著增大。因此,可以使用交流阻抗法对凝血酶进行测定。
2.2 适体传感器测量条件优化
2.2.1 自组装时间优化
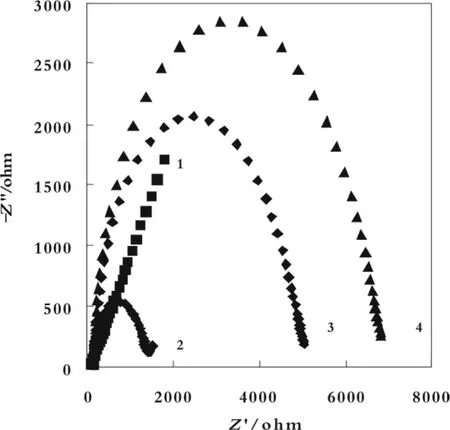
图1 适体传感器在[Fe(CN)6]3-/4-溶液中的交流阻抗图
考察了不同适体链固定时间对电子传递电阻Ret的影响。以 5'-C6-T5-A1 链为例,结果表明,电子传递电阻 Ret随 5'-C6-T5-A1 链固定时间增长而明显增加,当固定时间为5.0 h时,Ret达到稳定值。这表明在金电极表面的 5'-C6-T5-A1 的固定量,随着固定时间的增加慢慢达到饱和。固定时间为6.0~8.0时,Ret几乎与5.0 h时的Ret值相等。因此,本实验选择凝血酶适体的固定时间为6.0 h。
2.2.2 适体传感器与凝血酶相互作用时间优化
考察了凝血酶与适体传感器相互作用时间对传感器响应信号△Ret的影响。实验结果显示,相互作用时间在5~40 min之间增加时,△Ret显著增加,40 min时△Ret达到稳定值,40~60 min之间,△Ret变化不大,说明40 min相互作用时间足够凝血酶与适体的结合,为了保证适体与凝血酶的完全结合,在随后实验中选择适体传感器与凝血酶相互作用时间为50 min。
2.3 三条适体链结合反应的线性范围和检出限
在优化实验条件下,将三条不同长度连接臂修饰的凝血酶适体组装的电化学适体传感器对凝血酶进行测定。图 2 为 5'-C6-T0-A1 组装适体传感器对不同浓度(0.1~8.0 nmol/L)凝血酶测定的交流阻抗图。内插图为△Ret随凝血酶浓度变化图。从内插图可以看出△Ret与凝血酶的浓度在0.1~0.8 nmol/L之间呈良好的线性关系,线性回归方程为△Ret=1363.1 c-78.51(c/nmol/L),R2=0.9845。检出限0.05 nmol/L。
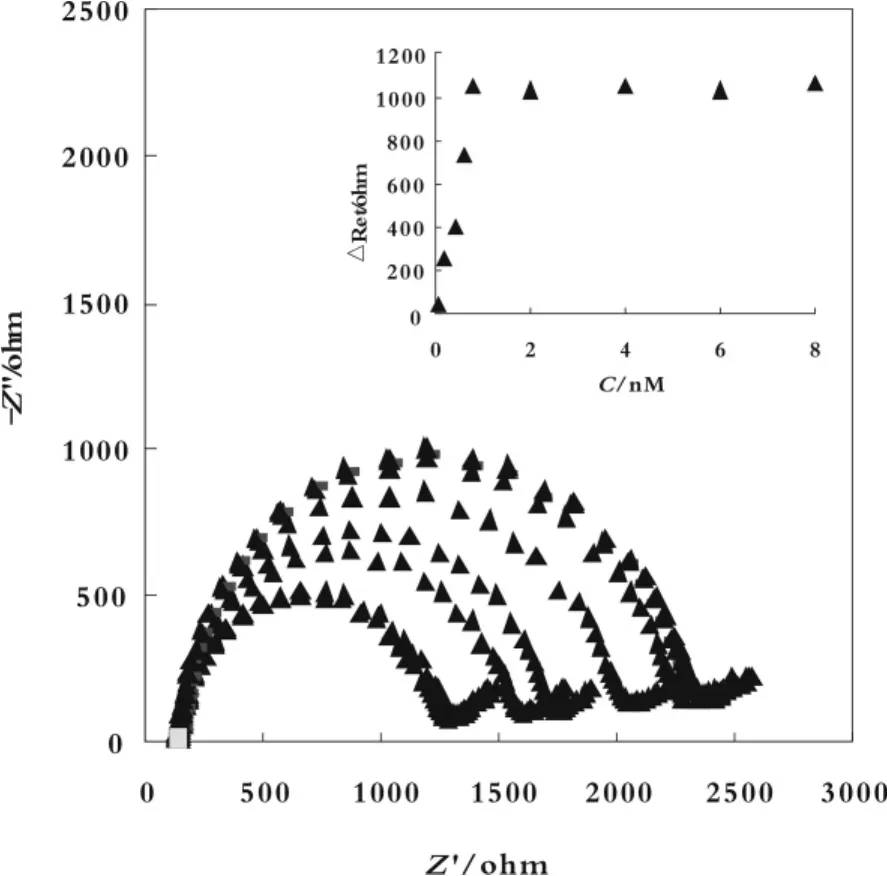
图2 5'-C6-T0-A1电化学适体传感器的复平面阻抗图及其线性关
图 3 为 5'-C6-T5-A1 组装适体传感器对不同浓度(0.1~8 nmol/L)凝血酶测定的交流阻抗图。内插图为△Ret随凝血酶浓度变化图。从内插图可以看出△Ret与凝血酶的浓度在0.1-1.0 nmol/L之间呈良好的线性关系,线性回归方程为ΔRet=67.12+1719.4 c(c/nmol/L),R2=0.9923。检出限为0.07 nmol/L。
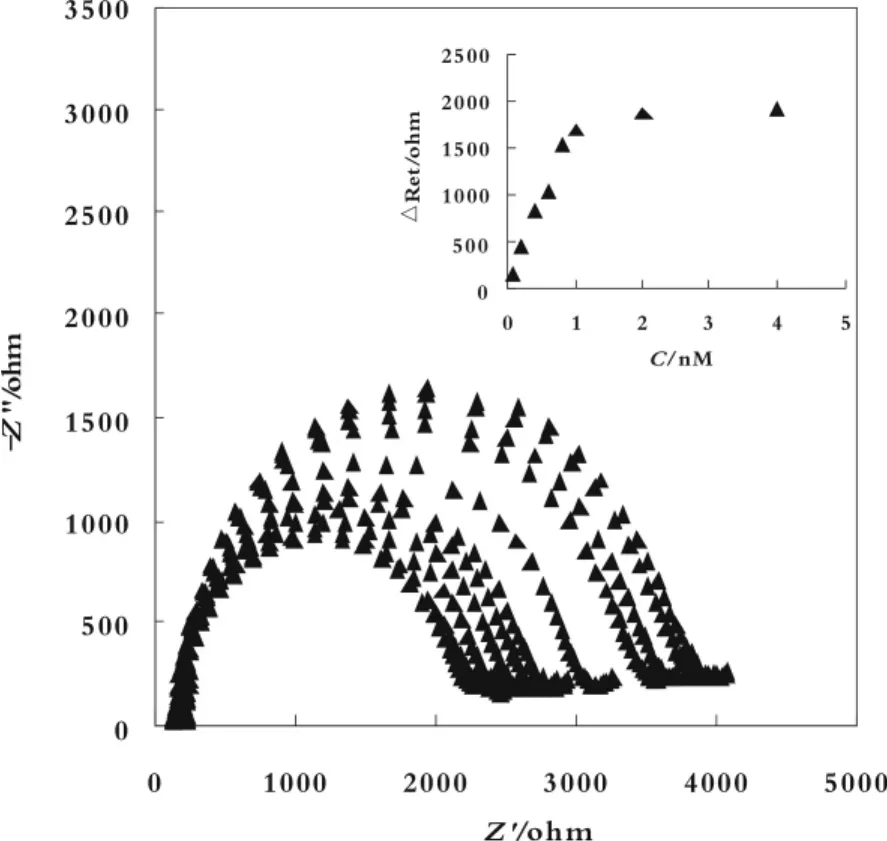
图 3 5'-C6-T5-A1 电化学适体传感器的复平面阻抗图及其线性关系
图 4 为 5'-C6-T10-A1组装适体传感器对不同浓度(0.1~8 nmol/L)凝血酶测定的交流阻抗图。内插图为△Ret随凝血酶浓度变化图。从内插图可以看出△Ret与凝血酶的浓度在0.1~0.8 nmol/L之间呈良好的线性关系,线性回归方程为△Ret=395.29+1618.8 c(c/nmol/L),R2=0.9982。检出限为0.05 nmol/L。
比较3种传感器的线性回归方程的斜率,其灵敏度为 5'-C6-T5-A1 > 5'-C6-T10-A1 > 5'-C6-T0-A1 >5'-C6-T20-A1。3 种传感器的灵敏度区别可能是由于不同的适体与凝血酶结合能力有差异引起的。
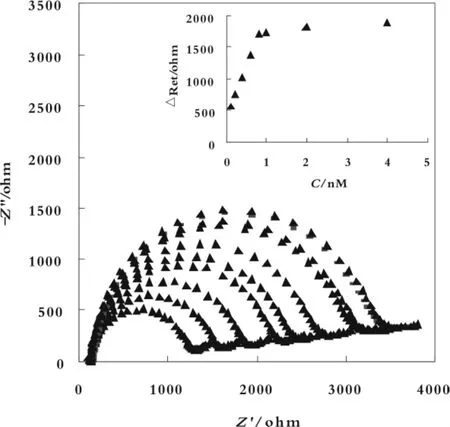
图 4 5'-C6-T10-A1 电化学适体传感器的复平面阻抗图及其线性关系
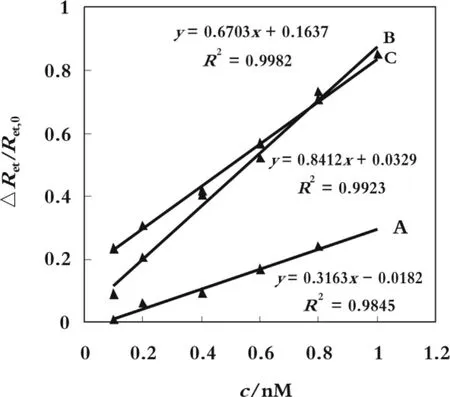
图 5 Ret/Ret,0 与(A)5'-C6-T0-A1,(B)5'-C6-T5-A1and(C)5'-C6-T10-A1 的线性关系
2.4 适体与凝血酶结合常数的测定
根据 Szymánska等[16]报道利用电化学交流阻抗法检测免疫反应的平衡常数。利用交流阻抗法测定了3种凝血酶适体与凝血酶的结合常数。以△Ret/Ret,0对凝血酶浓度c作图,得到一条直线,根据直线斜率,可以计算出适体与凝血酶的结合常数Ka。由图5可知,3条链的结合常数Ka分别为0.32 nM-1,0.84 nM-1,0.67 nM-1,5'-C6-T5-A1 > 5'-C6-T10-A1 >5'-C6-T0-A1。文献里曾有报道随着连接臂的增加自组装单层的适体传感器表面密度逐渐降低[15]。分析其原因,从 5'-C6-T0-A1 到 5'-C6-T5-A1结合常数增加,是由于凝血酶有更多机会与适体结合。而随着胸腺嘧啶连接臂长度的增加,结合能力整体有所下降,是因为适体的表面密度逐渐降低和连接臂的空间位阻加大所致。最终由于适体链变长,导致凝血酶距离电极越远,使得电子传递效率更加困难。
3 结论
设计了连接臂长度逐渐增加的适体链5'-C6-T0-A1、5'-C6-T5-A1 和 5'-C6-T10-A1,将其自组装于金电极上构成电化学适体传感器,利用交流阻抗技术,分别以这3种适体为识别分子测定凝血酶的线性范围和检出限,比较了三者灵敏度的差异。利用浓度平衡法计算了适体与凝血酶形成的结合常数。并通过动力学方法进行了验证。实验结果表明,5'-C6-T5-A1组装的传感器灵敏度最好,与凝血酶的结合常数最大。本研究对适体-目标蛋白质之间结合过程的机理有一个更深的理解,将有助于我们进一步揭示核酸与蛋白这两种生命中最关键物质之间的相互作用和关系,对于我们更好地理解基本的生物过程和预测设计适体生物检测方法,发展用于疾病诊断的方法有着重要的意义。
[1]Gold L.Conformational Properties of Oligonucleotides[J].Nucleic Acids Symp.Ser.1995,33:20 -22.
[2]Osborne S E,Matsumura I,Ellington A D.Aptamers as therapeutic and diagnostic reagents:problems and prospects[J].Curr.Opin.Chem.Biol.1997,1:5 -9.
[3]Famulok M,Hartig J S,Mayer G.Functional aptamers and aptazymes in biotechnology,diagnostics,and therapy [J].Chem.Rev.2007.107(9):3715-3743.
[4]Lee J O,So H M,Jeon E K,et al.Aptamers as molecular recognition elements for electrical nanobiosensors[J].A-nal.Bioanal.Chem.2008,390(4):1023 -1032.
[5]Klussmann S.The aptamer handbook[M].2006,Wiley-VCH,Weinheim.
[6]Balamurugan S,Obubuafo A,Soper S A,et al.Surface immo-bilization methods for aptamer diagnostic applications[J].Anal.Bioanal.Chem.2008,390:1009 -1021.
[7]Kaur G,Roy I.Therapeutic applications of aptamers[J].Expert opinion on investigational drugs,2008,17(1):43 -60.
[8]Balkenhohl P T,Kafka J,Schäfer D,et al.Impedance Spectroscopy and biosensing[J].Adv.Biochem.Eng.Biotechnol.2008,109:195-237.
[9]McGuinness R.Impedance- based cellular assay technologies:recent advances,future promise [J].Curr.Opin.Pharmacol,2007,7(5):535 -540.
[10]Striggow F,Riek M,Breder J,et al.The protease thrombin is an endogenous mediator of hippocampal neuroprotection at high concentrations [J].Proc.Nat.Acad.Sci.2000,97:2264-2267.
[11]黄松音.肿瘤患者凝血指标变化的临床意义[J].血栓与止血学,2002,8(4):156 -157.
[12]Bogomolova A,Komarova E,Reber K,et al.Aldissi challenges of electrochemical impedance spectroscopy in protein biosensing[J].Anal.Chem.2009,81(10),3944 -3949.
[13]Du Y,Li B L,Wei H,et al.Multifunctional label- free electrochemical biosensor based on an integrated aptamer[J].Anal.Chem.2008,80(13):5110 -5117.
[14]Li X X,Shen L H,Zhang D D,et al.Electrochemical impedance spectroscopy for study of aptamer- thrombin interfacial interactions[J].Biosens.Bioelectron.2008,23(11):1624-1630.
[15]Subramanian B,Anne O,Robin L,et al.Effect of linker structure on surface density of aptamer monolayers and their corresponding protein binding efficiency.anal.chem.2008,8(14):8916-8920.
[16]Szymánska I,Radecka H,Radecki J,et al.Electrochemical impedance spectroscopy for study of amyloid β - peptide Interactions with(-)nicotine ditartrate and(-)cotinine [J].Biosens.Bioelectron.2007,22:1955 -1960.
