纤维素与丙烯酸在氯化锌水溶液中的均相接枝*
2012-01-24叶代勇姚雷
叶代勇 姚雷
(华南理工大学化学与化工学院,广东广州510640)
纤维素是自然界丰富而又应用广泛的天然高分子材料之一.它是由D-吡喃葡萄糖环彼此以β-(1,4)糖苷键链接而成的高分子化合物,它的每个葡萄糖基环上均有3个羟基,这3个羟基在多相化学反应中具有不同的反应活性特性,在均相反应中的反应活性基本相同[1-4].随着全球能源与资源问题的日益突出,纤维素这种可再生资源引起了各国越来越多的重视,因为其可以广泛应用于纺织、造纸、食品、医药、材料、建筑等多个领域[5],被认为是未来化工的主要原料[6].
纤维素上丰富的羟基以及分子内和分子间的氢键作用使得纤维素很难溶于一般溶剂,其应用也相应地受阻.为了更好地应用这种廉价的可再生资源,纤维素化学改性成为人们争相研究的热点[7].纤维素的改性主要是由羟基发生反应来完成的,主要有酯化反应、酰化反应、醚化反应、接枝共聚反应等[1-5].其中接枝共聚反应是纤维素化学改性的重要方法之一,接枝后的纤维素不但能够让纤维素获得新的性能同时还不会破坏其固有的优点.单体通过共价化学键接枝到纤维素分子链上形成的纤维素接枝共聚物,能够制备性能优异的纳米晶须[4]、高吸水材料[8-9]、力学性能良好的模压板材[10]、具有抗菌性能的纤维素纤维[11];而且接枝后纤维素的表面亲水性分散基团明显增多[12].
纤维素接枝共聚分为均相接枝和多相接枝.由于纤维素本身的结构复杂,又受分子内和分子间氢键的影响,多相条件下的接枝反应是非均匀进行的;均相反应中,由于纤维素是整个分子溶解于溶剂中,形成一种透明的溶液,分子间和分子内的氢键均已断裂,对反应来说分子上的伯仲羟基都是可及的,不存在单体传质不均匀的问题,反应是均相进行的[13-14].均相反应可以提高纤维素反应性能,促进取代基分布均匀,有效地控制取代位置,有规律地将各种基团引入到纤维素分子链上[15-16].与非均相接枝相比,均相接枝能够更好地控制所得到的产品的物理化学性质,有利于提高产品的均一性及其应用范围[17].
以离子液体为溶剂的纤维素均相接枝反应研究较多[18-19],但是离子液体有价格高、制备难等缺点.本研究以价格便宜、制备简单的ZnCl2/水为溶剂溶解微晶纤维素,在均相的条件下用丙烯酸接枝溶解后的微晶纤维素,考察不同影响因素下的接枝率和接枝效率,并用红外光谱仪对接枝后的产物进行了鉴定,用热分析仪探讨了接枝前后的热性能.
1 实验材料和方法
1.1 主要试剂与仪器
主要试剂如下:微晶纤维素(MCC),广州市昱霖化工有限公司生产;丙烯酸单体(AA)、过二硫酸钾,天津市科密欧化学试剂有限公司生产;ZnCl2,上海强顺化学试剂有限公司生产;NaOH,南京化学试剂有限公司生产.以上试剂均为化学纯.
主要实验仪器如下:TG16-Ⅱ型高速离心机,长沙平凡仪器仪表有限公司生产;JY92-2DN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司生产;ZS-Nano S型马尔文粒度分析仪,英国Malvern仪器有限公司生产;Spectrum 2000型傅里叶变换红外光谱仪(FT-IR),美国珀金埃尔默公司生产;STA449C型综合热分析仪,德国Netzsch公司生产.
1.2 纤维素在ZnCl2水溶液中的接枝共聚反应
定量称取微晶纤维素,加入到配制好的65%ZnCl2水溶液中溶解,使其中MCC含量为1%,在磁力搅拌器下搅拌1~2 h得到澄清透明的纤维素/ZnCl2水溶液.通过乌氏粘度计法测得原微晶纤维素的聚合度(DP)为180~220.将一定量的 MCC/ZnCl2透明溶液置于恒压漏斗中,并滴加到去离子水中剧烈搅拌直接再生后反复洗涤,得到溶解后直接再生的MCC.将定量的MCC/ZnCl2水溶液加入到四口烧瓶中,并置于恒温水槽中,用K2S2O8作为引发剂,引发一定时间后用恒压漏斗加入适量的丙烯酸单体.接枝共聚一定时间后停止反应,再用恒压漏斗滴加到去离子水中剧烈搅拌再生,得到接枝后再生的纤维素悬浮液,在离心机下用去离子水反复洗涤,并用大量丙酮溶液洗涤反应产生的副产物,再用乙酸乙酯在常温下萃取48h,然后用旋转蒸发仪在50℃下提纯1.5h.充分提纯后的产物在功率400W、工作时间2s、间隔时间4 s的条件下超声分散20 min备用.充分洗涤后的再生纤维素用电导滴定的方法测定纤维素的接枝率[20].可以通过以下公式计算接枝率(G)和接枝效率(E):
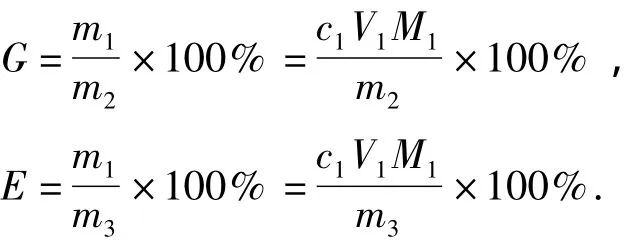
式中:m1为实验接枝上去的丙烯酸的质量;m2为实验加入的MCC的质量;m3为实验加入的丙烯酸的质量;c1为NaOH浓度;V1为滴定消耗的NaOH体积;M1为丙烯酸的相对分子质量,为72.06.
1.3 接枝共聚物表征
1.3.1 粒径和Zeta电位分析
取超声分散均匀后的溶液,稀释到0.1%左右,然后用马尔文粒度仪测试不同条件下接枝后的纤维素溶胶的粒径和Zeta电位,每个样品测试3次后取平均值.
1.3.2 红外图谱分析
直接溶解再生后的和接枝后的纤维素经过反复洗涤、除杂,在真空中干燥后研磨成粉末,与KBr粉末混合后研磨并压片,所得样品再次干燥数分钟后放入红外光谱分析仪中,按照GB/T 6040—2002红外光谱分析方法进行分析测试.
1.3.3 结晶度的X射线衍射分析
把接枝前后的纤维素干燥后研磨成粉末,充分干燥备用.采用德国Bruker公司生产的D8 ADVANCE型X射线衍射仪(XRD),在实验条件为:铜靶,40kV,40mA,步长0.02°,扫描速度17.7 秒/步下测试接枝前后纤维素的X射线衍射谱.
1.3.4 热重分析
在流速为5 cm3/min的 N2气流保护下,采用STA449C型综合热分析仪对干燥至恒重的MCC以及接枝后干燥至恒重的MCC进行热重分析,升温速率为10℃/min,温度范围为30~600℃.
2 结果与讨论
2.1 单因素试验及其影响分析
本研究通过单因素影响分析考察了引发剂引发时间、单体用量、接枝共聚时间、引发剂用量这些因素对接枝率和接枝效率的影响.
2.1.1 引发剂引发时间
在60℃、单体/MCC质量比5∶1、引发剂/MCC质量比1∶2、接枝共聚时间8 h的反应条件下,改变引发时间(t),考察引发剂引发时间对反应的影响,结果如图1所示.引发时间是指引发剂扩散到纤维素分子表面使纤维素产生自由基这个过程所需要的时间.
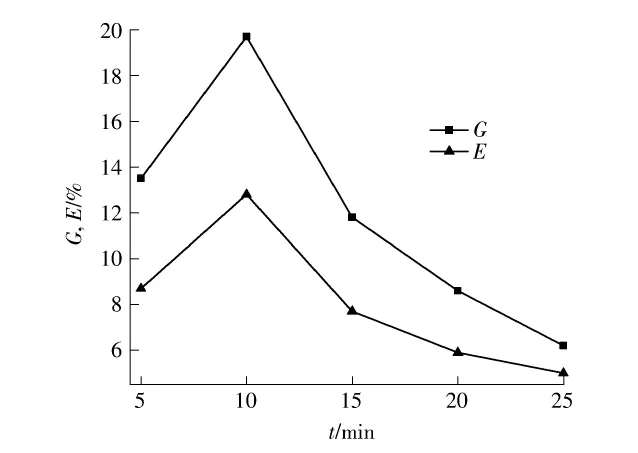
图1 引发时间对接枝率和接枝效率的影响Fig.1 Effect of initiation time on grafting yield and grafting efficiency
由图1可以看到,在一定的引发时间范围内随着引发时间的增加接枝共聚反应的接枝率和接枝效率都增加,这主要是因为随引发时间的增加过硫酸根和纤维素都产生更多的自由基[12,21].当引发时间大于10min之后,进一步增加时间接枝率和接枝效率反而减小,这主要是因为,引发时间延长,自由基增多,进而引发自由基之间的偶合反应[21].
2.1.2 单体用量
以60℃、引发时间10min、引发剂/MCC质量比1∶2,接枝共聚反应8h为反应条件,考察不同AA用量对共聚反应接枝率和接枝效率的影响.结果如图2所示.
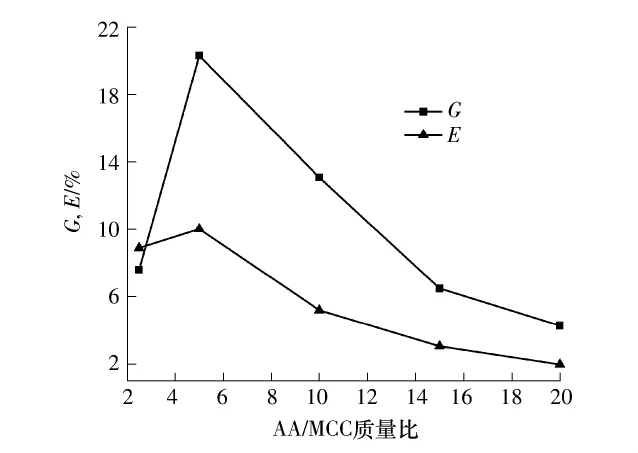
图2 AA/MCC质量比对接枝率和接枝效率的影响Fig.2 Effect of AA/MCC mass ratio on grafting yield and grafting efficiency
由图2可知,随着单体用量的增加,共聚反应的接枝率先显著增加然后减小,接枝效率先适量增加然后逐渐变小.这主要是因为,当丙烯酸单体浓度较低的时候,过硫酸根自由基主要引发丙烯酸和纤维素发生接枝反应,当丙烯酸量增加到一定的值之后,会出现纤维素骨架自由基链引发和丙烯酸自聚竞争反应活性,此时主要先发生单体自聚反应[21],因而接枝效率明显减小,接枝率也减小.接枝反应机理也能够说明单体的用量对接枝共聚反应的重要影响.
2.1.3 接枝共聚时间
图3示出了接枝共聚反应时间(t')对实验结果的影响.实验条件是60℃、AA/MCC质量比5∶1、引发时间10min、引发剂/MCC质量比1∶2,在不同反应时间测定反应接枝率和接枝效率.从图3中可以看到,在一定的时间内随着反应时间的增加,接枝率和接枝效率都是增加的,8h以后反应接枝率和接枝效率都基本不再变化.这主要是因为,反应初期,反应物浓度比较大,纤维素骨架自由基比较多,反应速率比较快,当反应到一定时间后自由基减少,纤维素自由基链引发减慢,直到后期反应基本不再发生变化.
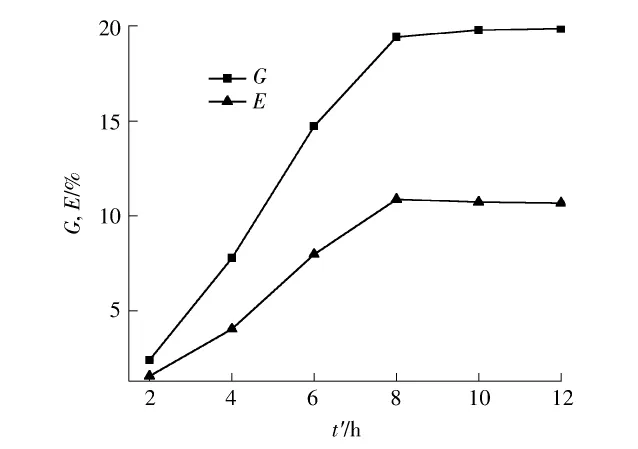
图3 共聚反应时间对接枝率和接枝效率的影响Fig.3 Effect of copolymerization time on grafting yield and grafting efficiency
2.1.4 引发剂用量
在60℃、AA/MCC质量比5∶1、引发时间10min、反应时间8h的条件下,测定不同引发剂用量下的接枝率和接枝效率,结果如图4所示.
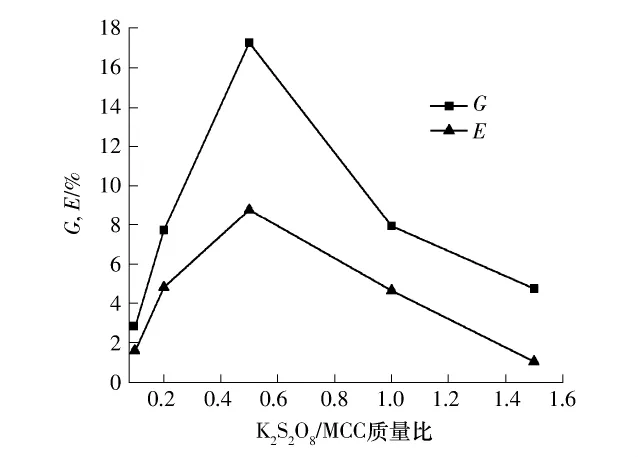
图4 K2S2O8/MCC质量比对接枝率和接枝效率的影响Fig.4 Effect of K2S2O8/MCC mass ratio on grafting yield and grafting efficiency
由图4可以看到,随着引发剂用量的增加,接枝率和接枝效率初期都呈增加的趋势,当引发剂用量增加大一定程度后,接枝率和接枝效率反而减小,在K2S2O8/MCC质量比为1∶2时共聚反应的接枝率和接枝效率达到最大值.这是因为,在引发剂浓度较低的时候,引发剂主要引发纤维素骨架产生自由基,从而使接枝率和接枝效率增加.当进一步增加引发剂浓度的时候,会发生自由基的转移,进而引发丙烯酸单体本身的均聚反应[21],从而减少了单体与纤维素自由基结合的机会,最终导致接枝率和接枝效率的减小.
2.2 接枝后产物的表征
2.2.1 接枝后产物的粒径和电位
在60℃、AA/MCC质量比5∶1、引发时间10min、引发剂/MCC质量比1∶2的条件下,取反应时间分别为 2、4、6、8、10 h,测试接枝后产物的粒径大小及其电位数值,结果如表1所示.
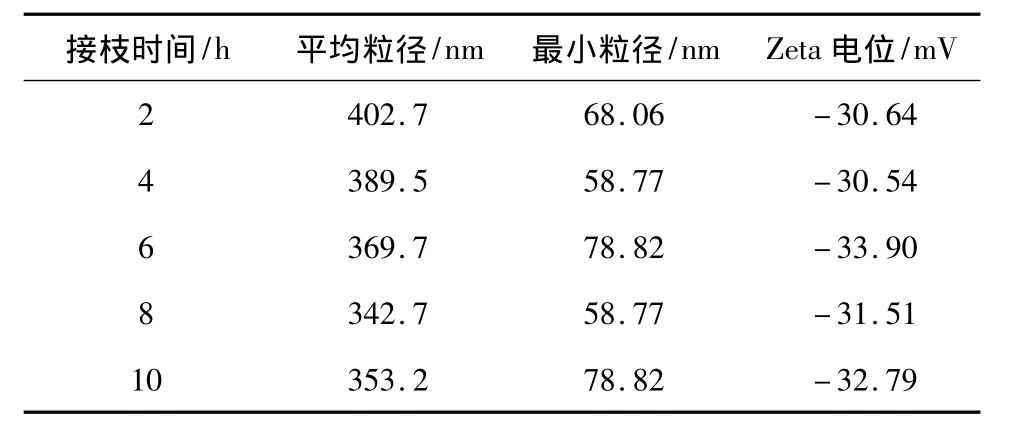
表1 不同接枝时间下产物的粒径及Zeta电位Table 1 Particle size and Zeta potential of products with different grafting time
从表1中可以看到,随着接枝时间的延长,接枝后产物的平均粒径呈减小趋势.这主要是因为,随着接枝时间的延长接枝率增加,更多的纤维素参与到接枝反应中,一方面更多的纤维素分子内和分子间氢键遭到破坏,使得其结晶区减少,另一方面,丙烯酸电离出的羟基增加了颗粒的电荷,所以得到的再生纤维素的粒径趋于减小,接枝后的电位数值呈增加趋势,这说明接枝率的增加提高了接枝后纤维素溶胶的稳定性.
2.2.2 接枝前后及直接溶解再生后的MCC结构
图5示出了MCC、直接溶解再生后以及接枝后的MCC的红外图谱.从图5中可以看到,MCC和直接溶解再生的MCC具有相近的官能团图谱,这说明直接溶解再生后的MCC也是类纤维素物质,ZnCl2水溶液对微晶纤维素是直接溶解而没有发生衍生化反应.与MCC的图谱相比,直接溶解再生后的MCC图谱在1453 cm-1处形成了CH2中的C—H振动吸收峰,说明在ZnCl2水溶液溶解过程中纤维素分子间部分氢键被破坏[22].接枝后的 MCC图谱同样和MCC具有相似的官能团,同时看到接枝后的纤维素在1729 cm-1处有吸收峰,资料说明在1730 cm-1的红外吸收峰是C═O吸收峰,这表明,接枝后的产物中有C═O基团的存在,实验产物接枝上了丙烯酸.
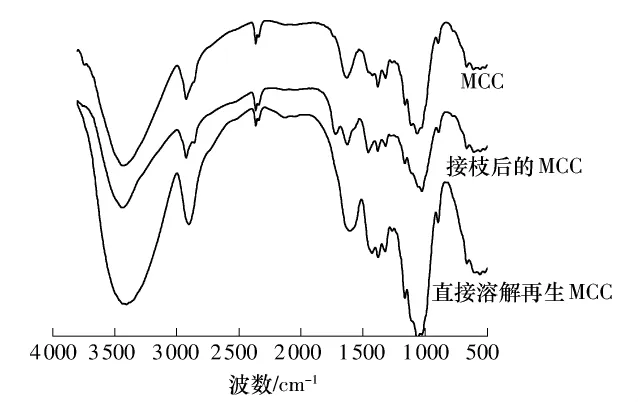
图5 MCC、接枝后的 MCC和直接溶解再生 MCC的FT-IR图谱Fig.5 FT-IR spectra of MCC、grafted MCC and regenerated MCC
2.2.3 接枝前后及直接溶解再生的MCC结晶性能
图6为微晶纤维素接枝前后以及溶解再生后的X射线衍射图谱,直接溶解再生MCC发生了明显的晶型变化,这主要是因为ZnCl2水溶液溶解后直接再生的纤维素分子间和分子内的氢键被破坏.接枝后的MCC与原MCC基本相同,都是具有部分结晶的高分子化合物,但是接枝后的MCC的衍射峰明显减小.这主要是因为,在均相条件下单体能够充分地与溶解后的MCC反应,接枝再生后的纤维素重新形成晶区和非晶区,其中非结晶区包括非结晶的纤维素和非结晶的丙烯酸,同时在与单体反应的时候破坏了纤维素的晶区,这两方面共同导致接枝丙烯酸后的纤维素结晶度减小.
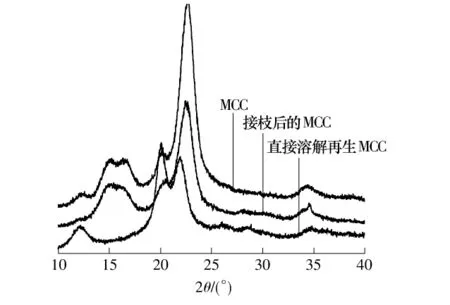
图6 MCC、接枝后的MCC和直接溶解再生MCC的XRD图谱Fig.6 XRD spectra of MCC、grafted MCC and regenerated MCC
2.2.4 接枝前后及直接溶解再生的MCC热性能
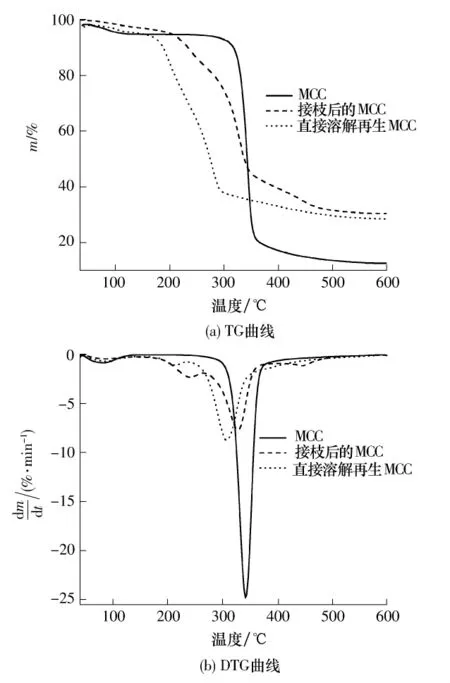
图7 MCC、接枝后的MCC和直接溶解再生MCC的TG和DTG曲线Fig.7 TG and DTG curves of MCC、grafted MCC and regenerated MCC
图7示出了MCC、接枝后的MCC和直接溶解再生MCC的热重分析(TG)和微分热重分析(DTG)曲线.从图7中可以看到,MCC初始分解温度为296.3℃,在340.8℃达到最大失重速率.接枝后的MCC初始分解温度为193.9℃,在326.4℃时达到最大失重速率.ZnCl2水溶液溶解后直接再生的MCC初始分解温度为182.5℃,在293.1℃时达到最大失重速率.由此可知,接枝后和直接溶解再生的MCC热分解温度都明显降低,热分解后的残余质量增多.这可能是因为:一方面微晶纤维素溶解在ZnCl2水溶液中再生后的纤维素分子间的氢键遭到改变,分子内与分子间的氢键也发生改变,分子颗粒变小,可及性和反应活性增加,导致容易被分解;另一方面接枝后的微晶纤维素增加了丙烯酸的含量,而丙烯酸的氢键强度小于纤维素,容易被分解;这两方面共同导致接枝后纤维素的热分解温度降低.
3 结论
(1)单因素分析表明,当引发剂/MCC质量比为1∶2、引发时间为10 min、接枝共聚时间为8 h,单体与MCC的质量比为5∶1、温度为60℃时接枝率达到最大,为 20.3%.
(2)粒径和电位分析表明,接枝率的提高有利于接枝后纤维素溶胶的稳定性.
(3)接枝后产物的FT-IR在1729cm-1处有C═O伸缩振动吸收峰,表明接枝后的产物中有丙烯酸酯类物质,说明均相接枝反应成功接上了丙烯酸单体.
(4)XRD分析结果表明,接枝后的产物与原纤维素具有相同的晶型结构,但是结晶度降低了.热重分析表明,接枝后产物的热分解温度降低.
[1] 高洁,汤烈贵.纤维素科学[M].北京:科学出版社,1996:64-79.
[2] Debashish Roy,Mona Semsarilar,James T Guthrie,et al.Cellulose modification by polymer grafting:a review [J].Chemical Society Reviews,2009,38(5):2046-2064.
[3] 叶代勇,黄洪,付和青,等.纤维素化学研究进展[J].化工学报,2006,57(8):1782-1791.Ye Dai-yong,Huang Hong,Fu He-qing,et al.Advances in cellulose chemistry[J].Journal of Chemical Industry and Engineering,2006,57(8):1782-1791.
[4] 叶代勇,周刘佳.纳米纤维素晶须用作水性聚氨酯的增稠流变剂[J].华南理工大学学报:自然科学版,2010,38(9):63-67.Ye Dai-yong,Zhou Liu-jia.Nanocellulose whiskers as thickening rheological agent for waterborne polyurethane dispersion[J].Journal of South China University of Technology:Natural Science Edition,2010,38(9):63-67.
[5] Schurz J.A bright future for cellulose [J].Progress in Polymer Science,1999,24(4):481-483.
[6] Nevell T P,Zeronian S H.Cellulose chemistry and its application[M].New York:Wiley and Sons,1985:17-51.
[7] 杨芳,黎钢,宋晓峰,等.改性纤维素的发展现状及展望 [J].天津化工,2004,18(5):22-24.Yang Fang,Li Gang,Song Xiao-feng,et al.Status and prospects of modified cellulose[J].Tianjin Chemical Industry,2004,18(5):22-24.
[8] 石红锦,孙晓琳.纤维素接枝丙烯酸类高吸水性树脂的研究 [J].橡塑技术与装备,2009,33(9):28-32.Shi Hong-mian,Sun Xiao-lin.Study of cellulose graft propylene acids with high hygroscopicity resin [J].China Rubber/Plastics Technology and Equipment,2009,33(9):28-32.
[9] Stefan Nilsson,Lars-Olof Sundelof,Bedrich Porch.On the characterization principles of some technically important water soluble non-ionic cellulose derivatives[J].Carbohydrate Polymers,1995,28(11):265-275.
[10] Shigeo N,Masato A.Preparation of hydrazinodexy cellulose and carboxyalkyl hydraxinodeox celluloses and their adsorption behavior toward heavy metal ions[J].Journal of Polymer Science Part A:Polymer Chemistry,1997,35(16):3359-3363.
[11] 邢晓东,王晓工.季铵盐型抗菌纤维素纤维的辐射接枝聚合[J].化工进展,2009,28(1):117-120.Xing Xiao-dong,Wang Xiao-gong.Antibacterial cellulose fiber grafted with quaternary ammonium salts by irradiation grafting[J].Chemical Industry and Engineering Progress,2009,28(1):117-120.
[12] 周刘佳,叶代勇.丙烯酸单体接枝纳米纤维素晶须[J].精细化工,2010,27(7):720-725.Zhou Liu-jia,Ye Dai-yong.Nanocellulose whiskers grafted with acrylic monomers[J].Fine Chemicals,2010,27(7):720-725.
[13] 熊犍,叶君,赵星飞.纤维素在ZnCl2水溶液中的溶解性能及再生结构[J].华南理工大学学报:自然科学版,2010,38(2):23-27.Xiong Jian,Ye Jun,Zhao Xing-fei.Solubility of cellulose in ZnCl2aqueous solution and structure of regenerated cellulose[J].Journal of South China University of Technology:Natural Science Edition,2010,38(2):23-27.
[14] 林春香,詹怀宇,刘明华,等.纤维素共聚接枝的研究进展[J].中国造纸学报,2010,25(1):90-95.Lin Chun-xiang,Zhan Huai-yu,Liu Ming-hua,et al.Study progress of graft copolymerization of cellulose[J].Transactions of China Pulp and Paper,2010,25(1):90-95.
[15] Heinze T,Liebert T.Unconventional methods in cellulose functionalization [J].Progress in Polymer Science,2001,26(9):1689-1762.
[16] Wu J,Zhang J,Zhang H,et al.Homogeneous acetylation of cellulose in a new ionic liquid [J].Biomacromolecules,2004,5(2):266-268.
[17] Marson G A,El Seoud O A.A novel,efficient procedure for acylation of cellulose under homogeneous solution conditions [J].Journal of Applied Polymer Science,1999,74(6):1355-1360.
[18] 武进,张昊,张军,等.纤维素在离子液体中的均相乙酰化及其选择 [J].高等学校化学学报,2006,27(3):592-594.Wu Jin,Zhang Hao,Zhang Jun,et al.Homogeneous acetylation and regioselectivity of cellulose in a new ionic liquid [J].Chemical Journal of Chinese Universities,2006,27(3):592-594.
[19] 杨扬,康燕,蔡志楠,等.纤维素接枝反应的研究进展[J].纤维素科学与技术,2009,17(3):53-58.Yang Yang,Kang Yan,Cai Zhi-nan,et al.Progress on graft polymerization of cellulose[J].Journal of Cellulose Science and Technology,2009,17(3):53-58.
[20] Liu Yinghai,Yang Lanying,Shi Zengqian,et al.Graft copolymerization of methyl acrylate onto cellulose initiated by potassium ditelluratoargentate(III)[J].Polymer International,2004,53(10):1561-1566.
[21] 潘祖任.高分子化学[M].北京:化学工业出版社,2007:70-119.
[22] 王犇,曹妍,黄科林,等.蔗渣纤维素在离子液体中的溶解与再生[J].化工学报,2010,61(6):1592-1597.Wang Ben,Cao Yan,Huang Ke-lin,et al.Dissolution and regeneration of sugarcane bagasse cellulose in ionic liquid [J].CIESC Journal,2010,61(6):1592-1597.
