登革Ⅱ型病毒E蛋白Ⅰ、Ⅱ结构域在大肠杆菌中的表达及免疫反应性鉴定*
2012-01-24付宇姣郑学礼
付宇姣,郑学礼
登革病毒(DENV)属于黄病毒科黄病毒属,是最常见的通过节肢动物(伊蚊)传播的病毒性疾病病原体,分布于全球100多个国家,特别是热带和亚热带地区[1]。全球大约有25亿人受登革病毒感染的威胁,每年大约有5 000万人感染登革热,其中大约有210万的严重病例,50万例登革出血热,20 000例死亡病例。登革病毒感染引起的病变范围很广,从自限性疾病到严重危及生命的登革热、登革出血热以及登革休克综合征[2-4]。登革热/登革出血热已成为热带地区最为重要的蚊-传播病毒性疾病,是重要的公共卫生问题[5]。
登革病毒是一个正义单链RNA病毒。登革病毒基因组RNA编码3个结构蛋白(C、E、prM/M)和7个非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5),分为4个典型的血清型(DENV1-4)。包膜糖蛋白E是主要的病毒颗粒包膜糖蛋白,以同源三聚体形式存在于成熟病毒颗粒表面。结晶学的研究表明,登革病毒的包膜糖蛋白E与其他黄病毒类似,分为3个结构域(Ⅰ-Ⅲ)[6-9]。在三个结构中,β链形成的二级结构是其主要结构。结构域I位于E蛋白单体中央,E蛋白II区折叠成长的指样结构,E蛋白C端的氨基酸残基构成了结构域Ⅲ。因为在所有成熟具有感染性的黄病毒中E蛋白均是由与病毒融合有关的同源二聚体形成,推断E蛋白的所有结构都可能和病毒与细胞的融合过程有关[10]。其中E蛋白II区中第98~111位氨基酸残基组成的cd环,富含甘氨酸且具有很强的疏水性,序列组成在几乎所有的虫媒黄病毒中高度保守。最近研究发现,cd环可在E蛋白由二聚体向三聚体的转变过程中插入胞膜,参与病毒与宿主细胞膜的融合,被认为是病毒融合靶点,或认为是潜在的病毒融合肽[11-12]。推断第一、第二结构域可能与登革病毒发病机制相关。本研究旨在从大肠杆菌中表达登革II型病毒包膜糖蛋白(E)的第一、二结构域(DI,DII),并通过免疫印迹验证重组蛋白的免疫原性,为后续的功能研究奠定工作基础。
1 材料与方法
1.1 实验材料
1.1.1 病毒株、菌株和质粒 登革Ⅱ型病毒NGC株、大肠杆菌DH5ɑ、表达菌BL21(DE3)、表达载体质粒pET-28a(+)为本实验室保存。
1.1.2 主要试剂、耗材 RT-PCR试剂盒、DNAMarker、限制性内切酶等购自大连宝生物工程有限公司;质粒提取试剂盒和凝胶回收试剂盒购自美国O-mega公司;PVDF膜购自millipore公司;Trizol试剂、His·Tag单抗、增强型HRP-DAB底物显色试剂盒购自英韦创津公司;HRP标记的羊抗小鼠IgG购自武汉博士德生物工程有限公司;登革病毒单抗(D1-11)购自美国Santa Cruz生物技术公司;预染双色蛋白质标准购自美国Bio-Rad公司。
1.1.3 实验动物 实验用1~3日龄昆明乳鼠购自南方医科大学实验动物中心。
1.2 方法
1.2.1 引物的合成 引物用Premier 5.0软件设计引物并由生工生物工程(上海)有限公司合成。RT-PCR扩增E蛋白第一,二结构域(DⅠ,Ⅱ)基因片 段 的 引 物:DV2-E-F:5′-CGTCCATATGATGCGTTGCATAG-3′(下划线部分为NdeⅠ酶切位点 ),DV2-E-R:5′-TCGCCTCGAGTTATCCTTTAGAGC-3′(下划线部分为XhoⅠ酶切位点)。
1.2.2 乳鼠脑内接种病毒传代 取-70℃保存的登革Ⅱ型病毒,加入DMEM培养基稀释作为病毒液。用微量注身器每只30μL颅内接种1~3d龄昆明乳鼠。接种后5~9d期间的发病濒死乳鼠拉颈处死,无菌取脑组织备总RNA的提取。
1.2.3 目的基因的获得 发病乳鼠脑组织的总RNA提取参见Invitrogen公司的Trizol说明书。E蛋白第一、二结构域基因片段的扩增参见TaKa-Ra公司的RT-PCR试剂盒说明书。反应条件为:94℃预变性5min,94℃变性45s,58.1℃退火60 s,72℃延伸120s,30个循环;72℃延伸8min。反应后扩增产物经1%琼脂糖凝胶电泳鉴定,检测扩增片段的长度。
1.2.4 目的基因的克隆及重组表达质粒的构建将目的基因的PCR产物经切胶回收纯化后与经XhoⅠ及NdeⅠ酶切纯化的表达载体pET28a(+),按照TaKaRa公司T4DNA ligase试剂盒说明书连接目的片断与表达载体,连接产物转化DH5α感受态细胞,置37℃培养12~16h挑取单菌落,采取菌落PCR法初筛阳性克隆质粒,提取质粒并进行双酶切鉴定,将阳性克隆质粒送上海英俊生物工程有限公司测序,检查连入的片段有无碱基突变及开放读码框是否正确。测序正确的质粒命名为pET28a-DV2-E-D1&2。
1.2.5 重组质粒转化BL21(DE3)感受态细胞及诱导表达的SDS-PAGE分析 测序正确的pET-28a(+ )-DV2-E-D1&2,pET-28a(+ ),转 化 BL21(DE3)感受态细胞,挑取单菌落于终浓度为50mg/L卡那霉素的LB培养基中,37℃振荡培养至OD600为0.5,取部分菌液作为诱导前对照,剩余菌液加入IPTG至终浓度为1mmol/L,37℃振荡培养3h后收集菌液,沉淀,经12%分离胶的SDS-PAGE分析重组菌的诱导表达。
1.2.6 重组蛋白的可溶性分析及纯化 菌体沉淀重悬于裂解缓冲液中冰浴超声裂解至澄清,裂解菌液离心后,回收上清及沉淀并加入等体积的裂解缓冲液重悬沉淀,分别取等体积的上清与重悬沉淀经12%分离胶的SDS-PAGE分析重组蛋白的可溶性,重组蛋白的纯化步骤参见德国Novagen公司的Ni-NTA His·Bind树脂说明书。
1.2.7 Western blot鉴定重组蛋白诱导前后的重组菌全菌蛋白 重组蛋白经12%SDS-PAGE分离后,半干转印于 PVDF 膜上,0.3%Tween-20,1%BSA封闭1h后,分别加入1∶3 000稀释的His·Tag单抗和1∶500稀释的登革病毒单抗于37℃孵育1.5h,PBST洗膜3次,加入1∶500稀释的HRP标记的羊抗小鼠IgG于37℃孵育1h,PBST充分洗膜后按照增强型HRP-DAB底物显色试剂盒说明书显色。
2 结 果
2.1 以提取的乳鼠总RNA经过RT-PCR扩增得到约900bp的E蛋白第一、二结构域基因片段,见图1。
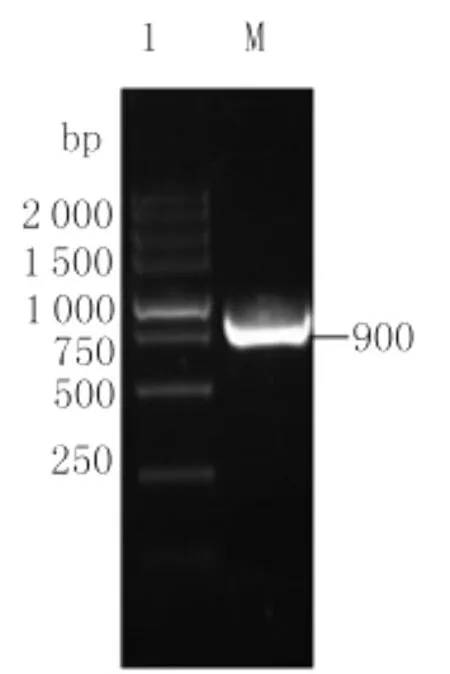
图1 E蛋白第一,二结构域基因片段的PCR扩增Fig.1 PCR amplification of the envelop protein DNA fragmentLane 1:Products of PCR amplification M:DL-5000marker
2.2 pET28a-DV2-E-D1&2载体的构建 重组质粒pET28a-DV2-E-D1&2经XhoⅠ和 NdeⅠ双酶切后,可见约900bp的酶切片段,与预期大小相符,见图2。测序分析表明,插入序列正确且开放读码框正确。
2.3 重组菌诱导表达的SDS-PAGE分析 重组菌BL21(DE3)/pET-28a(+)-DV2-E-D1&2经IPTG诱导后在37kD位置有明显的诱导后表达带,其大小与预测值一致。超声裂解重组菌后,分别取上清与沉淀经12%SDS-PAGE分析,显示重组蛋白主要以包涵体形式存在于沉淀中,见图3。
2.4 Western blot鉴定重组蛋白 Western blot结果显示,重组菌诱导前的全菌蛋白没有与His·Tag单抗反应的条带,而诱导后的全菌蛋白和在相对分子质量为37000的位置均有与His·Tag单抗反应的特异条带,见图4。登革病毒单抗(D1-11)与重组诱导前的全菌蛋白无反应,只在诱导后的全菌蛋白中有特异的条带出现,且与预测的相对分子质量为37000的位置相符合,见图5。上述结果说明,重组蛋白具有良好的免疫反应性。
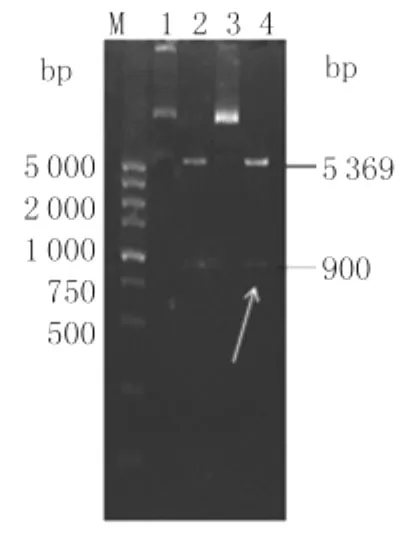
图2 重组质粒pET-28a-DV2-E-D1&2的酶切鉴定Fig.2 Identification of the recombinant plasmid pET-28a(+)-DV2-E-D1&2by restriction enzymes digestionLane 1,3:Recombinant plasmid pET-28a(+)-DV2-E-D1&2;Lane 2,4:Recombinant plasmid pET-28a(+)-DV2-E-D1&2digested by the restriction enzymes XhoⅠ/NdeⅠ;M :DL-5000Marker
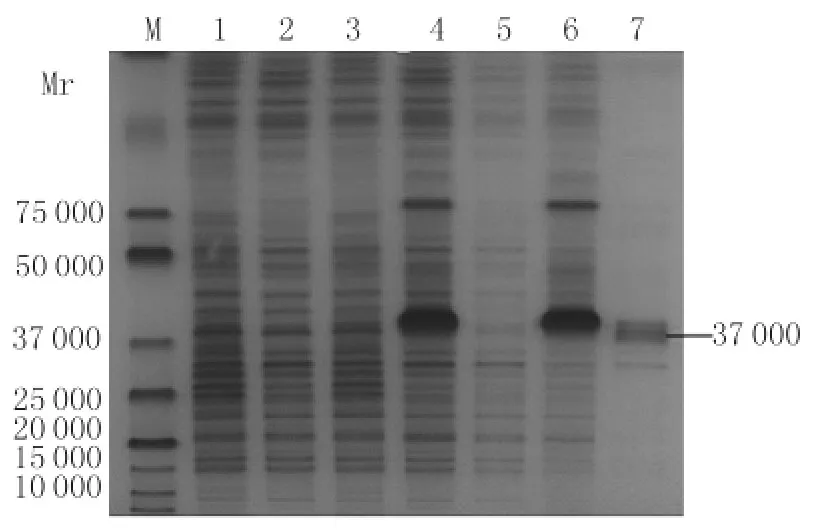
图3 BL21(DE3)/pET-28a(+)-DV2-E-D1&2重组菌表达的 SDS-PAGE 分析Fig.3 SDS-PAGE analysis the expression of BL21(DE3)/pET-28a(+)-DV2-E-D1&2Lane 1:BL21(DE3)/pET-28a(+)before induction;Lane 2:BL21(DE3)/pET-28a(+)after induction;Lane 3:BL21(DE3)/pET-28a(+)-DV2-E-D1&2 before induction;Lane 4:BL21(DE3)/pET-28a(+)-DV2-E-D1&2 after induction;Lane 5:Supernatant of BL21(DE3)/pET-28a(+)-DV2-E-D1&2after sonication;Lane 6:Pellet of BL21(DE3)/pET-28a(+)-DV2-E-D1&2after sonication;Lane 7:Purification of the recombinant protein DV2-E-D1&2with Ni-NTAHis·Bind Resin;M:Protein marker

图4 His·tag单克隆抗体鉴定重组DENV-2-E-D1&2蛋白Fig.4 Western Blot identification of recombinant protein with His·Tag McAbLane 1:BL21(DE3)/pET-28a(+)-DV2-E-D1&2 after induction;Lane 2:BL21(DE3)/pET-28a(+)-DV2-E-D1&2 before induction;M:Prestained Protein marker

图5 Dengue Virus(D1-11)的单克隆抗体鉴定重组DENV-2-E-D1&2蛋白Fig.5 Western blot identification of recombinant protein with DENV(I-IV)McAbLane 1:BL21(DE3)/pET-28a(+)-DV2-E-D1&2 after induction;Lane 2:BL21(DE3)/pET-28a(+)-DV2-E-D1&2 before induction;M:Prestained Protein marker
3 讨 论
登革病毒包膜蛋白E是由494~501个氨基酸残基组成、分子质量约为55~60kDa的糖蛋白。E蛋白可形成3个不同的结构域,即呈β桶状的I区,参与二聚体形成的II区和具有免疫球蛋白样结构的III区。硫酸乙酰肝素(HS)是广泛存在于细胞表面的一类由二糖重复单位组成的多糖,表面具有大量负电荷,具有包括介导病原体吸附等在内的多种生物学功能。研究表明,登革2型病毒中含高度保守的碱性氨基酸Lys89,Lys122,Lys123,其中I区和II区中带有大量的正电荷Arg和Lys可能有助于病毒与硫酸乙酰肝素结合。研究也发现,将细胞表面的硫酸乙酰肝素脱硫或经酶消化去除后,登革病毒和黄热病毒与细胞的结合能力显著降低[13]。推断第一、第二结构域可能与登革病毒发病机制相关。
本研究中重组表达的蛋白经SDS-PAGE分析以包涵体的形式存在。分析其形成原因有以下几方面:蛋白表达量过高;重组蛋白含巯基酸多;重组蛋白所处发酵温度高或胞内pH接近蛋白的等电点,这些因素均可导致降低蛋白的溶解度,形成包涵体。
本研究成功地在大肠杆菌中表达登革II型病毒包膜糖蛋白(E)的第一、二结构域(DI,DII),对其进行免疫反应性鉴定,鉴定结果表明其具有良好的免疫反应性。为进一步研究第一、二结构域与宿主细胞的相互作用和功能及其致病性奠定了基础。
[1]Henchal EA,Putnak JR.The dengue viruses[J].Clin Microbiol Rev,1990,3(4):376-96.
[2]Guzman MG,Halstead SB,Artsob H,et al.Dengue a continuing global threat[J].Nat Rev Microbiol,2010,8(12Suppl):7-16.
[3]Whitehorn J,Farrar J.Dengue[J].Br Med Bull,2010,95(1):161-73.
[4]Tapia-CR,Méndez-Galván JF,Gallardo-Rincón H.The growing burden of dengue in Latin America[J].Clin Virol,2009,46(2 Suppl):3-6.
[5]雷子庆,苏裕心,郑学礼.登革域型病毒E蛋白第三结构域在大肠杆菌中的表达、纯化及免疫反应性鉴定[J].南方医科大学学报,2010,30(7):1496-1499.
[6]Zhang W,Chipman PR,Corver J,et al.Visualization of membrane protein domains by cryo-electron microscopyof dengue virus[J].Nat Struct Biol,2003,10(11):907–912.
[7]Kuhn RJ,ZhangW,Rossmann MG,et al.Structure of dengue virus:implications for flavivirus organization,maturation,and fusion[J].Cell,2002,108(5):717-725.
[8]Modis Y,Ogata S,Clements D,et al.Structure of the dengue virus envelope protein after membrane fusion[J].Nature 2004,427(6972):313-319.
[9]Megret F,Hugnot JP,Falconar A,et al.Use of recombinant fusion proteins and monoclonal antibodies to define linear and discontinuous antigenic sites on the dengue virus envelope glycoprotein[J].Virology,1992,187:480-491.
[10]Kuhn RJ,Zhang W,Rossman MG,et al.Structure of dengue virus:implications for flavivirus organization,maturation,and fusion[J].Cell,2002,108(5):717-725.
[11]Zheng A,Umashankar M,Kielian M.In vitro and in Vivo studies identify important features of dengue virus pr-E protein interactions[J].PLoS Pathog,2010,6(10):e1001157.
[12]Lin SR,Zou G,Hsieh SC.The helical domains of the stem region of dengue virus envelope protein are involved in both virus assembly and entry [J].Journal 0fVirology,2011,85(10):5159-5171.
[13]秦鄂德,秦成峰,姜涛.登革病毒与登革病毒病[M].北京:科学出版社,2008:28-34.
