狂犬病毒pVax-G/N融合基因的克隆及其在酿酒酵母中的表达*
2012-01-24王小英马文丽李孟森
王 政,王小英,马文丽,李孟森
狂犬病是一种严重威胁人类和动物健康的重要人兽共患病,至今无有效地治疗药物,一旦发病即引起100%的死亡。近年来,我国狂犬病疫情一直呈上升趋势,病死数据居我国37种法定报告传染病之首[1]。
为了预防狂犬病并研制高效安全的狂犬病疫苗,人们不断地进行研究和探索,Tao L等利用反向遗传学把两组狂犬病毒糖蛋白(G)基因通过鸡胚传代得到灭活的狂犬病毒疫苗[2]。口服疫苗是研究的新领域,即利用消化道吸收含有治疗性的核酸,经消化道到达特定部位分泌出治疗性蛋白,发挥治疗功能,从而达到防治狂犬病的作用。
目前研究狂犬病毒某个蛋白的表达情况较多是大肠杆菌表达系统。大肠杆菌表达系统虽然表达量高,但具有致病性,不适合用于药物研发。相比之下,酿酒酵母作为真核表达系统却具备有安全无致病性,易遗传操作、有良好的蛋白分泌能力、有类似高等生物的蛋白质翻译后的修饰功能、培养条件简单、易进行高密度发酵等优点[3],成为一种良好的药物蛋白表达载体。此外,酿酒酵母特殊的细胞壁结构,对消化道的胃酸有较强的抵抗作用,是一种天然的生物胶囊,能为生物大分子提供良好的保护,同时酿酒酵母细胞壁所含有的成分可调节肠胃功能,增强机体免疫能力,是一种良好的保健食品来源[4]。由此可见酿酒酵母完全有可能作为外源物质的天然缓释包裹物,在消化道给药过程中起长效作用。
本研究以酿酒酵母为微生物输送载体,以狂犬病毒核蛋白(N)和糖蛋白(G)为实验对象,通过连接核蛋白和糖蛋白,并构建分泌型表达载体,表达出具有免疫原性的蛋白,为今后的口服疫苗提供依据。
1 材料与方法
1.1 实验材料 SAD-B19弱毒株编码GP和NP的基因(质粒pVax-G)由军事医学科学院军事兽医研究所扈荣良博士惠赠;酿酒酵母INVScI、酵母表达载体pYes2由南方基因研究所惠赠;E.coli的DH5α由本实验室保存。ExTaq酶pMD-18T载体和EcoRI、PstI、XbaI、NheI等限制性核酸内切酶购自Takara(大连)公司。T4DNA连接酶购自Promege公司,DNA胶回收试剂盒、质粒提取试剂盒、DNA Ladder购于北京天根生化科技有限公司。狂犬病病毒的小鼠单克隆抗体(1C5)购自Abcam;羊抗鼠IgG购自Bioworld。
1.2 实验方法
1.2.1 pMD18-T/G/N融合基因克隆质粒的构建
1.2.1.1 PCR 扩增 G/N 基因片段:根据 Sambrook[5]等试验设计及操作方法,确定PCR扩增反应体系及条件。PCR法从质粒pVax-G中扩增狂犬病病毒G基因。上游引物为5′-CCGGAATTCATGGTTCCTCAGGCTCTC-3′(下划线部分为EcoRI酶 切 位 点 ),下 游 引 物5′-GGCCTGCAGCAGTCTGGTCTCACCCCCACTCTTG-3′(下划线部分为PstI酶切位点),反应体积50μL,30个循环:94℃90s,58℃90s,72℃120s。目的片段以EcoRI、PstI酶切回收纯化备用。PCR法从质粒pVax-G中扩增狂犬病病毒N基因。上游引物为5′-GCCCTGCAGGATGCCGACAAGATTGTATTC-3′(下划线部分为PstI酶切位点),下游引物5′-TGCTCTAGATTATGAGTCACTCGAATA TGTCT-3′(下划线部分为XbaI酶切位点),反应体积50μL,30个循环:94℃90s,58℃90s,72℃120s。目的片段以PstI、XbaI酶切回收纯化备用。
1.2.1.2 线 性 pMD18-T 的 制 备 克 隆 质 粒pMD18-T以EcoRI和XbaI酶切,回收线性载体片段。
1.2.1.3 融合基因的制备 将PCR扩增的G、N基因酶切后的回收产物,在T4DNA连接酶的作用下融合,回收融合片段。
1.2.1.4 融合片段与克隆质粒pMD18-T 连接将融合片段与pMD18-T载体在16℃条件下过夜连接,获得克隆质粒。反应体积10μL(融合片段7μL,pMD18-T 1μL,T4DNA 连接酶1μL,10×T4DNA连接酶缓冲液1μL)常规CaCl2法转化大肠杆菌DH5α感受态,以氨苄抗性筛选,菌落酶切鉴定重组阳性克隆,将鉴定正确的克隆各送3个至北京天根公司测序,抽提构建成功的克隆质粒。
1.2.2 融合基因分泌表达载体的构建
1.2.2.1 融合基因片段的获取 取克隆成功的pMT-G/N融合基因克隆质粒,以EcoRI和XbaI酶切,回收G/N融合基因。
1.2.2.2 线性分泌表达载体的制备 表达载体pYes2以EcoRI和XbaI酶切,回收线性表达载体。将融合基因片段与分泌表达载体pYes2 16℃连接过夜。获得成功连接融合基因的分泌表达质粒。反应体积10μL(融合片段7μL,pYes2 1μL,T4DNA连接酶1μL,10×T4DNA连接酶缓冲液1μL),鉴定方法如1.2.1.4;抽提构建成功的携带融合基因的分泌表达质粒pYes2-G/N。
1.2.3 pYes2-pVax-G/N 质粒转化酿酒酵母 常规醋酸锂法转化酿酒酵母INVSc1,尿嘧啶营养缺陷型(SC-U)培养基初次筛选,提取经初次筛选的阳性克隆酵母质粒,PCR鉴定为阳性重组酵母。
1.2.4 pYes2-pVax-G/N 在酿酒酵母中的诱导表达 将酵母阳性克隆转接至15mL液体SC-U培养基(含2%的葡糖糖)中,30℃过夜培养,测OD600=2.2,取10mL培养物4℃3 000r/m离心5min,去上清,加1mL SC诱导培养基(含2%半乳糖)重悬菌体,并转移至50mL诱导培养基中,使最终OD600约为0.4,30℃诱导培养12h,取10mL菌液,高速离心,收集上清,至上清中加入5倍体积预冷丙酮,静置1h,4℃离心,去上清,往沉淀中加入7mol/L盐酸胍0.5mL复性30min,分装,-80℃保存备用于SDS-PAGE电泳。
1.2.5 Western-blot分析 以12%分离胶进行SDS-PAGE电泳,以诱导前菌株为阴性对照,狂犬病病毒的小鼠单克隆抗体(1C5)1∶2 000和辣根过氧化物酶山羊抗小鼠IgG 1∶5 000进行 Westernblot分析。
2 结 果
2.1 G和N基因的PCR扩增结果从质粒pVax-G中PCR扩增出G、N基因,1%琼脂糖凝胶电泳,以DGL500为Marker,得到位于1 000~2 000之间的G、N两条目的带,G基因的片段为1 518bp,N基因片段为1 353bp,见图1。
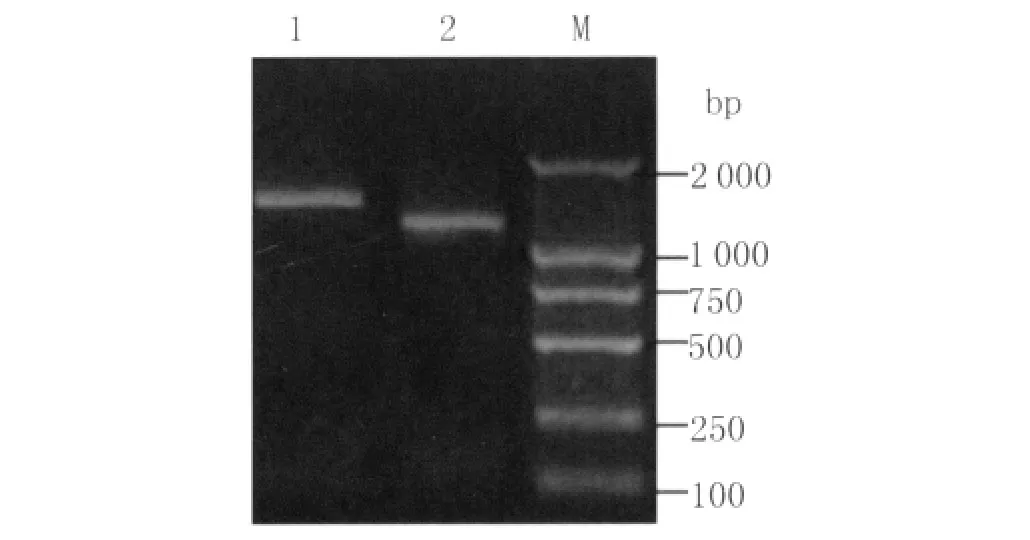
图1 G、N基因的PCR结果1:G基因;2:N基因;M:DNA markerFig.1 PCR detection on the existence of G and N genes1:G gene;2:N gene;M:DNA Marker.
2.2 G和N基因的融合 将G、N基因PCR扩增产物用PstI内切酶酶切4h,DNA胶回收后,相同浓度等量加入到反应体系中,以T4DNA连接酶16℃连接过夜,以1kb为Marker,连接产物电泳,在2 928bp处存在一条预期的条带,如图2。
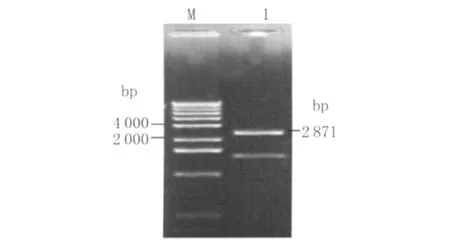
图2 PCR检测狂犬病病毒G/N融合基因酶切电泳图Fig.2 Result of PCR production of G/N gene digested by endoenzymeM:DNA Marker;1:G/N fused gene.
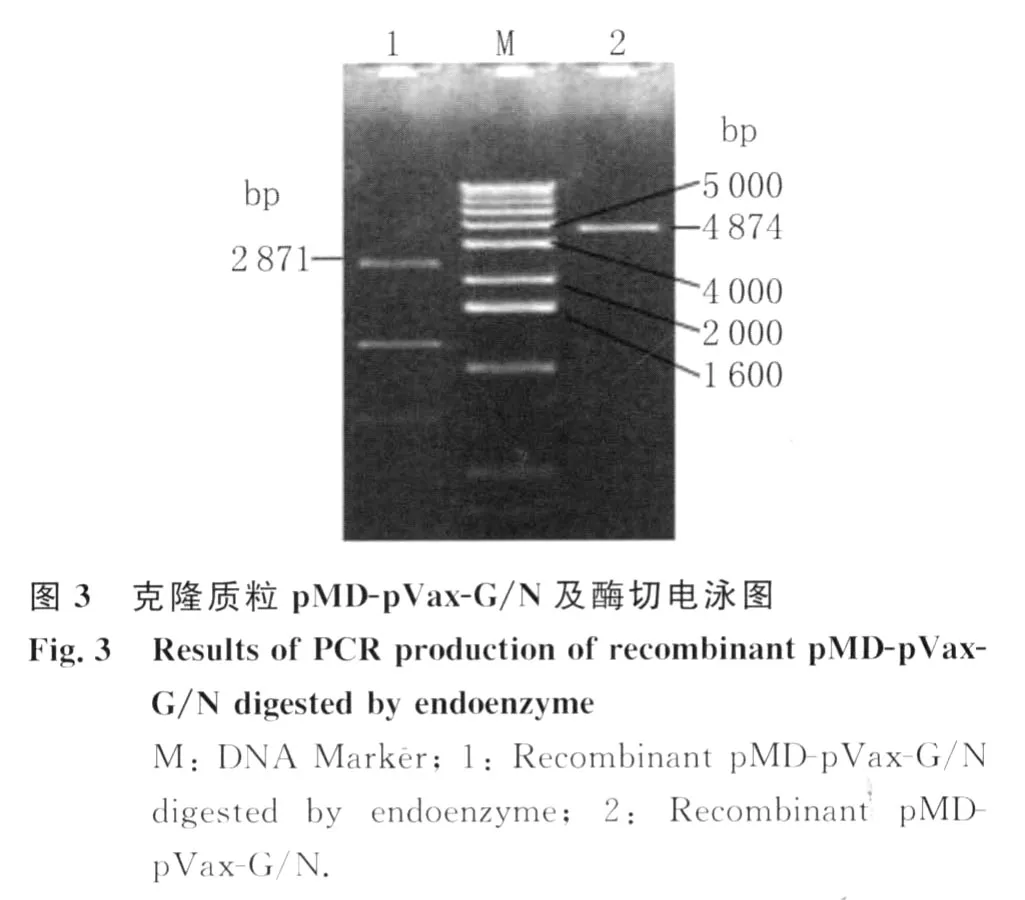
2.3 融合片段与与克隆质粒pMD18-T连接 将融合片段与pMD18-T载体在16℃条件下过夜连接,获得克隆质粒,并转化感受态细胞,挑取3个菌落以内切酶EcoRI、XbaI和NheI酶切鉴定,并送至测序公司进行测序。酶切如图3。
2.4 pYes2-pVax-G/N 质粒载体的鉴定 pYes2与pVax-G/N融合基因连接转化大肠杆菌,以扩增G/N融合基因的引物进行PCR鉴定,电泳结果中出现2871bp的特异性条带即为目的基因,对应菌落即为阳性克隆,如图4,阳性克隆提取质粒测序结果与理论值完全相符。
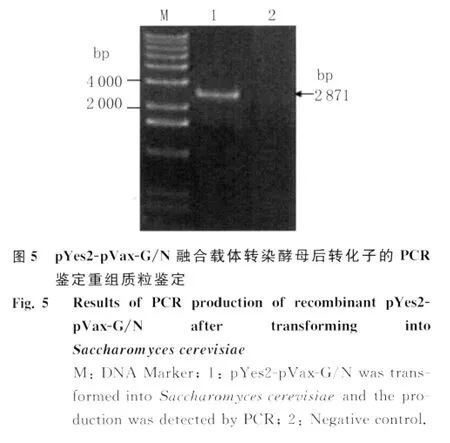
2.5 酵母阳性克隆子的鉴定 pYes2-pVax-G/N质粒转化酿酒酵母,SC-U培养基筛选出阳性克隆,提取该阳性酵母克隆质粒,PCR进一步鉴定,如图5。
2.6 pYes2-pVax-G/N 质粒诱导的表达结果 收集上清液,经变性复性处理后,SDS-PAGE鉴定重组酿酒酵母菌株的诱导表达,结果在约110kD处有一条与对照不同的条带出现,但该条带是否为目标蛋白,能否与狂犬病病毒单克隆抗体发生特异性反应还需通过 Western-blot进一步鉴定确定,如图6A;Western-blot分析结果显示,经诱导后表达的上清液约在110kD处有一特异性条带,据此可判定狂犬病毒pYes2-pVax-G/N融合基因在酿酒酵母中获得分泌表达,且目标蛋白具有良好的抗原性,如图6B。

3 讨 论
据2008年世界卫生组织统计全球约有五万五千人死于狂犬病[6],而全球约有一千万狂犬病疫苗用于暴露后治疗,其中约48%的疫苗仍然来源于具有潜在危险的脑组织减毒疫苗。
狂犬病病毒(Rabies virus,Rv)属弹状病毒科狂犬病病毒属,其基因组为12kb的单股负链RNA,编码5种主要结构蛋白,即核蛋白(N)、转录酶蛋白(L)、基质蛋白(M)、磷酸化蛋白(NS)和糖蛋白(G)[7]。其中糖蛋白(GP)和核蛋白(NP)是Rv可诱导机体产生保护性免疫反应的两种主要蛋白质。GP可刺激机体产生相应的中和抗体[8],NP与抗狂犬病病毒的免疫识别和记忆有关,NP可以激活B细胞的抗体反应,诱发补体结合抗体,促进中和抗体产生,抑制病毒在细胞间的传播和在细胞内繁殖。据研究发现,NP与抗狂犬病病毒的免疫识别和记忆有关。在以GP为目的抗原进行抗狂犬病的研究中,发现GP是Rv当中重要的一种抗原蛋白,具有6个~7个抗原表位,其中Ⅱ和III是重要的抗原表位[9]Tomar NR等[10]为了研究表位疫苗预防狂犬病,利用巨细胞病毒表达狂犬病毒GP,并利用免疫印迹和间接免疫荧光技术等方法预测其抗原表位。
在研究狂犬病疫苗领域,表达抗原性蛋白最初用大肠杆菌表达系统。该表达系统虽然表达产量高,但原核表达系统不具有修饰功能,且表达产物具有致病性,所以不适合用于药物研发。后来Osorio等和Henderson等分别在痘苗病毒和腺病毒中表达抗原性蛋白,虽然能够诱发机体产生中和抗体,但是这两种病毒作为载体的同时存在潜在的致病性[11]。相比之下,酿酒酵母作为真核表达系统却具备有安全无致病性,易遗传操作、有良好的蛋白分泌能力、有类似高等生物的蛋白质翻译后的修饰功能、培养条件简单、易进行高密度发酵等优点[3],成为一种良好的药物蛋白表达载体。同时作为口服疫苗的输送载体,酿酒酵母细胞具有独特的优点,其细胞外层为甘露聚糖,中间层为蛋白质分子,内层为葡聚糖,因此该酵母对消化道的胃酸作用具有较强的抵抗作用,是一种天然的生物胶囊。它具备其他微生物所不具有的优势[12],如增强免疫能力,具有抗辐射、抗肿瘤、抗炎和调节胃肠功能的作用。由此可见,酿酒酵母是一种很好的药物表达载体。
糖蛋白(GP)和核蛋白(NP)是Rv可诱导机体产生保护性免疫反应的两种主要蛋白质。为了研制高效、安全的狂犬病疫苗,本研究通过基因工程方法将编码GP和NP的狂犬病病毒基因进行融合,构建狂犬病糖/核蛋白融合基因真核表达载体,利用酿酒酵母表达目的蛋白,最后通过SDS-PAGE和Western-blot验证表达结果,发现诱导先后的蛋白表达有一条明显差异条带,约110kD。由此可知,已经成功构建狂犬病病毒糖蛋白及核蛋白的融合表达体系,并成功分泌出目的蛋白,且具有良好的抗原性。
本实验采用酿酒酵母表达狂犬病病毒蛋白,在结构和功能上更接近天然蛋白,具有较好的抗原性,另外利用酿酒酵母作为载体不会对人和动物产生危害,生产和使用过程安全,可以大批量的生产抗原。通过上述的研究,为后续的口服狂犬病疫苗的制备和应用提供充足的理论依据和研究条件。
[1]Nigg AJ,Walker PL.Overview,prevention,and treatment of rabies[J].Pharmacotherapy,2009,29(10):1182-1195.DOI:10.1592/phco.29.10.1182
[2]Tao L,Ge J.Generation of a recombinant rabies Flury LEP virus carrying an additional G gene creates an improved seed virus for inactivated vaccine production[J].Virol J,2011,8(1):454.DOI:10.1186/1743-422X-8-454
[3]Nielsen J,Jewett MC.Impact of systems biology on metabolic engineering ofSaccharomycescerevisiae[J].FEMS Yeast Res,2008,8(1):122-131.DOI:10.1111/j.1567-1364.2007.00302.x
[4]Steidler L,Hans W,Schotte L,et al.Treatment of murine colitis byLactococcuslactissecreting Interleukin-10[J].Science,2000,289(5483):1311-1312.DOI:10.1126/science.289.5483.1352
[5]Sambrook J,Russell DW.Molecular cloning:A laboratory manual[M].2001,New York:Cold Spring Harbor Laboratory Press,607-610.
[6]Manning SE,Rupprecht CE,Fishbein D,et al.Human rabies prevention-United States,2008:recommendation of the Advisory Committee on Immunization Practices[J].MMWR Recomm Rep,2008,57(RR-3):1-28.
[7]Yuan HJ,Hu RL,Zhang SF,et al.Cloning,sequencing and expression of N gene of rabies virus subclione strain SRV9[J].Chin J Prev Vet Med,2003,25(1):5-8.DOI:cnki:ISSN:1008-0589.0.2003-01-001.(in Chinese).袁慧君,扈荣良.狂犬病病毒SRV9克隆株核蛋白基因的克隆表达与特性分析[J]。中国预防兽医学报,2003,25(1):5-8.
[8]Faber M,Faber ML,Papaneri A,et al.A single amino acid hange in rabies virus glycoprotein increases virus spread and enhances virus pathogenicity[J].J Virol,2005,79(22):14141-14148.DOI:10.1128/JVI.79.22.14141-14148.2005
[9]Houimel M,Dellagi K.Peptide mimotopes of rabies virus glycoprotein with immunogenic activity[J].Vaccine,2009,27(34):4648-4655.DOI:10.1016/j.vaccine.2009.05.055
[10]Tomar NR,Chandra R.Expression of rabies virus glycoprotein gene into eukaryotic system and determination of potential T-cell epitopes[J].Indian J Exp Biol,2011,49(8):584-589.
[11]Henderson H,Jackson F,Bean K,et al.Oral immunization of raccoons and skunks with a canine adenovirus recombinant rabies vaccine[J].Vaccine,2009,27(51):7194-7194.DOI:10.1016/j.vaccine.2009.09.030
[12]Zhao LJ,Song XP,Li FY.Research progress on anti-oxidation ofPolysaccharideand its derivatives[J].J Shanghai Uni Eng Sci,2008,22(1):44-47.DOI:CNKI:SUN:SGCJ.0.2008-01-012(in Chinese)赵琳静,宋小平,黎方雅.多糖及其衍生物抗氧化性质的研究进展[J].上海工程技术大学学报,2008,22(1):44-47.
