致死型约氏疟原虫感染BALB/c小鼠巨噬细胞的作用地位研究*
2012-01-24潘艳艳曹雅明
冯 辉,潘艳艳,李 莹,曹雅明
疟疾是人类最为严重的寄生原虫感染性疾病。2010年世界疟疾报告显示,2009年有2~3亿疟疾临床病例,病死人数高达100万[1]。我国也制定了“十二·五”期间在中国境内消灭疟疾的宏伟计划。因此,研制开发疟疾疫苗和抗疟新药已经成为当今世界亟待解决的重大课题,而疟原虫感染宿主机体应答的免疫学基础研究是其重要前提[2]。
动物模型和人体研究的结果均已表明:固有免疫和适应性免疫共同参与抗疟保护性免疫应答。固有免疫应答有直接抗疟原虫效应,在清除疟原虫感染红细胞(iRBCs)中抗疟天然免疫发挥重要防御作用[3-5]。CD4+T细胞在抵抗红内期疟原虫感染过程中,通过分泌以IFN-γ增加为主的Th1型细胞因子显著遏制原虫的爆发性增殖[6-7]。固有免疫对启动适应性免疫应答尤其是CD4+T细胞和抗体应答是必需的[8]。然而,固有免疫应答过强亦可导致重症疟疾等相关病理损伤[9]。目前,与适应性免疫应答机制研究相比,固有免疫在疟疾急性期感染中的保护性作用尚有待深入研究与阐明。
巨噬细胞是参与固有免疫应答的主要细胞。体内注射氯磷酸二钠脂质体是一种有效消除体内巨噬细胞的方法[10-11]。为此,本研究拟通过建立巨噬细胞消除的鼠疟模型,探讨吞噬细胞在致死型约氏疟原虫(Plasmodiumyoelii17XL,P.yoelii17XL)感染的BALB/c小鼠模型中的作用地位及可能的免疫保护作用机制。
1 材料与方法
1.1 实验动物、疟原虫与主要试剂 6~8w龄,雌性BALB/c小鼠,购自中国科学院上海实验动物中心。P.yoelii17XL,日本爱媛大学分子寄生虫学教研室惠赠。以下单克隆抗体(mAb)均购自美国BD Bioscience:抗-F4/80-FITC mAb(BM8)和FcγIII/II封闭抗体(2.4G2)。
1.2 实验动物感染和吞噬细胞消除模型建立 在感染-2、0d腹腔注射氯磷酸二钠脂质体(clodronate liposomes,300μL/只/次),建立巨噬细胞体内消除模型。对照组小鼠在同时点注射同体积PBS脂质体。小鼠腹腔注射1×106P.yoelii17XL寄生的红细胞(pRBC)。尾静脉采血,制备薄血膜,Giemsa染色,显微镜检计数原虫血症,动态观察生存率。
1.3 脾细胞培养 小鼠感染0d、3d和5d常规无菌摘取脾脏,用10mL含5%热灭活FCS的RPMI1640培养液制成细胞悬液,350×g室温离心10 min。经0.17mol/L NH4Cl裂解红细胞、RPMI1640洗涤2次,以台盼蓝液检查脾细胞活性,确定活细胞超过90%。用含10%FCS的RPMI1640调整脾细胞终浓度至1×107个/mL,24孔培养板(FALCON),每孔加入500μL细胞悬液,一式3孔,培养48h。350×g室温离心10min,收集上清,-80℃保存,待细胞因子测定。
1.4 脾细胞FACs分析 取0.1mL脾细胞悬液,预先加入FcγⅢ/Ⅱ封闭抗体1μg封闭30min。设阴性对照管,每份样品同时用抗-F4/80-FITC进行细胞表面标记,4℃孵育30min。洗涤1次,弃上清,用0.5ml FBS/PBS重悬细胞,待流式细胞仪进行检测。
1.5 细胞获取与分析 利用流式细胞仪(FACSAria II,美国B&D公司)获取细胞,使用前向散射角(FSC)及侧向散射角(SSC)确定淋巴细胞群。以阴性对照为参考,每个样品获取10 000~50 000个细胞。利用FAC expressV3software分析流式结果。
1.6 细胞因子检测 双抗体夹心ELISA法分别对小鼠脾细胞培养上清IFN-γ、IL-10含量进行定量检测,酶标仪(InterMedNJ-2100)测定450nm 处 OD值。绘制标准曲线,计算细胞因子含量(pg/mL)。
1.7 NO水平检测 Griess方法检测NO-2浓度,酶标仪(InterMedNJ-2100)测定550nm 处 OD 值。绘制标准曲线,计算NO含量(μmol/L)。
1.8 统计学分析 应用SPSS 11.5统计学分析软件,Student’sttest比较分析组内和组间均值的显著性差异。P≤0.05为差异显著。
2 结 果
2.1P.yoelii17XL感染BALB/c小鼠巨噬细胞消除和对照组原虫血症和生存率 PBS脂质体对照在感染后2d外周血出现感染红细胞,原虫血症于感染后6d达峰值42.5%。小鼠感染后5d出现死亡,达峰值后小鼠全部死亡。巨噬细胞消除组原虫血症较对照组比较提前出现,于感染后4d达峰值40.8%。巨噬细胞消除组在感染后1d出现死亡,于原虫血症达峰值后,即感染后5d小鼠全部死亡。由此显示,巨噬细胞消除后加速P.yoelii17XL感染BALB/c小鼠的感染进程且明显影响疟疾感染的最终结局。
2.2P.yoelii17XL感染BALB/c小鼠巨噬细胞消除和对照组脾巨噬细胞数量 为评估巨噬细胞消除效果,FACS检测两组小鼠脾巨噬细胞数量。结果显示,与对照组相比,在感染后0d,巨噬细胞消除组脾F4/80+巨噬细胞占脾总细胞数的百分率和细胞绝对值均明显降低(P<0.01)。在感染后3~5 d,巨噬细胞消除组脾F4/80+巨噬细胞百分率和细胞绝对数量一直保持低水平,明显低于对照组(P<0.01)。由此表明,巨噬细胞消除模型建立成功。
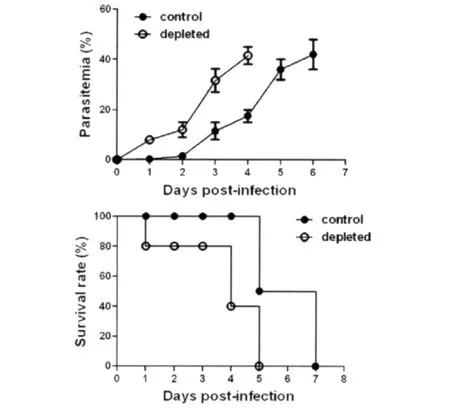
图1 P.yoelii 17XL感染BALB/c小鼠巨噬细胞消除和对照组原虫血症(A)和生存率(B)Fig.1 P.yoelii 17XL infection in BALB/c mice from macrophage depleted group and control groupA:Parasitemia;B:Survival rate of mice.
2.3P.yoelii17XL感染BALB/c小鼠巨噬细胞消除和对照组脾炎症因子水平 我们对参与调控疟疾感染的重要前炎症因子进行检测。ELISA结果显示,与对照组相比,在感染后3~5d,巨噬细胞消除组小鼠脾上清IFN-γ分泌水平明显降低(P<0.01),IL-10分泌水平亦明显降低(P<0.01)。在感染后3~5d,巨噬细胞代表性因子NO在巨噬细胞
消除组明显降低(P<0.01)。
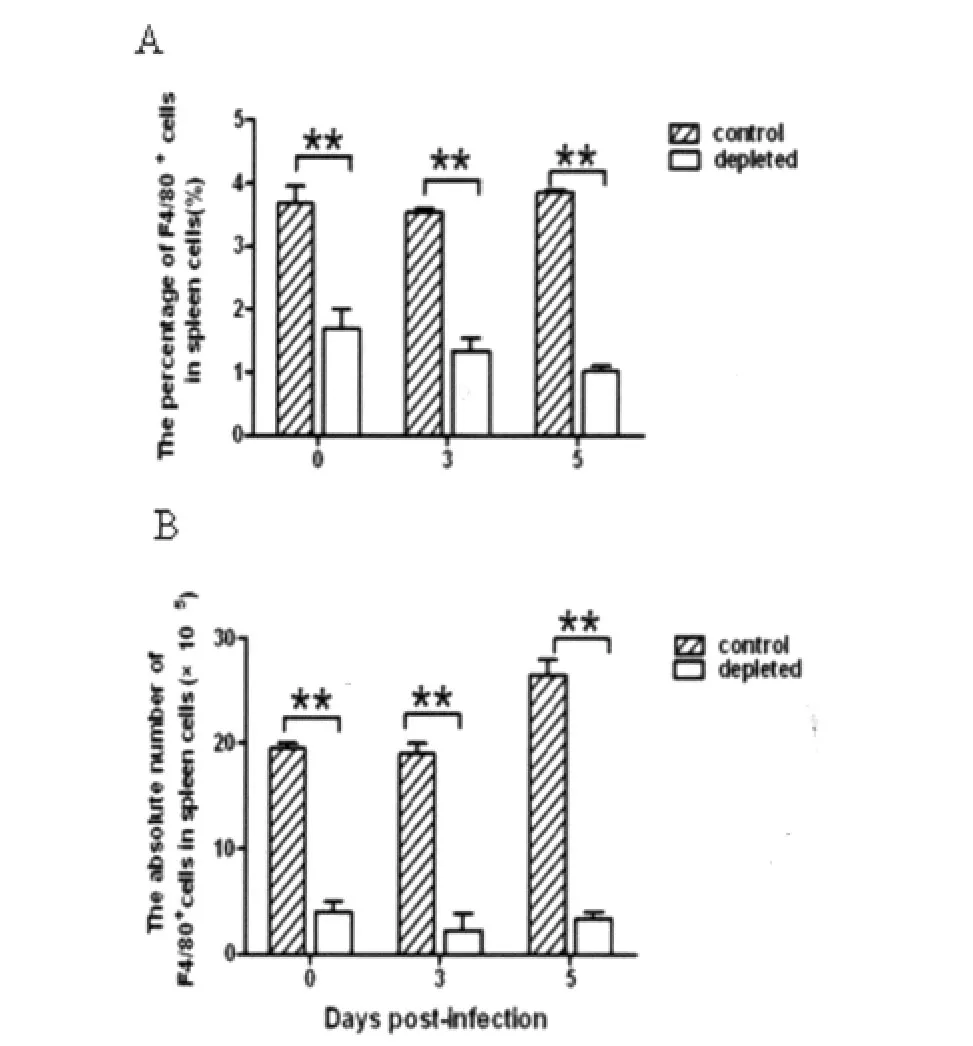
图2 P.yoelii 17XL感染BALB/c小鼠巨噬细胞消除和对照组脾巨噬细胞数量比较A:巨噬细胞占脾细胞总数的百分含量;B:巨噬细胞绝对值。**:P<0.01.Fig.2 Comparison on the number of macrophages in BALB/c infected with P.yoelii 17XL from macrophage depleted group and control groupA:Percentage of macrophages in spleen cells;B:Absolute numbers of macrophages;**:P<0.01.
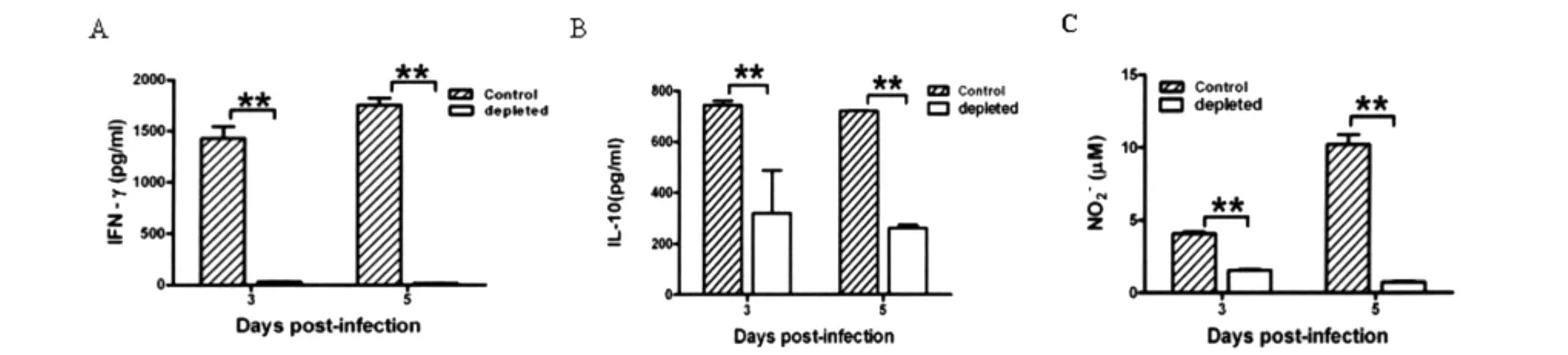
图3 P.yoelii 17XL感染BALB/c小鼠巨噬细胞消除和对照组脾脏炎症因子水平A:IFN-γ水平;B:IL-10水平;C:NO水平;**:P<0.01.Fig.3 The levels of pro-inflammation in BALB/c infected with P.yoelii 17XL from macrophage depleted group and control groupA:IFN-γ;B:IL-10;C:NO;**:P<0.01.
3 讨 论
固有免疫应答参与控制疟疾感染。本研究发现巨噬细胞与疟疾感染结局密切相关。巨噬细胞消除后,以IFN-γ为代表的前炎症应答水平明显降低,巨噬细胞特征性因子NO水平明显降低,抗炎症细胞因子IL-10亦明显降低,原虫血症峰值提前出现。由此显示,巨噬细胞消除加速疟疾感染进程且加重疾病严重性,进而证实巨噬细胞对控制红内期感染发挥重要免疫保护作用。
血液中的单核细胞和组织中的巨噬细胞对控制原虫血症发挥重要作用,清除iRBCs与单核-巨噬细胞功能活性有关[12]。研究证实,恶性疟患者外周血循环中的单核细胞在体外具有很强的抗体依赖细胞抑制活性(ADCI)。疟原虫感染可以诱导单核-巨噬细胞以抗体非依赖方式直接削弱原虫负荷,同时通过启动和调控适应性免疫应答,以抗体依赖的调理作用和ADCI方式清除iRBCs[13]。本研究利用巨噬细胞消除模型进而感染致死型约氏疟原虫,结果显示,感染后1d小鼠即出现死亡,且原虫血症增殖速度和幅度明显高于对照组,由此进一步证实在疟原虫感染早期巨噬细胞具有重要的控制原虫血症作用。
最新研究证实,分别感染P.yoelii17XL或P.yoelii17XNL的BALB/c小鼠腹腔巨噬细胞裂解pRBC能力增强,这与巨噬细胞表面TLR2和胞内转录因子 MyD88,IRAK-1和TRAF-6表达增高有关[14]。与无法抵抗P.yoelii17XL感染相比,BALB/c小鼠更能控制P.yoelii17XNL感染与巨噬细胞TLR高表达维持更长时间有关[14]。我们近期研究证实,牛膝多糖作为免疫调节剂可上调巨噬细胞数量,增强Th1型免疫应答,进而抵抗P.yoelii17XL感染[15]。本研究结果显示,巨噬细胞消除组Th1型细胞因子IFN-γ分泌水平明显受到影响,不能有效建立CD4+Th1型免疫应答。由此进一步强化固有免疫应答对启动适应性免疫应答的重要性。
综上,固有免疫在抗疟免疫防御中的作用越来越受到关注。固有免疫重要的执行细胞—巨噬细胞在抗红内期疟疾感染中的作用不容忽视。本研究通过鼠疟模型证实巨噬细胞对控制红内期感染具有重要作用。如何调控巨噬细胞的生物学活性,进而有效地干预和控制红内期感染,有待我们进一步深入探讨。
[1]WHO:World Malaria Report[R].2010.
[2]Pierce SK,Miller LH.World Malaria Day 2009:what malaria knows about the immune system that immunologists still do not[J].J Immunol,2009,182(9):5171-5177.DOI:10.4049/jimmunol.0804153
[3]Smith TG,Ayi K,Serghides L,et al.Innate immunity to malaria caused byPlasmodiumfalciparum[J].Clin Invest Med,2002,25(6):262-272.
[4]Molineaux L,Trauble M,Collins WE,et al.Malaria therapy reinoculation data suggest individual variation of an innate immune response and independent acquisition of antiparasitic and antitoxic immunities[J].Trans R Soc Trop Med Hyg,2002,96(2):205-209.
[5]Fell AH,Smith NC.Immunity to asexual blood stages ofPlasmodium:is resistance to acute malaria adaptive or innate?[J].Parasitol Today,1998,14(9):364-369.DOI:10.1016/S0169-4758(98)01298-8
[6]Su Z,Stevenson MM.IL-12is required for antibody-mediated protective immunity against blood-stagePlasmodiumchabaudiAS malaria infection in mice[J].J Immunol,2002,168(3):1348-1355.
[7]Su Z,Stevenson MM.Central role of endogenous gamma interferon in protective immunity against blood-stagePlasmodium chabaudiAS infection[J].Infect Immun,2000,68(8):4399-4406.DOI:10.1128/IAI.68.8.4399-4406.2000
[8]Langhorne J,Albano FR,Hensmann M,et al.Dendritic cells,pro-inflammatory responses,and antigen presentation in a rodent malaria infection[J].Immunol Rev,2004,201:35-47.
[9]Lamb TJ,Brown DE,Potocnik AJ,et al.Insights into the immunopathogenesis of malaria using mouse models[J].Expert Rev Mol Med, 2006, 8 (6 ): 1-22. DOI: 10.1017/S1462399406010581
[10]Zeisberger SM,Odermatt B,Marty C,et al.Clodronate-liposome-mediated depletion of tumour-associated macrophages:a new and highly effective antiangiogenic therapy approach[J].Br J Cancer,2006,95(3):272-281.DOI:10.1038/sj.bjc.6603240
[11]Hu Z,Van Rooijen N,Yang YG.Macrophages prevent human red blood cell reconstitution in immunodeficient mice[J].Blood,2011,118(22):5938-5946.
[12]Chimma P,Roussilhon C,Sratongno P,et al.A distinct peripheral blood monocyte phenotype is associated with parasite inhibitory activity in acute uncomplicatedPlasmodiumfalciparummalaria[J].PLoS Pathog,2009,5(10):e1000631.DOI:10.1371/journal.ppat.100063
[13]Coban C,Ishii KJ,Horii T,et al.Manipulation of host innate immune responses by the malaria parasite[J].Trends Microbiol,2007,15(6):271-278.10.1016/j.tim.2007.04.003
[14]Fu Y,Ding Y,Zhou T,et al.Plasmodiumyoeliiblood-stage primes macrophage-mediated innate immune response through modulation of toll-like receptor signalling[J].Malar J,2012,11(1):104.DOI:10.1186/1475-2875-11-104
[15]Zhu X,Pan Y,Zheng L,et al.Polysaccharides from the Chinese medicinal herbAchyranthesbidentataenhance anti-malarial immunity duringPlasmodiumyoelii17XL infection in mice[J].Malar J,2012,11:49.DOI:10.1186/1475-2875-11-49
