实验性自身免疫性脑脊髓炎小鼠中枢神经组织中CD4mRNA的变化及益肾达络饮对其的影响*
2012-01-23吴彦青朱陵群娄丽霞张东梅
吴彦青 高 颖 朱陵群 娄丽霞 张东梅
(1.天津中医药大学,天津 300193;2.北京中医药大学东直门医院,北京 100700)
目前研究认为炎性细胞向CNS的迁移和浸润是人类多发性硬化(MS)发病的主要因素[1-2]。MS特征性病理改变为中枢神经系统内散在而多发的脑白质或脊髓中的脱髓鞘病灶血管周围T细胞、B细胞及单核/巨噬细胞浸润[3-4]。在MS的研究中发现髓鞘抗原特异性CD4+及CD8+T细胞对其临床和病理改变具重要作用[5]。为进一步明确实验性自身免疫性脑脊髓炎(EAE)发病过程中枢神经系统炎症程度的动态变化及中药益肾达络饮的作用机制,本部分研究运用实时荧光定量PCR,以β-actin作为对照,检测不同时间点CD4mRNA在EAE小鼠脑和脊髓中的表达变化,为MS在发病过程中发病程度与中枢神经系统炎性聚集提供依据和下一步可能干预的途径。
1 材料与方法
1.1 动物 C57BL/6小鼠购自中国医学科学院实验动物研究所,实验动物许可证号:SCXK(京):2005-0013。 选用 8~10 周龄雌性C57BL/6小鼠108只,体质量(18.4±0.8)g。实验小鼠饲养在中国中医科学院基础研究所二级动物中心饲养室。
1.2 试剂 MOG35-55多肽(MEVGWYRSPFSRVVHLYNGK)由北京赛百盛生物工程公司合成,纯度(HPLC)98.3%;完全弗氏佐剂(CFA)购自美国 sigma 公司,批号:049K8700;百日咳毒素(PTX)购自美国sigma公司,批号:P7208;结核分枝杆菌(H37RA)购自美国DIFCO公司,批号:0172191;POWERSYBRGREENPCRMASTER试剂购于美国ABI公司,批号:4367659。
1.3 药物 益肾达络饮(由熟地黄、石菖蒲、栀子、豨莶草等药物组成)饮片购自北京中医药大学东直门医院,常规方法煎煮,收集滤液并文火煎煮浓缩制成2 g生药/mL的水提物。醋酸泼尼松,天津力生制药股份有限公司,批号:081206,用去离子水配制成0.39 mg/mL溶液。
1.4 模型制备 采用MOG35-55抗原免疫C57BL/6小鼠:将等体积的 MOG35-55 水溶液 (每 100 μL 含 MOG35-55200 μg)与完全弗氏免疫佐剂(每100 μL含结核杆菌H37RA500 μg)混合乳化制成油包水的抗原乳剂。于免疫动物当日记为第0日,模型组、激素组、中药组每只小鼠背侧脊柱中线两侧分4点皮下注射共计0.2 mL MOG35-55抗原配剂,佐剂组每只小鼠背侧脊柱中线两侧分4点皮下注射共计0.2 mL不含MOG35-55的油包水乳剂。注射完配剂30 min后,佐剂组、模型组、激素组、中药组每只小鼠均腹腔内注射0.1 mL(含400 ng PTX)百日咳毒素溶液,48 h后再次腹腔内注射0.1 mL PTX溶液1次;正常组小鼠不给予任何药物干预。
1.5 分组与给药 实验分4个取材时点,即造模后7 d(发病前期)、14 d(发病初期)、24 d(发病急性期)和 40 d(慢性期)。 实验前将所有C57BL/6小鼠随机分配至5个组:正常组、佐剂组、模型组、激素治疗组、中药治疗组,正常组24只,佐剂组24只,模型组24只,激素组18只,中药组18只。免疫后第7日起,每日给予各组小鼠灌服相应的药物。
1.6 神经功能评分 小鼠免疫后,采用盲法由两名观察者进行神经功能评分,观察时间为第0日到第40日(共41 d),评分标准根据Kono等[6]的5级评分法:0分为小鼠不发病;1分为小鼠出现尾部张力降低或轻度步态笨拙;2分为小鼠尾部完全无张力,和(或)中度步态异常,和(或)姿态维持缺乏;3分为小鼠肢体明显力弱;4分为小鼠肢体麻痹或瘫痪;5分为小鼠处于濒死状态。测评分≥1分为发病动物。评价EAE发病严重程度的指标包括:每日平均临床评分、平均起病天数、疾病指数及平均最高评分[7]。
1.7 实时荧光定量PCR检测CD4mRNA的表达 CD4及βactin引物由北京奥科鼎盛生物科技有限公司合成,引物序列见表1。

表1 引物序列
小鼠在相应时间点处死后,超净工作台上快速取大脑和脊髓组织,每组6只,液氮冷冻。取脑或脊髓组织约100 mg,采用异硫氰酸胍一步法抽提组织总RNA。所提总RNA经1%琼脂糖凝胶电泳确定其完整性,并经紫外分光光度计检测所提RNA含量和纯度。取2.0 μg总RNA进行逆转录反应,采用SYBR Green荧光染料技术进行实时荧光定量PCR扩增。记录其循环阈值(Ct),每个样品中靶基因的相对mRNA表达采用相对定量公式2-△△Ct计算,其中△Ct值=靶基因 Ct值-β-actin Ct值。
1.8 统计学处理 应用SPSS13.0统计软件。组间比较采用单因素方差分析,以(±s)表示。P<0.05为差异有统计学意义。
表2 各组EAE小鼠神经功能评分比较(±s)
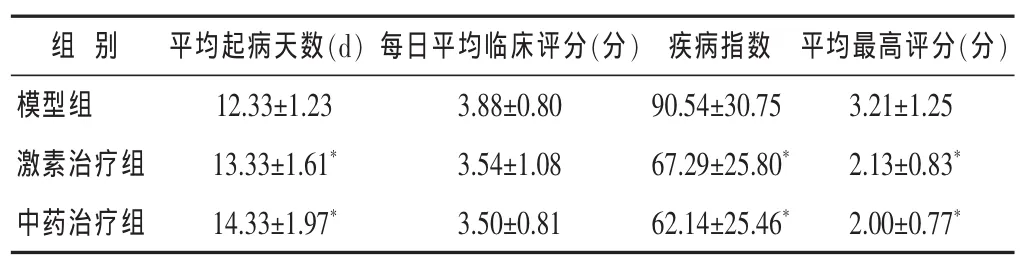
表2 各组EAE小鼠神经功能评分比较(±s)
与模型组比较,*P<0.05。
组 别 平均起病天数(d) 平均最高评分(分)每日平均临床评分(分) 疾病指数模型组3.21±1.25激素治疗组 2.13±0.83*14.33±1.97*12.33±1.23 13.33±1.61*3.88±0.80 90.54±30.75 3.54±1.08 67.29±25.80*中药治疗组2.00±0.77*3.50±0.81 62.14±25.46*
2 结 果
2.1 造模后EAE小鼠行为学观察结果 见表2。表2示各治疗组与模型组相比,各治疗组的平均起病天数明显延迟(P<0.05),平均最高评分明显降低(P<0.05),疾病指数显著降低(P<0.05)。
2.2 造模后EAE小鼠脑和脊髓内CD4mRNA的表达 见表3~表4。与正常组比较,免疫后7 d,EAE小鼠脑内CD4mRNA的表达显著上升(P<0.05),而脊髓内表达未见显著升高(P>0.05);至免疫后14 d,EAE小鼠脑和脊髓内CD4mRNA的表达继续显著上升(P<0.01);免疫后24 d,EAE小鼠脑和脊髓内CD4mRNA的表达继续显著上升(P<0.01);免疫后40d,EAE小鼠脑内CD4mRNA的表达仍显著升高(P<0.01),而脊髓CD4mRNA内表达未见显著升高(P>0.05)。
表 3 各组大脑组织中CD4mRNA表达比较(CD4/β-actin,±s)
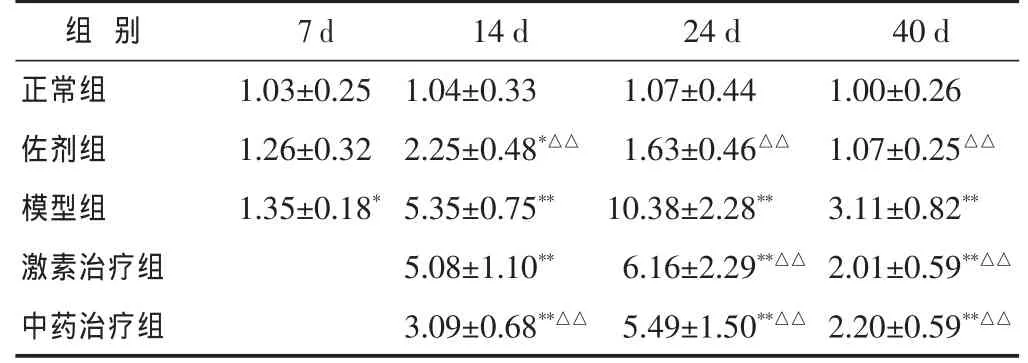
表 3 各组大脑组织中CD4mRNA表达比较(CD4/β-actin,±s)
与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。
1.35±0.18*5.35±0.75** 10.38±2.28**激素治疗组 5.08±1.10** 6.16±2.29**△△ 2.01±0.59**△△中药治疗组 3.09±0.68**△△ 5.49±1.50**△△ 2.20±0.59**△△14 d 24 d 1.04±0.33 1.07±0.44 2.25±0.48*△△ 1.63±0.46△△模型组40 d正常组 1.00±0.26佐剂组 1.07±0.25△△组 别7 d 1.03±0.25 1.26±0.32 3.11±0.82**
表 4 各组脊髓组织中CD4mRNA表达比较(CD4/β-actin,±s)

表 4 各组脊髓组织中CD4mRNA表达比较(CD4/β-actin,±s)
14 d 24 d 1.08±0.47 1.10±0.52 0.58±0.16△△ 1.07±0.51△△△模型组40 d正常组 1.04±0.30佐剂组 1.93±0.57△△组 别7 d 1.07±0.47 3.46±1.67*2.19±1.37 2.61±0.51** 21.58±9.31**激素治疗组 0.67±0.24△△ 16.21±9.64**△△ 0.36±0.20**中药治疗组 0.95±0.51△△ 14.20±9.97*△△ 0.48±0.32*0.62±0.30
经过益肾达络饮治疗后在14、24、40 d EAE小鼠脑组织CD4mRNA的表达同样出现显著上升(P<0.01),但是与模型组表达比较均出现了显著下降(P<0.01)。经过益肾达络饮治疗后EAE小鼠脊髓组织CD4mRNA的表达在14 d时尚未出现明显升高,而在24 d CD4mRNA的表达明显升高(P<0.05);在40 d时CD4mRNA的表达显著降低(P<0.05)。
经过激素治疗后在 14、24、40 d EAE小鼠脑组织 CD4mRNA的表达同样出现显著上升(P<0.01),但是在24、40 d时与模型组小鼠比较均出现了显著下降(P<0.01)。经过激素治疗后EAE小鼠脊髓组织CD4mRNA的表达在14 d时尚未出现明显升高,而在24 d CD4mRNA的表达明显升高 (P<0.05),在40 d时脊髓中CD4mRNA的表达出现显著降低(P<0.01)。
佐剂组在免疫后7 d,与正常组比较,小鼠脑内CD4mRNA的表达未见明显改变,而脊髓内CD4mRNA的表达显著上升(P<0.05)。免疫后14 d,佐剂组小鼠脑内CD4mRNA的表达显著上升(P<0.05),但是与模型组相比,表达显著降低(P< 0.05)。免疫后24、40 d,与正常组比较,佐剂组小鼠脑和脊髓内CD4mRNA的表达均未见显著改变;与模型组相比,脑和激素内CD4mRNA的表达均显著降低(P<0.01)。
3 讨 论
实验性自身免疫性脑脊髓炎模型是自身免疫性疾病的一个重要的动物模型,其免疫学特征、病理改变和临床表现与多发性硬化非常相似,被认为是研究MS发病机制和寻求新的治疗方法的理想的动物模型[8-11]。 研究表明[12-13],人 MS 及其动物模型EAE是一类主要由T细胞介导的自身免疫性疾病,T细胞针对髓鞘成分的反应在MS的发病过程中起到了关键的作用。其主要发病机制是某种诱因作用下激活的T细胞透过血脑屏障(BBB)进入到脑实质结合中枢的抗原递呈细胞(APC)抗原,通过再刺激分泌出大量的趋化因子和细胞因子,进一步促使B细胞和巨噬细胞的活化,募集外周血T细胞、单核细胞以及B细胞等进入到炎症部位,从而导致中枢神经轴索的损害以及神经组织的炎症脱髓鞘反应。
有实验研究结果表明[14],自身反应性CD4+Th细胞是启动EAE病理过程的主要效应性T淋巴细胞。尽管CD4+Th细胞的活化对EAE的启动、诱导非常重要,但目前普遍认为EAE病程中的效应细胞(即巨噬细胞谱系)包括CNS本身的小胶质细胞以及从血液浸润的单核细胞,是造成组织破坏和髓鞘脱失的主要原因。因此,淋巴细胞和单核/巨噬细胞浸润是MS的根本原因。
本实验观察了免疫后7、14、24、40 d EAE小鼠脑和脊髓内CD4mRNA的表达,表达量均显著高于正常值,其中尤以免疫后24 d表达量最高,这一结果与疾病的临床神经功能损伤程度基本一致。脊髓组织在发病前期即免疫后7 d虽有升高,但不具有显著性差异,考虑原因可能是脊髓中BBB的破坏比脑中在时间上有所延迟;而且在40 d脊髓组织中CD4mRNA的表达没有升高,反而出现了轻度下降,考虑原因可能是机体对炎性改变的自我反应所致。中药治疗组在免疫后14、24、40 d脑内CD4mRNA的表达均出现了显著下降,在14 d降低CD4mRNA在脑内的表达为中药组延迟疾病发生提供了证据,而在免疫后24、40 d降低CD4mRNA在脑内的表达为益肾达络饮能够降低临床神经功能评分提供了依据。同时,这一研究也支持了CD4+在脑内的表达与EAE的发病有着密切联系[15]。
[1]Lu JQ,Fan Y,Mitha AP,et al.Association of alpha-synuclein immunoreactivity with inflammatory activity in multiple sclerosis lesions[J].J Neuropathol Exp Neurol,2009,68(2):179-189.
[2]Sloane E,Ledeboer A,Seibert W,et al.Anti-inflammatory cytokine gene therapy decrea sessensory and motor dysfunction in experimental Multiple Sclerosis:MOG-EAE behavioral and anatomical symptom treatment with cytokine gene therapy[J].Brain Behav Immun,2009,23(1):92-100.
[3]徐全刚,王晓辉,田书娟.趋化因子MCP-l、MIP-1α在EAE小鼠脊髓中的表达[J].脑与神经疾病杂志,2007,15(3):2l6-2l9.
[4]Bennett J,Basivireddy J,Kollar A,et al.Blood-brain barrier disruption and enhanced vascular permeability in the multiple sclerosis model EAE[J].J Neuroimmunol,2010,229(1-2):180-191.
[5]梅云华,徐凌云.CD8+T细胞在多发性硬化中的致病性作用[J].生命科学,2006,18(3):244-246.
[6]Kono DH,Urban JL,Horvath SJ,et al.Two minor determinants of myelin basic protein induce experimental allergic encephalomyelitis in SJL/J mice[J].J Exp Med,1988,168(1):213-27.
[7]Stosic-Grujicic S,Savic-Radojevic A,Maksimovic-Ivanic D,et al.Down-regulation of experimental allergic encephalomyelitis in DA rats by tiazofurin[J].J Neuroimmunol,2002,130(1-2):66-77.
[8]Mix E,Meyer-Rienecker H,Zettl UK.Animal modes of multiple sclerosis for the development and validation of novel therapies-potential and limitations[J].J Neurol,2008,255(Supp16):7-14.
[9]Uboldi C,Doring A,Alt C,et al.L-Selectin-deficient SJL and C57BL/6 mice are not resistant to experimental autoimmune encephalomyelitis[J].Eur J Immunol,2008,38(8):2156-2167.
[10]Schmitt C,Strazielle N,Ghersi-Egea JF.Brain leukocyte infiltration initiated by peripheral inflammation or experimental autoimmune encephalomyelitis occurs through pathways connected to the CSF-filled compartments of the forebrain and midbrain[J].J Neuroinflammation,2012,9(1):187.
[11]Rao P,Segal BM.Experimental autoimmune encephalomyelitis[J].Methods MolBiol,2012,900:363-380.
[12]Bitsch A,Schuchardt J,Bunkowski S,et al.Acute axonal injury in multiple sclerosis.Correlation with demyelination and inflammation[J].Brain,2000,123(Pt6):1174-1183.
[13]Noseworthy JH,Lucchinetti C,Rodriguez M,et al.Multiple sclerosis[J].N Engl J Med,2000,343(13):938-952.
[14]张旭,李佳.实验性自身免疫性脑脊髓炎的历史和现状[J].中国神经免疫学和神经病学杂志,2010,17(1):4-6.
[15]Fabis MJ,Phares TW,Kean RB,et al.Blood-brain barrier changes and cell invasion differ between therapeutic immune clearance of neurotrophic virus and CNS autoimmunity[J].Proc Natl Acad Sci USA,2008,105(40):15511-15516.
