胸腔内循环高温灌注化疗对恶性胸腔积液的作用
2012-01-22王国卿魏东山
冯 兴,李 浒,王国卿,魏东山
浙江省杭州市第一人民医院胸外科(杭州 310006)
恶性胸腔积液(malignant pleural effusions,MP Es)由胸膜原发恶性肿瘤或胸膜腔内外恶性肿瘤通过血行、淋巴转移及直接种植至胸膜所引起的,是晚期肿瘤的重要并发症。根据2009年国际抗癌联盟(UICC)制定的最新肺癌分期标准,分期为M1a期[1],为晚期肺癌的重要标志。虽然现在癌症治疗方面取得了很多进展,但对MPEs患者治疗效果仍较差,一旦明确诊断为MPEs,其中位生存期为4个月[2]。我们于1999年2月—2008年3月对40 例明确为MPEs 患者采用胸腔内循环高温灌注化学治疗(intrapleural circular hyperthermic perfusion chemotherapy,ICHPC),取得了满意的疗效,现总结报道如下。
1 资料与方法
1.1 临床资料 本组共40例,男22例,女18例;年龄31~81 岁,平均(52.5±7.2)岁。发病时间17 d~12.6个月,平均(45±12)d。生活质量按卡氏行为状态评分标准,(Karnofsky Performance Status, KPS):≥60分19例,50分8例,40分10例,30分3例。临床表现主要为呼吸困难、反复胸闷、气急、刺激性咳嗽、消瘦、乏力、胸痛、痰中带血等。表现为一侧大量胸腔积液24 例,其中乳腺癌转移2 例,淋巴瘤1 例;右肺病变7 例,左肺病变9 例,均合并少至中量胸腔积液。经临床表现、胸片、CT、纤维支气管镜、胸水找脱落细胞、胸水及血液肿瘤指标等,明确诊断。
1.2 治疗方法 气管内双腔插管,健侧卧位,单肺通气。于患侧第7 肋间腋中线处取约1.5 cm 切口,置入胸腔镜探查。吸净胸液。于第3或4肋间腋前线取约1.5 cm切口,置入操作钳。松解脏、壁层胸膜之间的黏连,并将壁层胸膜癌结节处及其癌旁正常胸膜组织取样,留送病理及电镜检查。拔出胸腔镜及操作钳,将体外循环预热43 ℃恒温预充液(含生理盐水3000 mL、顺铂300 mg) 的两根管道置入上两个切口中,妥善固定后循环灌注胸膜腔60 min。胸腔灌注前静脉注射甲基强的松龙0.5 g,格拉司琼6 mg,并静滴氨磷汀0.4 g,防止可能出现的胃肠道、肝肾功能损害等副反应的发生。吸净灌注液,并对壁层胸膜癌结节处及癌旁正常胸膜组织再次取样留送病理及电镜检查。鼓肺至肺复张满意后缝合胸壁切口,放置胸管,连接引流瓶。术中用温度计监测胸腔内温度,监测鼻咽温度、生命体征以及心电图变化。
1.3 观察指标 观察治疗前后患者症状改善状况、生活质量变化,胸腔积液的控制状况,胸液中癌胚抗原(CEA)、细胞角蛋白K19片段(CYFRA21-1)、神经元特异性烯醇化酶(NSE)浓度变化,并比较胸膜癌结节治疗前后光镜及电镜形态变化,以及癌旁正常壁层胸膜组织治疗前后光镜及电镜形态变化。
1.4 疗效评价 ⑴完全缓解(CR):胸水、症状消失,维持4 周以上;⑵部分缓解(PR):胸水显著减少,超过50%以上,症状明显改善,维持4 周以上;⑶稳定(SD):胸水减少,无增加趋势;⑷病变进展(PD):胸水无减少或有增加[3]。总有效率为CR+PR所占各组病例总数的百分比。
1.5 统计学分析 计量资料以均数±标准差(±s)表示,采用t检验,计数资料采用χ2检验,应用SPSS 11.0 统计软件进行统计处理,P <0.05 有统计学意义。
2 结果
2.1 临床疗效 本组40 例中,CR39 例,PR1 例。无手术死亡。术后胸管引流液总量在260~1380 mL,平均在(480±120)mL。大多数患者3~7 d内拔除胸管。患者胸闷、气急、呼吸困难、咳嗽等症状明显改善,生活质量提高,KPS 评分均在70 分以上。出院前复查胸片,均无胸腔积液。
随访40例,随访2~48个月,平均(26.0±3.2)个月。2 例于灌注化疗3 个月后复发,复发率为5.0%。复发者胸水局限包裹,且患者无症状,均通过胸腔置入Arrow 14 F 导管(美国)抽液治疗,待胸水抽净后胸腔内注射顺铂、香菇多糖、博来霉素等。胸水平均消失时间11.6个月,最长29个月。中位存活期13.9 个月,1年生存率45%(18/40),其中11 例存活2年以上。随访中5例1年内死亡。1例于术后2月余因脑转移衰竭死亡,4例1年内因原发灶恶化或远处转移死亡,但无1例因胸水复发死亡。
2.2 KPS评分 治疗前后KPS评分比较详见表1。
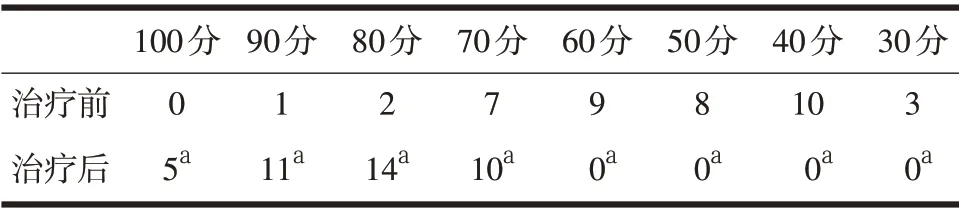
表1 40例MPEs患者治疗前后KPS评分比较(n=40)
2.3 胸液控制状况 ICHPC 前后胸片比较详见图1~图3。

图1 ICHPC前胸片

图2 ICHPC后3个月余胸片

图3 ICHPC后7个月余胸片
2.4 副作用 40 例患者治疗过程中不良反应发生及处理情况见表2。

表2 40例患者治疗过程中不良反应发生及处理
2.4 胸水中CEA、CYFRA21-1、NSE 浓度检测 治疗后胸水中的CEA、CYFRA21-1、NSE 浓度较治疗前明显降低(t=2.58,P<0.05),见表3。
表3 治疗前后胸水中CEA、CYFRA21-1、NSE浓度的变化(±s)

表3 治疗前后胸水中CEA、CYFRA21-1、NSE浓度的变化(±s)
注:与治疗前比较,aP<0.05
组 别治疗前治疗后n 40 40 CEA(μg/L)43.5±4.6 13.8±2.1a CYFRA21-1(μg/L)37.5±3.2 7.8±3.6a NSE(μg/L)30.2±4.3 13.6±4.5a
2.5 胸膜上肿瘤结节病理形态改变 ICHPC 前后改变情况见图4~图5。

图4 治疗前胸膜病变光镜下见大量癌细胞(HE×40)
图5 治疗后胸膜病变光镜下见大量癌细胞细胞坏死(HE×40)
2.6 胸膜癌结节及其旁正常胸膜电镜变化 ICHPC前后电镜下变化情况见图6~图9。
3 讨论
MPEs易并发肺不张、反复感染,甚至呼吸衰竭、严重的呼吸困难和循环障碍。如不及时治疗,平均生存期仅为3.3 个月[4]。目前,MPEs 治疗方法主要有胸腔穿刺术、胸腔闭式引流术、胸膜固定术、胸腹膜分流术。胸腔穿刺多用于对MPEs的诊断或是暂时缓解症状,但疗效差。有报道[3],胸穿将胸水抽净后向胸腔内注入化疗药物或粘连剂,有效率为53.2%~57.4%。但是,对于那些生存期不能超过1~3 个月、无法耐受其他的治疗方法,可考虑反复多次胸穿[5]。胸腔闭式引流加胸膜腔内注入硬化剂或抗肿瘤药曾一度被认为是本病的标准治疗,但对那些胸腔形成黏连、胸液趋于包裹者,效果仍不理想。

图6 治疗前胸膜癌结节电镜下见细胞核呈梭形,形态不规则(×12 000)
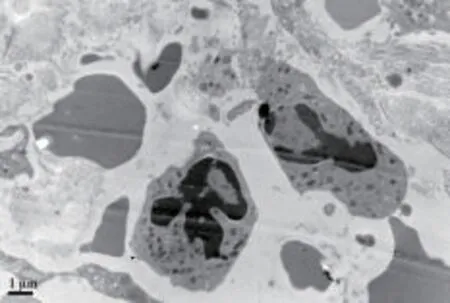
图7 治疗后胸膜癌结节电镜下见:染色质浓缩,呈块状,不规则,可见凋亡小体,进一步发展为核碎裂,至死亡(×10 000)

图8 治疗前癌旁正常胸膜电镜下见细胞形态基本正常,细胞核略增大。细胞内有多量胶原纤维形成,未见明显变性。细胞排列极性整齐(×15 000)

图9 治疗后病变旁正常胸膜电镜下见大量胶原纤维组织,结构清晰,未见明显变性。未见完整细胞核及核内改变(×6000)(×12 000倍)。
胸腔镜手术(video—assisted thoroscopic surgery,VATS)对于MPEs的诊断有重要的价值,也是很好的治疗方法。通过VATS,能有效分离黏连,清除肺表面的纤维素沉积,便于肺复张。通过电灼位于胸膜表面的肿瘤结节,减少术后胸腔积液的产生。同时,结合胸腔内43 ℃恒温灌注,利用热化疗的协同增强作用,通过治疗前后胸膜癌结节及癌旁正常胸膜组织的病理及电镜形态观察,充分证明胸腔内热化疗能有效杀死胸膜上肿瘤细胞,而正常组织无明显损伤。治疗后无1 例胸水控制失败,无手术死亡。所有患者术前的呼吸困难、胸闷等症状明显缓解或消失,生活质量提高,生存时间延长。
多年来,我们一直在探索有关MPEs的治疗,积累了一定的经验[6]。我们体会,MPEs的治疗效果关键在于肺能否充分复张,以及脏、壁层胸膜能否有效黏连。本方法先在胸腔镜下探查,分离肺表面纤维素及黏连后确保肺能充分复张,再行胸腔内循环高温灌注化疗,达到预期效果。通过临床观察,我们体会该方法有以下优点:⑴治疗MPEs安全有效,本组总有效率为100%,明显优于文献中报道的胸腔内局部用药或联合用药效果[7]。⑵毒副作用轻微,经积极的对症处理,短时间内恢复正常,患者能耐受。⑶微创,只需在胸壁上取2个长约1.5 cm小切口,对高龄患者也适用。⑷胸腔镜下视野开阔,能镜下直视分离黏连,有利于患肺充分张开,并准确对胸膜腔病变活检。取足够的组织病理检查及EGFR等基因检测,所有患者病理诊断得到明确,为下一步采取静脉化疗、靶向治疗等综合治疗措施提供依据。⑸体外循环下热启动快,胸腔内热疗剂量分布均匀,而MPEs患者往往胸膜腔内病变广泛,避免传统胸腔内局部用药后受胸腔内黏连及给药后患者不能规律改变体位等各种不利因素,以及短期内积液复发、形成分隔及包裹性积液的缺点。⑹术后恢复快,本组病例平均住院时间为8.5 d,明显短于开胸手术患者。
ICHPC 过程中化疗、热疗剂量未统一规定。Shigemura等[8]在I期研究中指出,顺铂最高安全剂量为200 mg/m2。热疗剂量包括灌注温度及灌注持续时间,43 ℃高温可杀死肿瘤细胞,而正常组织不受影响,这已成为公认。为防治热诱导的肺损伤及减少术后肾毒性、消化道毒性的发生,多主张灌注1 h。本组患者均胸腔内高温灌注1 h,顺铂剂量200 mg/m2,显示效果良好。副作用发生率较高,但总体耐受较好,均在患者心理承受范围内。除3例患者发生急性肾功能不全,恢复稍慢,余患者反应均在短期内控制。我们亦在探索热量剂量,试图减少顺铂剂量,以期达到相同疗效。目前,还在收集病例资料中。
MPEs的患者易于远处转移,ICHPC局部控制胸腔积液后患者生活质量改善,后续全身化疗等综合治疗措施对巩固疗效非常重要[9]。对一般情况良好的患者,继续定期全身静脉化疗,如患者经济许可,结合EGFR 等基因检测结果,选择敏感有效的个体化治疗策略。同时,予以营养支持、中医药治疗、免疫治疗等措施,能有效改善患者生活质量及生存期。
患者出现MPEs,提示疾病已进展至晚期,预后极差。虽然通过胸膜固定或长期置管引流等多种多样的、耐受性好的技术来治疗MPEs,但都无法从病因上根治胸腔积液。因此,如何有效控制胸腔积液,防止复发,缓解症状,改善生活质量,延长生存期,成为治疗的目标。虽然采用滑石粉胸膜固定术治疗效果牢靠,但引起急性胸膜炎及胸膜炎样剧烈胸痛,且呼吸困难、发热、肺不张、脓胸及急性呼吸衰竭等发生率高[10],甚至发展为急性呼吸窘迫综合征,临床应用受限。我们所采取的方法虽也只是一种姑息性治疗方法,但有效地结合胸腔镜微创诊治及热化疗协同作用,对MPEs 具有较好的治疗作用,效果可靠,对老年患者亦适应,在临床上有较高的应用价值。
[1]Frank C, Daniel J, Lynn T. The new lung cancer staging system[J]. Chest, 2009, 136(1):260-271.
[2]Bielsa S, Martin-Juan J, Porcel JM, et al. Diagnostic and prognos⁃tic implications of pleural adhesions in malignant effusions [J]. J Thorac Oncol, 2008, 3(11):1251-1256.
[3]Antunes G, Neville E, Duffy J, et al, BTS Pleural Disease Group, a subcommittee of the BTS Standards of Care Committee. BTS guide⁃lines for the management of malignant pleural effusions [J]. Thorax,2003,58(suppl2):ii29.
[4]Sahn SA. Management of Malignant Pleural Effusions [J]. J Monal⁃di Arch Chest Dis, 2001, 56 (5) :394-399.
[5]Maskell NA, Butland RJ. BTS guidelines for the investigation of a unilateral pleural effusion in adults [J]. Thorax, 2003,58(suppl 2):ii8.
[6]冯兴, 李浒, 王国卿, 等. 微创置管胸腔内注射顺铂及香菇多糖治疗恶性胸腔积液[J]. 中国中西医结合外科杂志, 2009,4(2):17-21.
[7]孙燕主编.内科肿瘤学[M]. 北京:人民卫生出版社,2001:260-270.
[8]Shigemura N, Akashi A, Nakagiri T, et al. Pleural perfusion ther⁃mo-chemotherapy under VATS: a new less invasive modality for advanced lung cancer with pleural spread [J]. Ann Thorac Surg,2004,77(3):1016-1022.
[9]Matsuzaki Y, Shibata K, Yoshioka M. Intrapleural perfusion hyper⁃thermo-chemotherapy for malignant pleural dissemination and effu⁃sion [J]. Ann Thorac Surg, 1995,59(1):127-133.
[10]Medford AR, Maskell NA. A national survey of oncologist and chest physicians’attitudes towards empirical anti-oestrogen thera⁃py, early pleurodesis and preference of sclerosing agent in malig⁃nant breast and ovarian pleural disease [J]. Palliat Med, 2005, 19(5):430-431.
