Skp2和Cyclin D1在胃癌中的表达及其临床意义
2012-01-21郑元正谢建亮孙鹂王佩飞
郑元正,谢建亮,孙鹂,王佩飞
(1.温州医学院附属乐清医院 外科,浙江 温州 325600;2.杭州师范大学医学院 中心实验室,浙江 杭州 310036)
有研究表明,细胞周期调控异常与细胞癌变密切相关,细胞周期的关键是G1期的启动,因此对肿瘤的研究多集中在G1~S期[1]。S期激酶相关蛋白2(S-phasekinaseassociated protein 2,Skp2)属于F-box蛋白家族中重要的一员,是细胞周期G1/S期的重要调控因子,通过泛素化参与细胞周期调控,与肿瘤发生、发展和预后密切相关[2-3]。但Skp2与Cyclin D1的表达在胃癌中的关系目前尚不清楚,本研究采用RT-qPCR检测胃癌组织和正常胃组织中的Skp2、Cyclin D1,探讨两者在胃癌组织和正常胃组织中的表达及其临床意义。
1 资料和方法
1.1 一般资料 标本来源于温州医学院附属乐清医院2008年9月至2010年10月间内镜室胃镜活检的正常胃黏膜组织及经外科手术切除的胃癌组织标本,均经病理证实。正常胃黏膜组织20例,其中男13例,女7例,年龄31~69岁,平均(50.3±4.6)岁。胃癌组织35例,其中男24例,女11例,年龄30~76岁,平均(56.5±6.2)岁;其中早期胃癌15例,进展期胃癌20例;高中分化20例,低分化15例;肿瘤未穿透浆膜(T1~T2)22例,穿透浆膜(T3~T4)13例;有淋巴结转移16例,无淋巴结转移19例。
1.2 方法 用RT-qPCR法检测Skp2与Cyclin D1在正常胃组织、胃癌组织中的表达情况。RNA抽提:每50 mg组织加入1 mL Trizol(购自Gibco公司),按Trizol试剂说明书提取总RNA,测定OD280/260。RT-qPCR所用引物由上海英骏生物技术有限公司合成,Oligo dT(购自Takara公司)进行逆转录。RT-qPCR检测反应体系包括:1μ L RT产物,1×SYBR Green I Mastermix(购自Takara公司),0.5μmol/L引物。GAPDH为内参。反应条件为:95 ℃ 10 min后,95 ℃ 15 s,60 ℃ 1 min,40个循环。所有样品做3个复孔。记录每个反应管中的荧光信号到达所设定的域值时所经历的循环数(Ct值)。公式为:△Ct=标本Ct均值-内参Ct均值,取2-△Ct代表标本初始cDNA相对量。
1.3 统计学处理方法 采用SPSS10.00软件进行统计分析。Skp2与Cyclin D1表达以其相对组织的百分比表示,不同标本表达水平的比较采用one-way ANOVA;Spk2与Cyclin D1表达之间的关系经Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Skp2和Cyclin D1在胃癌中的表达 胃癌组织和正常胃组织中均检测到Skp2和Cyclin D1 mRNA,两者在胃癌组织中的表达水平明显高于正常胃组织(分别为F=3.674,P=0.016;F=7.455,P=0.001)(见表1)。低分化胃癌组织的Spk2和Cyclin D1 mRNA表达明显高于高中分化程度,差异有统计学意义(P=0.034,P=0.008)(见表2);而其表达水平在浸润程度及有无淋巴结转移中的差异无统计学意义(P>0.05)。
表1 Skp2和Cyclin D1 mRNA在胃癌中的表达(±s)

表1 Skp2和Cyclin D1 mRNA在胃癌中的表达(±s)
与正常胃组织比:aP<0.05
Skp2 mRNA 0.679±0.381 1.958±0.876a 2.239±0.989a组别正常胃组织早期胃癌进展性胃癌例数20 15 20 cyclin D1 mRNA 0.419±0.324 0.924±0.613a 1.524±1.001a
表2 胃癌组织中Skp2及Cyclin D1 mRNA表达与临床病理学特征的关系(±s)
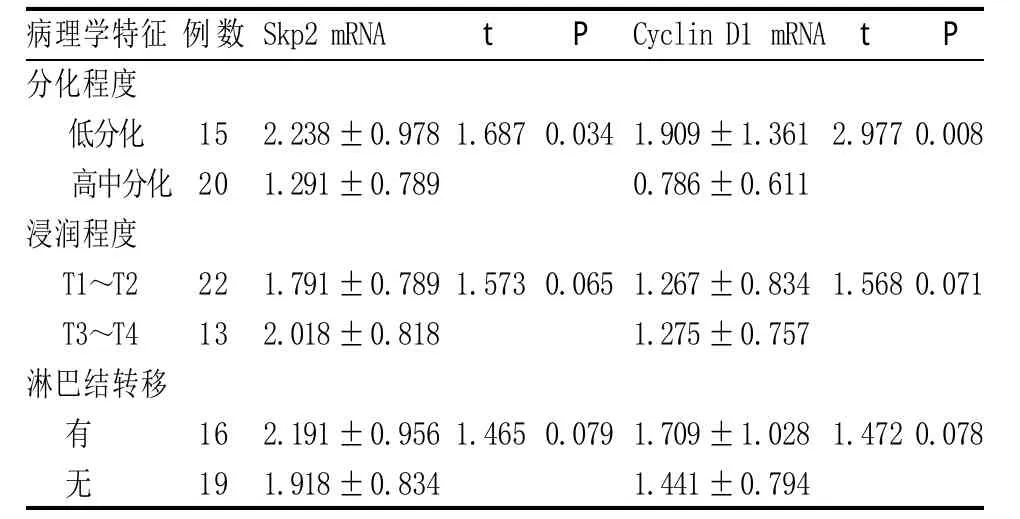
表2 胃癌组织中Skp2及Cyclin D1 mRNA表达与临床病理学特征的关系(±s)
病理学特征分化程度低分化高中分化浸润程度T1~T2 T3~T4淋巴结转移例数Skp2 mRNA t P Cyclin D1 mRNA t P 15 20 2.238±0.978 1.291±0.789 1.6870.0341.909±1.361 0.786±0.611 2.9770.008 22 13 1.791±0.789 2.018±0.818 1.5730.0651.267±0.834 1.275±0.757 1.5680.071有 无16 19 2.191±0.956 1.918±0.834 1.4650.0791.709±1.028 1.441±0.794 1.4720.078
2.2 Spk2与Cyclin D1表达之间的关系 经Pearson相关分析发现,Skp2与Cyclin D1之间存在明显正相关:r=0.987,P<0.01。
3 讨论
Cyclin D1基因位于人染色体12p13区,其产物Cyclin D1蛋白与CDK4/6形成活性复合物,参与G1期和S期的pRb磷酸化作用,是细胞周期正性调节蛋白,其异常表达与多种恶性肿瘤的发生发展有关[4]。本研究结果显示,Cyclin D1 mRNA在胃癌组织中的表达明显高于正常胃组织(P<0.05),并且低分化胃癌组织的Cyclin D1 mRNA表达明显高于高中分化程度,提示Cyclin D1蛋白的过表达可能参与胃癌的发生、发展。但是,Cyclin D1过表达与胃癌临床病理特征关系的分析结果显示,Cyclin D1过表达与肿瘤浸润深度及淋巴结转移均无相关性。
Skp2蛋白是细胞周期G1期到S期转换密切相关的关键性调控因子,在G1末期出现,S期前达到高峰,与肿瘤的发生、发展关系密切[5]。已有研究表明,在多种人类肿瘤中发现Skp2蛋白呈高表达,如结肠直肠癌、宫颈癌、口腔鳞癌、胃癌、肺癌等,并发现Skp2表达水平高低与肿瘤的恶性程度及预后相关[6-8]。本实验结果显示,Skp2在胃癌组织中的表达量明显高于正常胃组织中的表达量,并且低分化胃癌组织的Skp2 mRNA表达明显高于高中分化程度,表明细胞的增殖、癌变可能与Skp2的表达上调有关。相关性分析发现Skp2与Cyclin D1的表达存在正相关,Skp2的高表达,可能导致了Skp2底物降解的紊乱,促进细胞通过G1/S转换“关卡”的作用,使本来应该停止增殖的细胞进入细胞周期,促进DNA的复制、细胞的增殖,最终导致肿瘤的发生[9]。Skp2和Cyclin D1在胃癌中表达上调,提示Skp2和Cyclin D1可能协同参与了胃癌的发生、发展,此发现为胃癌的诊治提供了新的思路和依据。
[1] Musgrove EA, Caldon CE, Barraclough J, et al. Cyclin D as a therapeutic target in cancer[J]. Nat Rev Cancer,2011,11(8):558-572.
[2 Stacey DW. Three observations that have changed our understanding of Cyclin D1 and p27 in cell cycle control[J]. Genes Cancer, 2010,1(12):1189-1199.
[3] Masuda TA, Inoue H, Sonoda H, et al. Clinical and biological significance of S-phase kinase-associated protein 2 (Skp2)gene expression in gastric carcinoma: modulation of malignant phenotype by Skp2 overexpression, possibly via p27 proteolysis[J]. Cancer Res,2002,62(13):3819-3825.
[4] Oberg K. Genetics and molecular pathology of neuroendocrine gastrointestinal and pancreatic tumors (gastroenteropancreatic neuroendocrine tumors) [J]. Curr Opin Endocrinol Diabetes Obes,2009,16(1):72-78.
[5] 李香梅, 李男, 王新, 等. Skp2与恶性肿瘤关系的研究进展[J].辽宁医学院学报, 2008, 29( 2) :180-182.
[6] 李胜,梅同华,黎联,等. Skp2表达质粒的构建及其对肺癌细胞生长的影响[J].第三军医大学学报,2008,30(13):1275-1278.
[7] Arbini AA, Greco M, Yao JL, et al. Skp2 overexpression is associated with loss of BRCA2 protein in human prostate cancer[J]. Am J Pathol, 2011,178(5):2367-2376.
[8] Meng J, Ding Y, Shen A, et al.Overexpression of PPAR γ can down-regulate Skp2 expression in MDA-MB-231 breast tumor cells[J]. Mol Cell Biochem,2010,345(1-2):171-180.
[9] Sarmento LM,Huang H,Limon A,et al. Notchl modulates timing of G1-S progression by inducing SKP2 transcription and p27 Kipl degradation[J].J Exp Med,2005,202(1):157-168.
