乳腺(癌)干细胞与Wnt信号通路
2012-01-21陈旭东
陈旭东
(复旦大学上海医学院 分子医学教育部重点实验室,上海 200032)
肿瘤的起源目前有体细胞学说和干细胞学说。如果说宇宙起源于大爆炸,那肿瘤则是细胞在人体里的大爆炸。恶性肿瘤是来自干细胞的大爆炸而良性肿瘤是来自体细胞的大爆炸,因为致肿瘤因子既要改变与“增殖”相关的基因或基因组,又要改变与“分化”相关的基因或基因组,而干细胞具有自主分化的功能,无需改变。本综述以乳腺癌为例,介绍目前恶性肿瘤的基础研究热点和方向,着重说明干细胞的研究现状。
1 乳腺(癌)干细胞
正常乳腺组织由乳腺干细胞分化而来。而肿瘤的干细胞假说则认为乳腺癌来源于分化不同阶段的乳腺干/前体细胞的突变,这对乳腺癌的异质性是很好的解释。由于以前缺乏特异的分子表面标记和体外培养系统以维持干细胞的未分化状态,乳腺(癌)干细胞的分离和培养受到制约。Al-Hajj等[1]成功鉴定了乳腺癌干细胞为CD44+CD24-Lin-的细胞亚群。参照胚胎干细胞、神经干细胞的培养方法,目前已成功分离和培养乳腺干细胞:以“mammospheres”(乳腺细胞团)的形式,悬浮生长在无血清培养基上。并证实富含自我更新能力和分化成乳腺组织的三种细胞系(导管上皮、肌上皮、腺泡上皮)的未分化细胞。“mammospheres”亦含有ER+增殖前体细胞。若将“mammospheres”的细胞与成纤维细胞混合,在NOD/SCID小鼠的清洁乳腺脂肪垫上,可重建具有导管腺泡结构的正常乳腺组织[2-4]。依照同样方法成功分离和培养了乳腺癌细胞系MCF-7及临床标本的乳腺癌干/前体细胞[5]。基因表达谱分析提示,“mammospheres”与血液、神经及胚胎干细胞有显著的重叠。影响干细胞自我更新的信号通路有Notch、Hedgehog、侧翼蛋白(Wnt)、LIF等,前三者亦参与细胞命运的决定。正常干细胞与肿瘤干细胞共享某些特征:自我更新能力、端粒酶表达、分化能力、抗凋亡及特异位点的宿驻。肿瘤的转移和复发可能与肿瘤干细胞有关,因此,肿瘤干细胞的研究成为热点。
2 Wnt信号通路
由Wnt介导的信号通路在进化上高度保守,已知Wnt通路与细胞命运的决定、细胞增殖、细胞形态、迁移、凋亡、分化及干细胞自我更新有关[8]。Wnt信号通路包括经典的Wnt-β-catenin途径和非经典途径。前者通过Wnt蛋白与膜受体frizzled结合,通过β 链蛋白导致下游基因的转录激活。无Wnt信号,β-catenin滞留在胞浆,与抑癌基因APC(adenomatous polyposis coli)、axin及糖原合成酶激酶3(GSK3)形成复合物。GSK3能磷酸化β-catenin,启动β-catenin的泛素化降解途径。Wnt信号激活,GSK3抑制,阻碍了β-catenin的磷酸化,非磷酸化的β-catenin是稳定的,且能入核结合并激活转录因子TCF/LEF,导致下游基因(c-Myc、cyclin D1等)的转录激活[6-7]。因此,非磷酸化的、游离的β链蛋白是Wnt信号通路下传的中心环节。β链蛋白尚与E-cadherin(一个重要的细胞黏附分子)的胞内段结合。非经典途径可能通过如下三种机制:Wnt/Ca2+通路、Wnt/G蛋白通路和Wnt/PCP通路[9](见图1)。目前研究较多的是Wnt信号的经典途径。
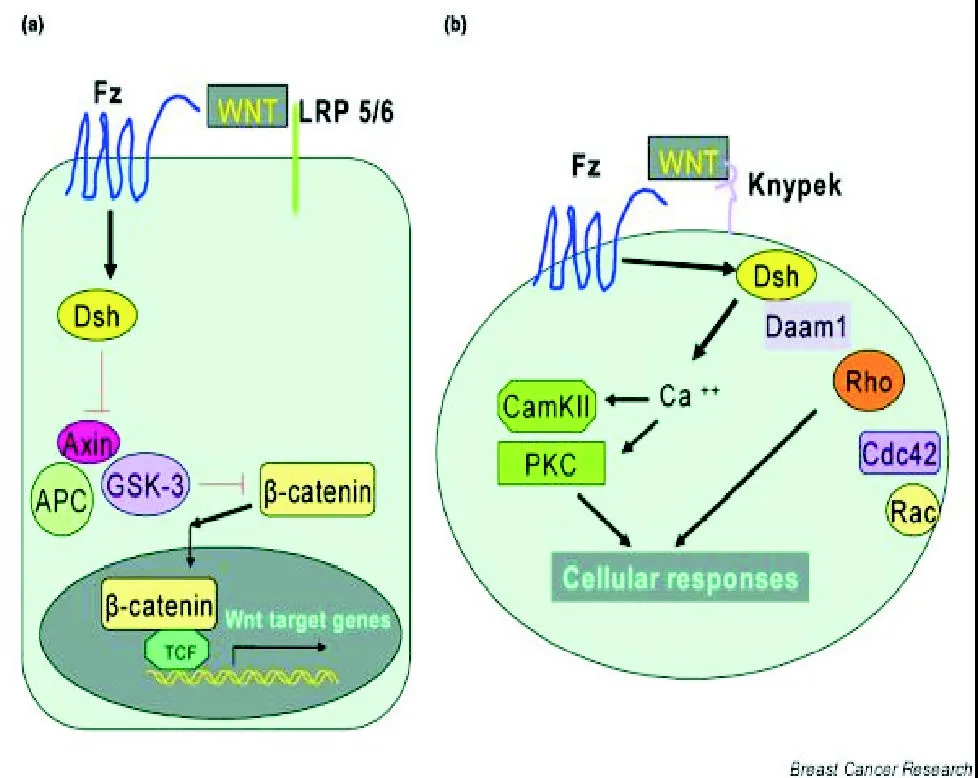
图1 Wnt信号的经典途径 (a)与非经典途径(b)
3 乳腺(癌)干细胞与Wnt信号通路
Wnt基因家族成员的wnt-1、wnt-3和wnt-10b都是由小鼠乳腺乳头状病毒(MMTV)诱发小鼠乳腺癌的过程中活化的癌基因。小鼠wnt-1、wnt-2、wnt-3a、wnt-5a与wnt-7基因在体外均具有转化细胞的能力。目前虽无明确证据表明,Wnt基因异常能直接导致人类肿瘤的发生,但是Wnt-5a在乳腺癌及早期乳腺增生中过度表达更为明显,因此Wnt-5a具有癌基因的某些特性。 研究发现,乳腺癌中免疫组化检测到核或胞质β-catenin水平增高;E-cadherin启动子区被高度甲基化,低表达或失活的E-cadherin能使与膜结合β-catenin减少,导致胞内游离的β-catenin量增加,从而激活Wnt信号通路,使细胞发生转化。因此,可以认为E-cadherin具有抑癌基因的功能[10]。抑癌基因APC与结肠癌发生的关系极为密切。结肠癌细胞中APC的失活可直接导致β-catenin在核内的累积;或β-catenin点突变抑制β-catenin蛋白磷酸化,不能降解,造成Tcf-4靶基因活化[11]。而在乳腺癌中均未发现APC的失活或β-catenin点突变。Wnt通路通过对乳腺生长发育的几个阶段产生影响,可能跟授乳期后的乳腺复旧有关。最近研究表明,在乳腺癌中,某些Wnt信号通路中的特异蛋白质的过表达或下调;如CKII及sFRP4的过表达及WIF-1和sFRP-1的下调,同时发现DVL-1的扩增[8]。通过细胞外给予Wnt拮抗剂FRP1及DKK1引起乳腺癌β-catenin水平下调,伴随着细胞分化特征的改变[12]。更进一步的研究着眼于Wnt信号通路如何在不同组织类型的乳腺癌的发生,发展中起作用,以及是否促进乳腺(癌)干细胞的自我更新。
Wnt1是首个被克隆的小鼠原癌基因,其被插入MMTV后具有病毒介导的致癌作用[13]。随后的MMTV.LTR-Wnt1转基因小鼠亦证实小鼠乳腺小叶腺泡上皮增生,一年内100%小鼠产生乳腺腺瘤。MMTV.-Wnt1 转基因小鼠亦成为广泛应用的乳腺肿瘤动物模型[14]。例如以此模型构建LRP-5缺失突变体,发现了LRP-5-/-MMTV.-Wnt1转基因小鼠乳腺发育延迟,产生抗肿瘤的表型[15];发现了MMPs在肿瘤转移中的作用[16];以及发现了抑癌基因PTEN(Phosphatase and Tensin Homologue)的过表达对肿瘤的抑制作用[17]。更值得一提的是:通过对MMTV.-Wnt1转基因小鼠动物模型本身的研究,发现肿瘤来源于TEBs(terminal end buds)细胞[18]。而TEBs细胞为公认的乳腺干细胞,故通过MMTV.-Wnt1转基因小鼠,将乳腺干细胞-乳腺肿瘤-Wnt信号通路有机地结合在一起[19]。相信以MMTV.-Wnt1转基因小鼠为基础,通过针对Wnt信号通路中的关键蛋白质的基因,采用Knock in或Knock out技术,构建缺失突变体或基因的过表达,将对乳腺癌的分子生物学特性有更深入的了解。而且针对各种干细胞的自我更新的信号通路的抗肿瘤药物,也在研发中,以便解决肿瘤的复发和转移难题[20]。
[1] Al-Hajj M,Wicha MS,Benito-Hernandez A, et al. Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[2] Gudjonsson T, Villadsen R, Nielsen HL, et al. Isolation,immortalization, and characterization of a human breast epithelial cell line with stem cell properties [J].Genes Dev,2002,16(6):693-706.
[3] Dontu G, Abdallah WM, Foley JM, et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells[J]. Genes Dev,2003,17(10):1253-1270.
[4] Woodward WA, Chen MS, Behbod F, et al. On mammary stem cells [J]. J Cell Sci,2005,118(Pt 16):3585-3594.
[5] Ponti D, Costa A, Zaffaroni N, et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties[J]. Cancer Res,2005,65(13):5506-5511.
[6] Polakis P. Wnt signaling and cancer[J]. Genes Dev,2000,14(15):1837-1851.
[7] Dontu G, Wicha MS.Survival of mammary stem cells in suspension culture:implications for stem cell biology and neoplasia[J]. J Mammary Gland Biol Neoplasia,2005,10(1):75-86.
[8] Howard B, Ashworth A.Signalling pathways implicated in early mammary gland morphogenesis and breast cancer[J]. PloS Genet,2006,2(8):e112.
[9] Liu S, Dontu G, Wicha MS.Mammary stem cells, self-renewal pathways, and carcinogenesis[J]. Breast Cancer Res,2005,7(3):86-95.
[10]Hiraguri S, Godfrey T, Nakamura H, et al. Mechanisms of inactivation of E-cadherin in breast cancer cell lines[J].Cancer Res,1998,58(9):1972-1977.
[11] Bienz M, Clevers H.Linking colorectal cancer to Wnt signaling [J].Cell,2000,103(2):311-320.
[12]Bafico A, Liu G, Goldin L,et al.An autocrine mechanism for constitutive Wnt pathway activation in human cancer cells[J].Cancer Cell,2004,6(5):497-506.
[13]Nusse R, Varmus HE.Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome[J]. Cell,1982,31(1):99-109.
[14]Li Y, Hively WP, Varmus HE.Use of MMTV-Wnt-1 transgenic mice for studying the genetic basis of breast cancer[J].Oncogene,2000,19(8):1002-1009.
[15]Lindvall C, Evans NC, Zylstra CR, et al. The Wnt signaling receptor Lrp5 is required for mammary ductal stem cell activity and Wnt1-induced tumorigenesis[J]. J Biol Chem,2006,281(46):35081-35087.
[16]Blavier L, Lazaryev A, Dorey F.Matrix metalloproteinases play an active role in Wnt1-induced mammary tumorigenesis[J].Cancer Res,2006,66(5):2691-2699.
[17] Zhao H,Cui Y,Dupont J, et al. Overexpression of the tumor suppressor gene phosphatase and tensin homologue partially inhibits wnt-1-induced mammary tumorigenesis[J]. Cancer Res,2005,65(15):6864-6873.
[18]Li Y, Welm B, Podsypanina K, et al. Evidence that transgenes encoding components of the Wnt signaling pathway preferentially induce mammary cancers from progenitor cells[J].Proc Natl Acad Sci USA,2003,100(26):15853-15858.
[19]Brennan KR, Brown AM.Wnt proteins in mammary development and cancer[J]. J Mammary Gland Biol Neoplasia,2004,9(2):119-131.
[20] 李佳,房林.乳腺癌干细胞与其肿瘤治疗的前景[J].中国普通外科杂志,2011,20 (5):533-535.
