右美托咪定对小儿腹腔镜手术应激反应的影响
2012-01-15樊友凌江伟航程平瑞
樊友凌,江伟航,程平瑞,黄 芳
广州市番禺区中心医院麻醉科(广东 广州 511400)
腔镜手术已在小儿外科领域内广泛运用,但由于小儿生理系统发育的不平衡性使小儿对应激反应有别于成人,尤其是在腹腔镜手术中CO2气腹会对小儿病理生理产生特殊的影响[1],因此运用各种麻醉方法和麻醉药物来调控围手术期应激反应成为当前研究的热点。盐酸右美托咪定为新型高选择性α2肾上腺素能受体激动剂,具有剂量依赖性的镇静催眠作用,还具有镇痛、抑制交感活性、改善手术期心血管稳定性等药理作用[2],其对围术期应激反应可能具有一定的影响,但确切机理尚不明确。本研究对小儿腹腔镜手术患儿全麻期间持续应用右美托咪定,测定围术期其血糖(Glu)、血浆肾上腺素(E)、去甲肾上腺素(NE)和IL-6浓度的变化,探讨其对围术期患儿应激反应的影响。
1 资料和方法
1.1一般资料择期行腹腔镜疝囊高位结扎术的患儿40例,年龄2~5岁,ASAⅠ-Ⅱ级,其中男性30例,女性10例,年龄(24.3±1.8)个月,体重(16.4±1.8)kg。随机分为两组,右美托咪定组(D组)和对照组(C组),每组20例。两组患儿的年龄、体重、性别比较差异无统计学意义(P>0.05)。
1.2麻醉方法两组患儿术前30 min肌注鲁米那钠5 mg/kg,阿托品0.01 mg/kg,进入手术室,右美托咪定组所有患儿从麻醉诱导开始,10 min内静脉泵入剂量为1 μg/kg的右美托咪定(江苏恒瑞医药股份有限公司),随后以0.5 μg/(kg·h)维持。对照组患儿予以等容量的生理盐水。两组患儿均采用相同的麻醉诱导及维持方法:静脉注射咪达唑仑0.05 mg/kg、阿曲库铵0.5 mg/kg、芬太尼3 μg/kg、丙泊酚1 mg/kg,诱导后行气管插管接Ohmeda麻醉机容量控制模式通气,潮气量10 ml/kg,吸呼比1∶2,呼吸频率20~30次/min,维持PetCO2于35~40 mmHg。术中恒速输注丙泊酚(AstraZeneca,意大利)4~6 mg/(kg·h)、瑞芬太尼(湖北宜昌人福药业)0.1~0.2 μg/(kg·min)、持续吸入1% ~2%七氟醚并间断静注阿曲库铵维持麻醉。分别根据患儿HR、BP调整静脉麻醉用量,使血流动力学变化幅度在基础值的20%以内。两组患儿在气腹操作结束时停用静脉麻醉药,术中气腹压为8 ~12 cmH2O,术中静脉维持液均使用乳酸林格氏液按4∶2∶1补液量补充,补液量相同。
1.3监测术中使用Ohmeda麻醉机连续监测心率、血压、脉搏血氧饱和度及呼气末CO2分压(PETCO2)。在麻醉前5 min(T0)、气腹前5 min(T1)、气腹后5 min(T2)、气腹后30 min(T3)及气腹结束后30 min(T4)各时点抽取静脉血6 ml,加入含EDTA抗凝剂管,常温下3000 r/min离心15 min,分离血浆置-20℃冰箱,采用酶联免疫吸附实验(ELISA)方法分批检测E、NE及IL-6浓度,采用快速血糖仪测定GIu浓度。
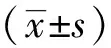
2 结果
2.1两组一般情况两组手术时间、麻醉时间及气腹时间差异无统计学意义(P>0.05);苏醒时间D组明显短于对照组(P<0.05);术中瑞芬太尼、丙泊酚的用量比较差异有统计学意义(P<0.05)。(见表1)。
2.2两组患儿血流动力学的变化与T0比较,C组HR、MAP在T2、T3、T4显著升高,差异有统计学意义,D组HR、MAP各时点差异无统计学意义(P>0.05);组间比较差异有统计学意义(P<0.05)。(见表2)。
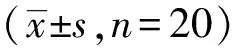
表1 两组患儿术中一般情况的比较
与C组比较,*P<0. 05
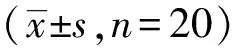
表2 两组患儿术中HR和MAP的比较
与T0比较,*P<0.05;与C组比较,△P<0.05
2.3两组患儿E、NE、Glu、IL-6浓度的变化与T0比较,两组患者T1、T2、T3时E、NE、Glu浓度逐渐升高,T3时达到峰值,T4时下降,但仍然明显高于T0时。与C组比较,D组T1~T4各时点E、NE、Glu浓度明显降低,差异有统计学意义(P<0.05)。
与T0比较,T2~T4各时点C组IL-6浓度逐渐升高,D组T3 、T4时IL-6浓度显著升高;与C组比较,T2~T4各时点均显著降低,差异有统计学意义(P<0.05)。(见表3)。
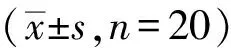
表3 两组患儿各时点E、NE、Glu和IL-6浓度的比较
与T0比较,*P<0.05;与C组比较,△P<0.05
3 讨论
应激反应是指机体受到强烈刺激而发生的以交感神经兴奋和下丘脑-垂体-肾上腺皮质功能增强为主要特点的一种非特异性防御反应。如创伤、失血、缺氧、疼痛、冷热、恐惧、剧烈运动、急性感染和手术麻醉等,均可使下丘脑-垂体-肾上腺皮质轴系及交感神经-肾上腺髓质系统兴奋。因此,减轻应激可缓解机体的免疫抑制,降低术后并发症的发生率,改善高危患者的术后恢复[3]。
本研究选用肾上腺素、去甲肾上腺素水平结合临床血流动力学变化来综合判定应激反应,而且手术刺激可以导致补体激活单核细胞、巨噬细胞和内皮细胞等产生炎性细胞因子,其中IL-6的水平直接反映了手术创伤刺激及损伤程度[4]。同时围术期患者血糖的变化是通过下丘脑-垂体-肾上腺轴而发挥作用的,且血糖变化程度与手术刺激强度正相关[5],所以将血糖和IL-6浓度的改变也选为本研究评价围术期应激反应的指标。
从本研究结果看出,两组患儿年龄、体重、性别、手术时间、麻醉时间及气腹时间差异无统计学意义;D组全麻镇痛药物需求量减少,术中瑞芬太尼、丙泊酚的用量及苏醒时间两组比较差异有统计学意义,这与Peden等人研究结果一致[6,7]。这表明由于右美托咪定的使用减少了术中全麻镇痛药物的用量,避免加深麻醉,同时减轻了患儿肝肾代谢负担,降低临床上出现术后苏醒延迟、呼吸抑制等不良反应的发生率。随着麻醉和气腹的开始,C组HR、MAP在术中各时点升高,均在T3时点达到最大值,气腹结束后30 min即T4时点降低,与麻醉前比较差异有统计学意义;D组T1、T2、T3时点MAP升高,但与麻醉前比较差异无统计学意义,这是因为盐酸右美托咪定的作用使突触后受体激活,降低交感活性,从而有效抑制麻醉和手术刺激引起的交感神经系统兴奋,起到稳定心血管系统的作用[8]。
本研究结果显示,两组患儿T0时肾上腺素、去甲肾上腺素、血糖和IL-6浓度水平比较差异无统计学意义。二氧化碳气腹建立时和建立后,由于机体的应激反应激活了交感神经、下丘脑、肾素-血管紧张素-醛固酮系统,使儿茶酚胺释放增加,肾素-血管紧张素系统活动性增强[9]。同时在应激状态下,促炎性细胞因子IL-6通过肾上腺素受体的介导促进促肾上腺皮质激素释放激素的分泌,进而激活下丘脑-垂体-肾上腺轴[10]。本研究发现,与T0时比较,两组患儿气腹后5 min和气腹后30 min肾上腺素、去甲肾上腺素、血糖和IL-6浓度均显著升高,与C组比较,D组升高幅度相对较小,差异有统计学意义。这说明全麻腹腔镜气腹期间持续应用盐酸右美托咪定可能是通过对下丘脑-垂体-肾上腺轴的作用,也可能使突触后受体激活,产生镇痛、镇静作用,降低交感活性,从而有效地抑制手术刺激引起的交感神经系统兴奋,减轻应激反应[11]。
综上所述,全麻期间持续应用盐酸右美托咪定能有效维持血液动力学的稳定,降低围术期患者血糖、血浆肾上腺素、去甲肾上腺素和IL-6水平的升高,在一定程度上减轻了机体的应激,盐酸右美托咪定应用于小儿腹腔镜手术具有一定优势。
[1]McHoneyM C,Corizia L,Eaton S,et al.Laparoscopic surgery in children is associated with an intraoperative hypermetabolic response[J].SurgEndosc,2006,20(3):452-457.
[2]Mandel J E,Tanner J W,Lichtenstein G R,et al.A randomized, controlled, double-blind trial of patient controlled sedation with propofol/remifentanil versus midazolam/fentanyl for colonoscopy[J].Anesth Analg,2008,106:434-439.
[3]Tan J A,Ho K M.Use of dexmedetomidine as a sedative and analgesic agent in critically ill adult patients: a meta-analysis[J].Intensive Care Med,2010,36:926-939.
[4]Sheeran P, HallG M. Cytokines in anaesthesia[J].Br J Anaesth,1997,78(2):201-219.
[5]C téA L,Zhang P,O’Sullivan J A,et al.Stimulation of the glucocorticoid-induced TNF receptor family-related receptor on CD8 T cells induces protective and high-avidity T cell responses to tumor-specific antigens[J].J Immunol,2010(24).
[6]Peden CJ,Cloote AH,Stratford N,et al.The effect of intravenous dexmedetomidine p remedication on the dose requirement of p ropofol to induce loss of consciousness in patients receiving alfentanil[J].Aaesthesia,2001,56:408-413.
[7]YildizM,Tavlan A,Tuncer S,et al.Effect of dexmedetomidine on haemodynamic responses to laryngoscopy and intubation : perioperative haemodynamics and anaesthetic requirements[J].D rugs R D, 2006,7:43-52.
[8]Wilkins B W,Hesse C,Charkoudian N,et al.Autonomic cardiovascular control during a novel pharmacologic alternative to ganglionic blockade[J].Clin Pharmacol Ther,2008,83:692-701.
[9]Leary EO,Hubbard K,Tormney W,et al. Laparoscopic cholecystectomy: haemodynamic and neuroendocrine response after pneumoperitoneum and changes in position[J].Br J Anaesth,1996,76:640-644.
[10]Costello N L,Bragdon E E,Light K C,et al.Temporomandibular disorder and optimism:relationships to ischemic pain sensitivity and interleukin-6[J].Pain,2002,100(1-2):99-110.
[11]Venn R M,Bryant A,Hall G M,et al. Effects of dexmedetomidine on adrenocortical function, and the cardiovascular, endocrine and inflammatory responses in post-operative patients needing sedation in the intensive care unit[J].BrJ Anaesth,2001,86:650-656.
