miR-133a在急性髓系细胞白血病中的表达及意义
2012-01-13吕艳薛向阳林茂王冰冰李宝青王志斌张丽芳
吕艳,薛向阳,林茂,王冰冰,李宝青,王志斌,张丽芳
(1.温州医学院 微生物学和免疫学教研室,传染病与疫苗研究所,浙江 温州 325035;2.温州医学院附属第二医院 检验科,浙江 温州 325027)
miR-133a在急性髓系细胞白血病中的表达及意义
吕艳1,薛向阳1,林茂1,王冰冰1,李宝青2,王志斌1,张丽芳1
(1.温州医学院 微生物学和免疫学教研室,传染病与疫苗研究所,浙江 温州 325035;2.温州医学院附属第二医院 检验科,浙江 温州 325027)
目的:探讨miR-133a在急性髓系细胞白血病(AML)骨髓有核细胞中的表达及意义。方法:收集37例AML初诊患者及25例化疗后完全缓解患者、12例急性淋巴细胞白血病(ALL)初诊患者和22例骨髓象正常的发热患者的骨髓标本。分离有核细胞,抽提总RNA,以U6为内参,采用实时荧光定量茎环RTPCR检测并比较AML、ALL及骨髓象正常的非白血病患者骨髓有核细胞中miR-133a的表达,同时比较miR-133a在AML常见亚型及化疗缓解前后的表达水平。结果:miR-133a在AML初诊患者骨髓中相对表达量(N=2-△Ct)明显高于ALL和非白血病患者(P<0.05);M3、M4及M5三种常见AML类型中,M5患者的骨髓标本miR-133a表达明显高于M3患者(P<0.05);AML化疗完全缓解后骨髓有核细胞中miR-133a的表达较化疗前明显下降(P<0.05)。结论:miR-133a可能参与AML的发生发展进程,其骨髓表达水平可为化疗敏感性评价提供一个新的指标。
微小RNA;微小RNA133a;白血病,髓样,急性
MicroRNA(miRNA)是长度约22 nt的内源性短链RNA,它通过和编码蛋白质的mRNA互补结合,沉默其表达,从而起到调控细胞的分化、生长、发育、增殖、代谢、凋亡等功能[1-4],并可作为肿瘤抑制或促进因子参与肿瘤的发生过程[5]。最近研究发现,miR-133a在肿瘤组织中存在明显差异表达,可能参与多种肿瘤的发生发展[6-8]。但miR-133a与白血病的关系少有研究。本研究通过茎环RT-实时定量PCR方法检测急性髓系细胞白血病(acute myeloid leukemia,AML)、急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)及非白血病(none leukemia,NL)患者骨髓有核细胞中miR-133a的表达水平,分析AML中常见的M3型、M4型和M5型之间miR-133a表达的差异及化疗缓解前后的变化,探讨miR-133a在AML中的表达情况及其临床意义。
1 对象和方法
1.1 研究对象 2008年10月至2009年7月,选择温州医学院附属第二医院血液肿瘤科确诊的37例AML患者(年龄27~65岁,中位年龄41岁)的初诊骨髓,包括2例M2型、7例M3型、15例M4型、12例M5型及1例M7型。AML化疗后完全缓解患者25例(年龄32~73岁,中位年龄42岁)的骨髓,包括2例M2型、5例M3型、10例M4型及8例M5型。ALL初诊骨髓标本12例,包括6例ALL1和6例ALL2,年龄16~58岁,中位年龄38岁。选择22例骨髓象正常的发热患者作为NL骨髓对照,年龄18~75岁,中位年龄42岁。骨髓标本经红细胞裂解液处理后,加Trizol(购自Invitrogen公司)彻底溶解,-80 ℃保存。
1.2 方法
1.2.1 RNA抽提:按Trizol试剂说明书抽提样品总RNA,为增加小RNA得率,异丙醇沉淀步骤改为-20 ℃沉淀2 h以上。焦碳酸二乙酯(diethypyrocarbonate,DEPC)处理水溶解RNA,分光光度计测定260 nm及280 nm吸光值,确定RNA溶液浓度和纯度。取2~5μg总RNA以1%琼脂糖变性凝胶电泳检测RNA的完整性。
1.2.2 miR-133a表达分析:参照文献[9-11]的实时荧光定量茎环RT-PCR miRNA检测方法,以U6为内参分析miR-133a表达。PCR所用引物由上海英骏生物技术有限公司合成,其序列见表1。1μg总RNA以miR-133a茎环RT引物进行逆转录。为准备实时荧光定量PCR内参模板cDNA,用相同的总RNA标本以U6 RT引物为逆转录引物进行逆转录。逆转录反应体系为1μg总RNA、50 nmol/L miR-133a茎环RT引物(或U6 RT引物)、2 U RNase inhibitor、5 U M-MLV逆转录酶、0.5 μmol/L dNTP。反应条件为:16 ℃ 30 min,42 ℃ 30 min,75 ℃ 15 min,反应结束后-20 ℃保存。以15μL反应体系进行实时荧光定量PCR。实时荧光定量PCR检测反应体系包括:1μL RT产物,1×SYBR Green I Mastermix,0.5μmol/L miRNA特异前向引物、0.5μmol/L通用的反向引物。实时荧光定量PCR条件为:95 ℃ 10 min后,95 ℃ 15 s,60 ℃ 1 min,40循环。实时荧光定量PCR使用Applied Biosystems 7500仪器进行。所有样品做3复孔。PCR产物经8% PAGE电泳分析。记录每个反应管中的荧光信号到达所设定的域值时所经历的循环数即Ct值,以U6作为内参照,采用定量PCR中的相对定量法,以N=2-△Ct表示目的基因的表达相对于内参的变化倍数,其中△Ct=CtmiRNACtU6。为增加数据直观性,所有数据均放大103倍。1.3 统计学处理方法 miRNA表达数据以中位数和四分位数间距表示。采用SPSS16.0统计软件的非参数Mann-Whitney U检验(两组)和Kruskal-Wallis H检验(多组)进行统计处理,P<0.05为差异有统计学意义。
2 结果
2.1 miR-133a在AML、ALL初诊患者及NL患者骨髓有核细胞中的表达 如图1所示,miR-133a及U6的实时荧光定量PCR产物溶解曲线均为单峰,8% PAGE电泳显示PCR产物为单一条带(见图1下),说明茎环RT-PCR能特异扩增相应的miRNA。以U6为内参,miR-133a在AML初诊患者骨髓中相对表达量(N=2-△Ct)为1.35(0.73,3.89),在ALL初诊患者骨髓中相对表达量为0.12(0.09,0.21),在NL患者骨髓中相对表达量为0.41(0.23,0.56),经检验,miR-133a在AML初诊患者骨髓中的表达明显高于ALL和NL患者,差异有统计学意义(P<0.01),见图2。2.2miR-133a在3种AML亚型骨髓有核细胞中的表达 如图3所示,miR-133a在M3、M4及M5患者的骨髓标本表达分别为0.83(0.65,1.16)、1.64(0.76,5.02)及2.93(1.33,4.60)。统计分析显示,M4患者和M3及M5患者miR-133a表达差异无统计学意义(P分别为0.130和0.696),但miR-133a在M3和M5患者中的表达差异有统计学意义(P=0.022)。
2.3 miR-133a在AML化疗缓解前后骨髓有核细胞中的表达 如图4所示,AML化疗完全缓解后骨髓有核细胞中miR-133a的表达明显下降(P=0.004),表达中位数从初诊的1.35降低到化疗后的0.49。

图1 miR-133a及U6内参实时荧光定量PCR溶解曲线和PCR产物8% PAGE电泳

图2 miR-133a在AML、ALL初诊患者及NL患者骨髓有核细胞中的表达
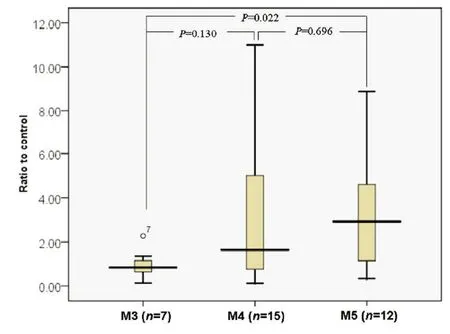
图3 3种AML亚型骨髓有核细胞中miR-133a的表达水平
3 讨论
与其他肿瘤一样,AML的发生发展也是一个多基因改变的过程。以往的研究大多集中在编码蛋白的癌基因或抑癌基因上,近年来新发现的一类内源性微小RNA,即miRNA,它不编码蛋白质,通过碱基配对决定mRNAs的翻译和稳定性,从而调控细胞的分化、生长、发育、增殖、代谢、凋亡等功能[2]。miRNA可以通过其存在、缺失和表达水平的改变影响造血细胞谱系的选择和分化[22],参与血液肿瘤的发生和发展[12-18,21,24]。有研究发现,miRNA的失调表达与AML患者细胞遗传学及治疗结果有关,高表达的miR-191和miR-199a跟生存期短及无病生存率低有显著的关系[19]。
miR-133a是肌肉组织特异性miRNA,在控制心脏发育中起重要作用[20]。研究发现,miR-133a可作为抑癌基因参与膀胱癌和食管癌的发生发展[6-7]。迄今,miR-133a在白血病患者中的表达及作用鲜见研究报道。为此,本研究选择患者骨髓有核细胞进行分析。以U6为内参,应用实时荧光定量茎环RT-PCR技术首先检测了AML、ALL初诊患者及骨髓象正常的发热患者骨髓有核细胞miR-133a的表达,结果显示miR-133a在AML中明显高表达。由于AML和ALL的预后不同,因此有效区分AML和ALL将有助于临床的治疗。Mi等[23]报道在AML和ALL中表达差异最显著的4个miRNAs是miR-128a、miR-128b、let-17b和miR-223,而其中任意两个miRNA都可以准确、有效地区分97%~100%的AML和ALL患者,这为临床AML和ALL的分类和诊断提供了新的标记。我们通过比较发现,AML的miR-133a表达水平远高于ALL,提示miR-133a或许可以辅助性地作为AML和ALL分类和诊断的标记物。
本研究分析所选择的M3、M4、M5三种常见的AML型别间miR-133a表达,结果显示,miR-133a表达在M3(急性早幼粒细胞白血病)及M5(急性单核细胞白血病)存在显著差异。进一步分析化疗缓解前后miR-133a表达的变化,结果显示化疗缓解后miR-133a的表达明显下调,提示miR-133a可能类似癌基因参与AML发生发展进程。化疗药物可部分直接或间接通过调节miR-133a的表达,但由于标本量较少,我们的实验数据尚无法说明这种下调的程度是否与患者的预后有关,还需更大的标本做随访性研究。
综上所述,本研究表明,miR-133a在AML患者的骨髓有核细胞中表达明显上调,不同类型的AML表达存在差异,且经化疗缓解后miR-133a的表达下调,提示,miR-133a可能参与AML的发生发展进程,其骨髓表达水平可为化疗敏感性评价提供一个新的指标。
[1] Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006):350-355.
[2] Bartel DP. MicroRNAs:genomics, biogenesis, mechanism,and function[J]. Cell, 2004, 116(2):281-297.
[3] Plasterk RH. MicroRNAs in animal development[J].Cell, 2006, 124(5):877-881.
[4] Poy MN, Spranger M, Stoffel M. microRNAs and the regulation of glucose and lipid metabolism[J]. Diabetes Obes Metab, 2007, 2:67-73.
[5] Chen CZ. MicroRNAs as oncogenes and tumor suppressors[J]. N Engl J Med, 2005, 353(17):1768-1771.
[6] Kano M, Seki N, Kikkawa N, et al. miR-145, miR-133a and miR-133b:Tumor suppressive miRNAs target FSCN1 in esophageal squamous cell carcinoma[J]. Int J Cancer Suppl,2010, 127(12):2804-2814.
[7] Chiyomaru T, Enokida H, Tatarano S, et al. miR-145 and miR-133a function as tumour suppressors and directly regulate FSCN1 expression in bladder cancer[J]. Br J Cancer,2010,102(5):883-891.
[8] Uchida Y, Chiyomaru T, Enokida H, et al. MiR-133a induces apoptosis through direct regulation of GSTP1 in bladder cancer cell lines[J]. Urol Oncol, 2011, [Epub ahead of print].
[9] 武文一, 沈贤, 薛向阳, 等. 胃癌组织miR-125a-5p和miR-125a-3p表达及其与临床病理特征的关系[J]. 温州医学院学报, 2010, 40(3):213-217.
[10] 李宝清, 薛向阳, 夏轶姿, 等.miR-221和miR-222在急性髓细胞白血病初发患者中的表达研究[J]. 医学研究杂志, 2011,(6):110-113.
[11] 李巧爱, 李玲玲, 巩文词, 等. miR-143在胃癌中的表达及其临床病理意义[J]. 中国病理生理杂志, 2010, 26(9):1674-1678.
[12]Vasilatou D, Papageorgiou S, Pappa V, et al. The role of microRNAs in normal and malignant hematopoiesis[J]. Eur J Haematol, 2010, 84(1):1-16.
[13]Pelosi E, Labbaye C, Testa U. MicroRNAs in normal and malignant myelopoiesis[J]. Leuk Res, 2009, 33(12):1584-1593.
[14]Bryant A, Lutherborrow M, Ma D. The clinicopathological relevance of microRNA in normal and malignant haematopoiesis[J]. Pathology, 2009, 41(3):204-213.
[15]Garzon R, Croce CM. MicroRNAs in normal and malignant hematopoiesis[J]. Curr Opin Hematol, 2008, 15(4):352-358.
[16]Fabbri M, Garzon R, Andreeff M, et al. MicroRNAs and noncoding RNAs in hematological malignancies: molecular,clinical and therapeutic implications[J]. Leukemia, 2008,22(6):1095-1105.
[17]Kluiver J, Kroesen BJ, Poppema S, et al. The role of microRNAs in normal hematopoiesis and hematopoietic malignancies[J].Leukemia, 2006, 20(11):1931-1936.
[18]Havelange V, Garzon R, Croce CM. MicroRNAs:new players in acute myeloid leukaemia[J]. Br J Cancer, 2009, 101(5):743-748.
[19]Garzon R, Volinia S, Liu CG, et al. MicroRNA signatures associated with cytogenetics and prognosis in acute myeloid leukemia[J].Blood, 2008, 111(6):3183-3189.
[20]Liu N, Bezprozvannaya S, Williams AH, et al. microRNA-133a regulates cardiomyocyte proliferation and suppresses smooth muscle gene expression in the heart[J]. Genes Dev,2008, 22(23):3242-3254.
[21]Wieser R, Scheideler M, Hackl H, et al. MicroRNAs in acute myeloid leukemia:expression patterns, correlations with genetic and clinical parameters, and prognostic significance[J]. Genes Chromosomes Cancer, 2010, 49(3):193-203.
[22]Shivdasani RA. MicroRNAs:regulators of gene expression and cell differentiation[J]. Blood, 2006, 108(12):3646-3653.
[23]Mi S, Lu J, Sun M, et al. MicroRNA expression signatures accurately discriminate acute lymphoblastic leukemia from acute myeloid leukemia[J]. Proc Natl Acad Sci USA, 2007,104(50):19971-19976.
[24] 沈秋丹, 缪扣荣, 徐卫, 等. 微小RNA与急性白血病[J]. 中华血液学杂志, 2009(6):426-428.
Expression and significance of miR-133a in acute myeloid leukemia
LV Yan*,XUE Xiangyang,LIN Mao,WANG Bingbing,LI Baoqing,WANG Zhibing,ZHANG Lifang.
*Department of Medical Microbiology and Immunology,Institute of Molecular Virology and Immunology,Wenzhou Medical College,Wenzhou,325035
Objective:To probe the expression and clinical significance of miR-133a in the marrow of acute myeloid leukemia(AML).Methods:Marrow tissues from 37 AML patients before chemotherapy,25 AML patients with complete remission(CR)after chemotherapy, 12 acute lymphoblastic leukemia(ALL)patients before chemotherapy and 22 non-leukemia(NL) fever patients with normal bone marrow picture were collected. Total RNA from nucleated cells of these samples were extracted and analyzed for miR-133a expression by stem-loop RT real-time-PCR based on the SYBR Green I. The differences in M3,M4 and M5 patients and the change of miR-133a expression in before- and after-chemotherapy AML patients were further analyzed.Results:Expression levels of miR-133a were significantly higher in marrow tissues of AML patients before chemotherapy than that in those of all patients before chemotherapy and nonleukemia patients(P<0.05). The expression of miR-133a in the marrow tissues of M5-type patients was significantly higher than that in M3-type AML(P<0.05). Compared to beforechemotherapy patients,the expression levels of miR-133a in the AML patients with complete remission(CR)after chemotherapy decreased significantly(P<0.05).Conclusion:MiR-133a may play an important role in the development and progression of AML and the level of miR-133a expression may be a potential biomarker for the sensitivity of AML treatment.
microRNA;miR-133a;leukemia,myeloid,acute
R733.71
A
1000-2138(2012)06-0517-05
2012-03-21
浙江省教育厅科研基金资助项目(Y200907403);温州市科技局科研基金资助项目(Y20090103)。
吕艳(1985-),女,安徽宿州人,硕士生。
张丽芳,教授,博士生导师,Email:wenzhouzlf@126.com。
丁敏娇)
·论 著·
