反复冻结-解冻对黄鳍金枪鱼肉品质的影响*
2012-01-12叶伏林顾赛麒刘源王锡昌
叶伏林,顾赛麒,刘源,王锡昌
(上海海洋大学食品学院,上海,201306)
金枪鱼(tuna)也称鲔鱼、吞拿鱼,是一种生活在中上层水域的高度跨洋性洄游鱼类,金枪鱼具有高蛋白、低脂肪的特点,被誉为现代人不可多得的营养美食[1]。金枪鱼在国际贸易中主要以罐装和生鱼片为交易形式,具有很高的经济价值[2-3]。
为了长期保持金枪鱼肉的高品质,其贮藏温度一般要求在 -50℃以下[4]。但在生产、加工、运输、贮藏、销售等过程中,由于受外界条件制约,并不能严格保证金枪鱼肉始终处于此温度下,容易发生因温度波动而使产品部分解冻的现象;此外,市场上一些商家也常常将一次未销售完的金枪鱼肉冻藏后再销售,而普通消费者根本对此无从辨别。据报道,反复冻结-解冻循环会使鱼肉组织发生汁液流失、蛋白变性、脂肪氧化等变化,从而导致鱼肉整体重量减少、色泽变差及质地劣变,故应尽量避免此过程的发生。本文以黄鳍金枪鱼腹肉为试验对象,研究反复冻结-解冻条件下其品质的变化规律,期望对市场监管部门及金枪鱼销售企业具有一定的指导意义。
1 材料与方法
1.1 材料与仪器
黄鳍金枪鱼腹肉,购于远洋股份有限公司,于斐济岛捕捞后直接冻藏(-60℃)。
TA.XT Plus质构仪,英国SMS公司;JZ-Ⅱ型均质器,天津四方电器设备厂;SW-CJ-1CU双人单面超净工作台,上海松泰净化科技有限公司;BagMixer 400W型拍打式均质器,法国INTERSCIENCE公司;Fox-4000气味指纹分析仪(电子鼻)、HS100电子鼻配套自动进样器,法国Alpha MOS公司。
1.2 样品预处理
将购得四分割的金枪鱼块超净台中切割成梯形块,质量为(500.0±20.0)g,立刻真空包装后分别贮藏在-60℃、-18℃的冰箱中待用。
冻藏金枪鱼解冻至中心温度-5℃时进行品质分析,黄鳍金枪鱼肉解冻流程详见图1。
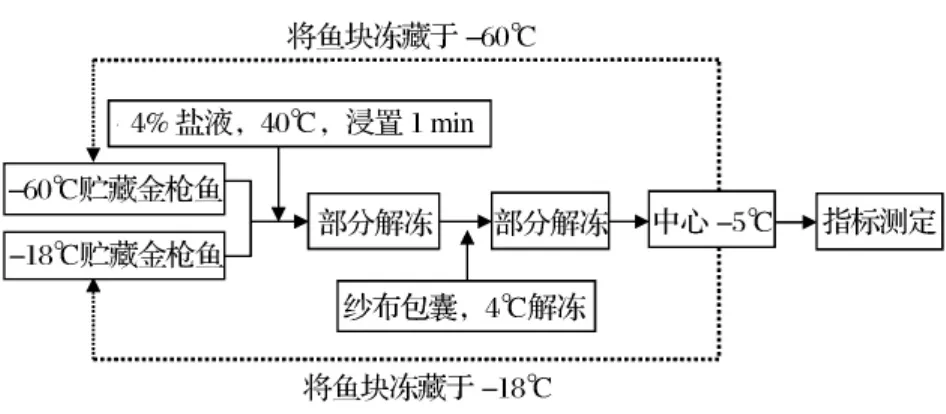
图1 黄鳍金枪鱼块解冻工艺流程图[5]
反复冻结-解冻设计:-60℃金枪鱼解冻至-5℃(以鱼块中心温度为标准),再冻结至-60℃,记为“1”次冻结-解冻循环,重复此循环3次,分别记为“2,3,4次”,共计4次循环;-18℃设计同 -60℃。
进行冻结-解冻循环时首先将金枪鱼块在40℃、4%的盐水中浸置1 min是为了缩短整体解冻时间,后期试验时将切除鱼体表层肉样,此时鱼体内部肉样还处于冻结状态;以-5℃作为解冻终点温度主要基于以下考虑:因金枪鱼一般以生食为主,市场上商家销售金枪鱼时通常将解冻终温控制为稍高于肉样冰点的温度,以便于金枪鱼经一段时间送到消费者面前时能保持刚解冻完全的高品质状态,故本试验同样设置-5℃为解冻终温。
1.3 测定指标
1.3.1 理化指标
1.3.1.1 解冻汁液流失率
参照 Boonsumrej[6]等人方法。

1.3.1.2 色差
取黄鳍金枪鱼肉切成约15 mm×15 mm×10 mm的规格,选用直径10 mm的透镜,在反射模式下测定红度值(a*值)变化。
1.3.1.3 质构特性
将鱼肉切成25 mm×25 mm×10 mm的规格,并按垂直于厚度的方向平放。测定条件为:探头型号P25;测前速率1.0 mm/s;测试速率5.0 mm/s;测后速率5.0 mm/s;压缩变形率75%;探头2次测定间隔时间5.00 s;数据采集速率400.00 Hz;触发强度5.0g;触发类型:自动。分别测定硬度、黏聚性、弹性和咀嚼性。
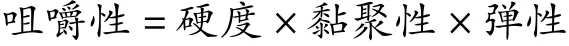
1.3.2 电子鼻分析
参照王锡昌等[5]方法,并稍作修改。将解冻后的金枪鱼肉绞碎,准确称取2.00 g±0.01 g,立即装入10 mL电子鼻自动进样瓶中,封盖后待测。各组于37℃平衡10 min后以洁净空气为载气,流速150 mL/min,进样体积为 2 000 μL,1 s进样完毕,注射针温度47℃,数据采集时间120 s,延滞时间10 min。
1.3.3 菌落总数
按照GB/T 4789.2-2010测定。
1.3.4 数据处理
所有值均用平均值±标准偏差表示,理化指标和菌落总数平行测定3次,结果用SPASS13.0处理。电子鼻平行测定5次,PCA数据分析由仪器自带的AlphaSoft V11.0软件处理,以传感器的最大响应值作为特征值。
2 结果与分析
2.1 冻结-解冻后理化指标的变化
2.1.1 解冻汁液流失率和红度值a*的变化
汁液流失是冻藏肉制品解冻时发生的一种不可避免的现象。冻藏时由于温度下降至冰点以下,组织细胞内部会产生大小不一的冰晶,从而对细胞膜结构造成机械损伤;而解冻过程中由于细胞膜已被破坏,细胞液中一些营养组分(可溶性蛋白等)随之溶出,宏观上表现为组织的汁液流失[7]。冻结-解冻过程会伴随温度的降低或升高,温度的降低或升高会引起冰晶的重结晶,解冻后导致鱼肉汁液流失。由图2(a)可见,-60℃和-18℃贮藏金枪鱼肉随着冻结-解冻次数的增加,解冻汁液流失率都呈现上升趋势;另一方面,-60℃比-18℃贮藏下金枪鱼解冻后的汁液流失更多。本实验所采用的冻结方法在较短时间内到达贮藏温度,冻结过程中主要有细胞间的水分和细胞内的水分参与重结晶,而快速到达稳定温度使得肌肉快速完成重结晶;浸置于40℃温盐水中1 min后在4℃下解冻,且-60℃持续时间相对较长,解冻过程组织内部的小的冰晶优先溶解,又在周围形成更大更不规则的重结晶,随着解冻的持续,小冰晶周围的重结晶以更快的速度生成。本实验中解冻是导致汁液流失的主要原因,而-60℃解冻时间相对较长,温度变化范围较大,使得汁液流失较多。由于这些重结晶的不规则,分布无规律,导致组织结构的物理变化,引发纤维的脱水,进而引发蛋白质的变性,当解冻完全后,导致更多的汁液流失。黄鸿兵等[8]研究了冻藏过程中温度波动对猪肉肌间冰晶的影响,生物显微镜拍摄组织结果显示温度波动越剧烈,冰晶体积增大幅度越大,组织破坏严重,与本实验结果一致。
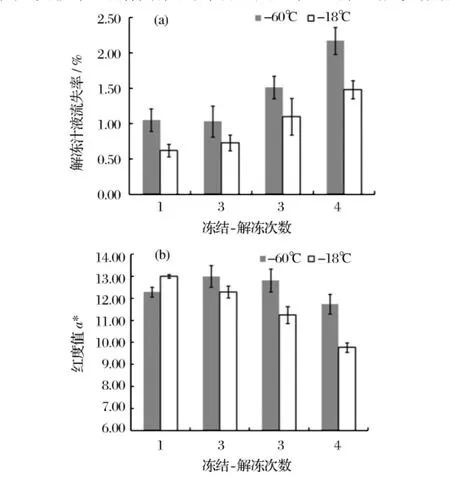
图2 黄鳍金枪鱼反复冻结-解冻后汁液流失率和a*和的变化
颜色对鱼肉自身的营养和风味并无大的影响,其作为鱼肉生理学、生物学和微生物学变化的外部体现,可由感官作用直接给予消费者以好或坏的影响[9]。金枪鱼鱼肉中血红蛋白和肌红蛋白含量较高,故使其呈典型的红色。相对血红蛋白而言,金枪鱼肉中肌红蛋白含量更为丰富,主要有脱氧肌红蛋白(DeoMb,deoxymyoglobin)、氧合肌红蛋白(OxyMb,oxymyoglobin)和高铁肌红蛋白(MetMb,metmyoglobin)3种形式。DeoMb和OxyMb在有O2时会进一步氧化成暗褐色的MetMb——称为鱼肉的“褐变”,其氧化速率往往受到温度、pH值、氧分压、盐类等因素的影响。图2(b)可见,随着反复冻结-解冻的次数增加,-18℃下贮藏的金枪鱼腹肉a*下降趋势更为明显(从13.0降至10.0);而-60℃下腹肉红度值变化较不明显(4次循环a*变化在1以内)。表明-60℃下贮藏金枪鱼肉较-18℃相比,解冻时能够更有效的抑制高铁肌红蛋白的生成,减缓鱼肉的褐变速度,延长金枪鱼肉的品质保持时间。
2.1.2 质构的变化与分析
质构是鱼类等水产品的一个非常重要的评价指标,质构特性包括硬度、弹性、咀嚼性、黏聚性、回复性等。张志广[10]在研究养殖大黄鱼冻藏过程时以硬度和弹性作为评价其品质状况的指标,而本文拟通过硬度、黏聚性、弹性、咀嚼性四项指标来评价冻结-解冻次数对黄鳍金枪鱼品质的影响。
1~4次冻结-解冻循环后,黄鳍金枪鱼腹肉质构特性变化见图3。
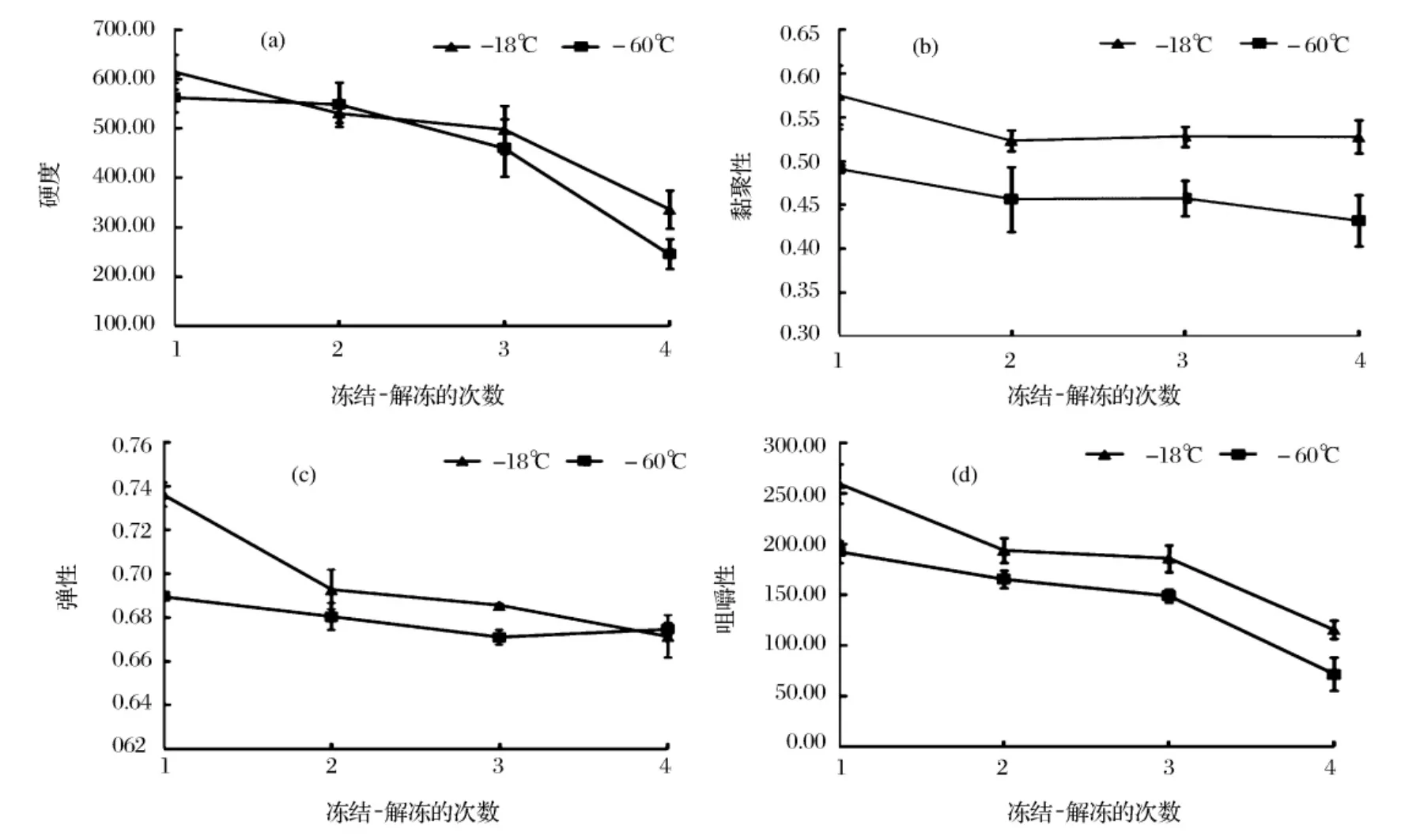
图3 黄鳍金枪鱼肉反复冻结-解冻后质构特性的变化
硬度反映鱼肉保持形状的内部结合力,并受到鱼肉的含水量、蛋白质含量、盐、脂肪含量[11]等影响;弹性反映鱼肉中的蛋白质及其水化层形成的网状结构抵抗外力的能力;黏着性表示当食品表面和其他物体(舌、牙、口腔)附着时,剥离它们所需要的力;咀嚼性是综合评价参数,与硬度、黏着性和弹性有关。金枪鱼富含丰富蛋白质,而蛋白质变化是导致质构特性发生变化的主要原因,蛋白质作为食品的重要组成,不仅具有营养学意义,同时还决定食品的质构和风味等诸多特性。从图3可以看出,随着黄鳍金枪鱼冻结-解冻次数的增加,-60℃和-18℃贮藏黄鳍金枪鱼的硬度、弹性、咀嚼性均明显降低。与李金平等[7]研究反复冻融对牛外脊肉品质的影响结果一致,反复冻融导致牛肉的理化品质下降和蛋白质降解。由前文已知反复冻结-解冻导致重结晶现象,进而促使鱼肉组织结构的物理变化,汁液流失增加,肌纤维破坏,蛋白质降解变性,进而受到硬度、弹性和咀嚼性下降。Sriket[12]等研究黑虎虾和白虾经过反复冻结-解冻后的微观结构,两者的结果都显示剪切力显著减少,这是由于内部肌肉纤维遭到破坏,实验结果表明反复冻结-解冻对虾的质构影响显著。由图3(b)看出,黏聚性在整个过程中没有显著变化,有报道指出黏聚性与淀粉含量正相关。Tsironi[13]研究发现,在冻藏过程中,黏聚性、恢复性等指标变化不显著。
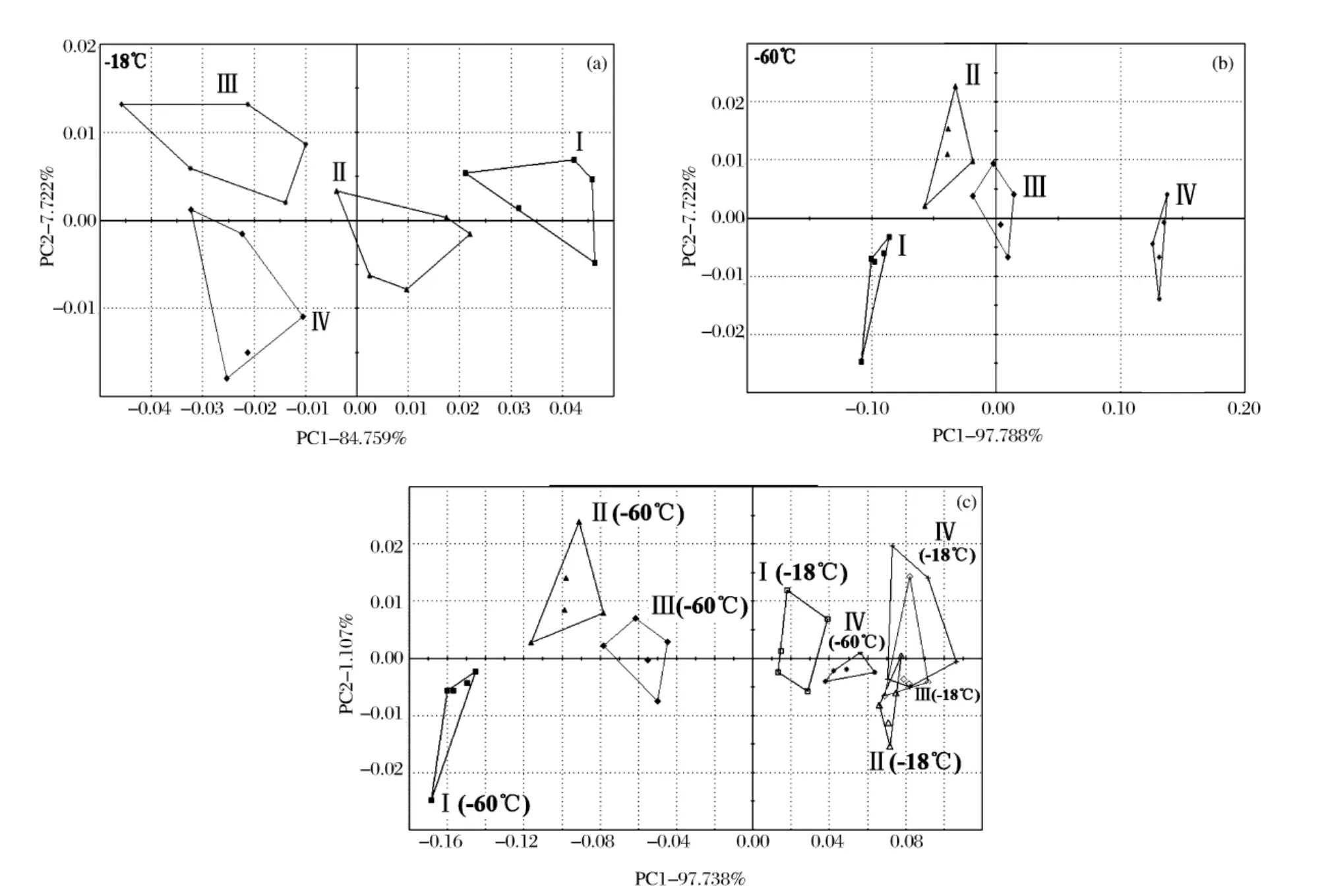
图4 电子鼻分析黄鳍金枪鱼反复冻结-解冻后气味的结果
2.2 挥发性气味物质的变化
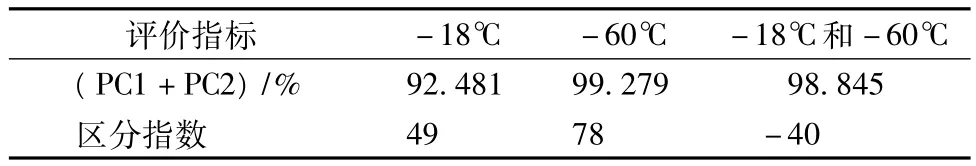
表1 黄鳍金枪鱼样品电子鼻分析结果评价指标
由表1可以看出,-18℃单独、-60℃单独、-18℃和-60℃叠加的3张PCA分析图上,其第一主成分(PC1)+第二主成分(PC2)之和均在90%以上,表明在PC1与PC2构建的平面上,样品信息均能较完整体现。电子鼻数据区分指数(discrimination index,DI值),最高值为100,一般≥75表示此PCA图上不同组样品区分度较好,负值表示组间样品结果有重叠。由表1可知,-60℃下DI值为78,表明此温度下黄鳍金枪鱼腹肉经1、2、3、4次冻结-解冻后,其挥发性气味差异较显著,能够明显区分;-18℃下DI值为49,表明金枪鱼肉分别经过1~4次冻结-解冻后,气味虽勉强能够区分,但差异性较小;-18℃和-60℃综合分析的情况下DI值为-40,表明在此2种温度下,肉样分别冻结-解冻1~4次后,各组样品气味间有重叠。进一步观察图4(c)可发现,造成此时DI值为负的原因,主要是由于-18℃下的后3次冻结-解冻循环,样品气味有重叠造成的(虽然-18℃单独分析时其能勉强分开,但在综合分析时由于引入了-60℃样品导致其PC1、PC2坐标轴已重新计算)。此外,图4(c)中各组样品,随着冻结-解冻次数的增加其PC1轴数值依次递增,且-60℃较-18℃相比,此温度下冻结-解冻1~4次的样品挥发性气味变化更大(PC1数值跃变程度更大)。目前,金枪鱼贮藏温度一般要求保持在-60℃下,由以上试验可以看出,若此温度下发生反复冻结-解冻等剧烈变温的情况,对金枪鱼肉的品质将造成更大的损害。国内顾赛麒等学者[14]采用电子鼻研究了冷却猪肉在5种温度( -18、0、4、10、20℃)下新鲜度变化规律,表明电子鼻可检测肉样在不同温度下贮藏期间的气味变化,来判断肉品品质变化状况。
2.3 菌落总数
食用安全性是对水产品类进行品质评价前所需满足的最基本要求,菌落总数则是判定水产品所受污染程度的最重要指标。对于金枪鱼这一主要以生食为主的高价值鱼类,在保持其原有品质的同时,保证其食用安全性更显得至关重要,此将直接关系到消费者的人身健康安全。我国行业标准要求生食金枪鱼肉中菌落总数含量在1×104CFU/g以下[4]。由图5可见,黄鳍金枪鱼经4次反复冻结-解冻后,其腹肉中微生物指标远远低于此限值,故可充分保证其食用安全性。但值得注意的是,采用不同的金枪鱼解冻方法,其所需的解冻时间各不相同,若鱼肉暴露空气中时间过长、环境温度过高等都会造成菌落总数的超标。本文所采用的金枪鱼块原料初次解冻前均贮藏在-60℃温度下,初始菌数较低;其次整个解冻方法用时约2.5 h,且解冻时鱼块包裹后均置于4℃冷藏库内,因此期间微生物生长繁殖量能够始终在安全范围内。
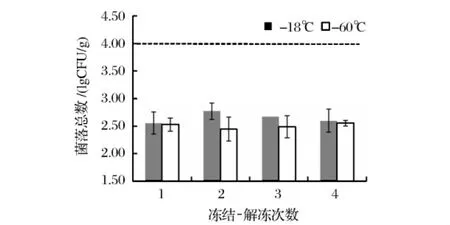
图5 黄鳍金枪鱼肉反复冻结-解冻后菌落总数变化
3 结论
将黄鳍金枪鱼腹肉(分别-18℃,-60℃贮藏)分别经过4次冻结-解冻后,测定理化、挥发性气味物质、菌落总数等相关指标,得到以下结论:(1)随着冻结-解冻次数的增加,解冻汁液流失增加,且-60℃贮藏汁液流失更多;(2)随着冻结-解冻次数的增加,-18℃贮藏a*下降显著,-60℃贮藏变化不明显;(3)随着冻结-解冻次数的增加,硬度、弹性、咀嚼性均显著降低;(4)PCA结果表明,-60℃相对-18℃贮藏下反复冻结-解冻后挥发性气味差异较显著;(5)随着冻结-解冻的次数增加,微生物变化不显著,且在安全范围内。
本试验结果说明反复冻结-解冻导致金枪鱼品质下降,要求我们要在金枪鱼加工、运输和贮藏过程中,严格控制温度稳定,并选择-60℃作为维持品质的较佳贮藏温度。
[1] 苗振清,黄锡昌.远洋金枪鱼渔业[M].上海:上海科学技术文献出版社,2003.
[2] Guizani N,Al-Busaidy M A,Al-Belushi I M,et al.The effect of storage temperature on histamine production and the freshness of yellowfin tuna(Thunnus albacares) [J].Food Research International,2005,38(2):215-222.
[3] Tsironi T,Gogou E,Velliou E,et al.Application and validation of the TTI based chill chain management system SMAS(safety monitoring and assurance system)on shelf life optimization of vacuum packed chilled tuna[J].International Journal of Food Microbiology,2008,128(1):108-115.
[4] SC/T 3117-2006.生食金枪鱼[S].
[5] 王锡昌,刘燕,刘源.大目金枪鱼块温盐水-冷藏库组合解冻工艺的优化[J].农业工程学报,2010,26(7):358-363.
[6] Boonsumrej S,Chaiwanichsiri S,Tantratian S,et al.Effects of freezing and thawing on the quality changes of tiger shrimp(Penaeus monodon)frozen by air-blast and cryogenic freezing[J].Journal of Food Engineering,2007,80(1):292-299.
[7] 李金平,李春保,徐幸莲,等.反复冻融对牛外脊肉品质的影响[J].江苏农业学报,2010,26(2):406-410.
[8] 黄鸿兵,徐幸莲,周光宏.冷冻贮藏过程中温度波动对猪肉肌间冰晶、颜色和新鲜度的影响[J].食品科学,2006,27(8):49 -52.
[9] Foegeding E A,Lanier T C.Characteristics of edible muscle tissues[J].Food Chemistry,1996:879 -942.
[10] 张志广.冷冻对养殖大黄鱼品质影响的研究[D].浙江:工商大学,2010.
[11] Nielsen D ,Hyldig G,Nielsen J,et al.Liquid holding capacity and instrumental and sensory texture p roperties of herring(Clupea harengus L.)related to biological and chemical parameters[J].Journal of Texture Studies,2005,36(2):119 -138.
[12] Sriket P,Benjakul S,Visessanguan W,et al.Comparative studies on chemical composition and thermal properties of black tiger shrimp(Penaeus monodon)and white shrimp(Penaeus vannamei)meats[J].Food Chemistry,2007,103(4):1 199-1 207.
[13] Tsironi T,Dermesonlouoglou E,Giannakourou M,et al.Shelf life modelling of frozen shrimp at variable temperature conditions[J].LWT-Food Science and Technology,2009,42(2):664-671.
[14] 顾赛麒,王锡昌,刘源,等.电子鼻检测不同贮藏温度下猪肉新鲜度变化[J].食品科学,2010,31(06):172-176.
