云南水晶石榴果皮中多酚组分及抗氧化活性分析*
2012-01-12孙丽平张会林杨美智子刘洋铭庄永亮
孙丽平,张会林,杨美智子,刘洋铭,庄永亮
(昆明理工大学化学工程学院,食品工程研究中心,云南 昆明,650500)
石榴(Punica granatum)为石榴科石榴属植物,在我国栽培广泛。云南省蒙自、建水、巧家、呈贡等地的水晶石榴具有生长海拔高、日照时间长的自然优势,营养价值高[1]。目前,云南水晶石榴除鲜销外,主要生产石榴汁原浆,据悉,云南某石榴加工厂一年即可消耗石榴1.25万t,生产石榴汁原浆5 000 t。石榴果皮是加工副产物,占石榴鲜果重的50%左右,研究发现其含有丰富的多酚物质,且抗氧化活性很高,目前,学者已对河北[2]、新疆[3]、陕西[4-5]等地生产的石榴果皮中抗氧化物质进行了研究和报道,但是对云南水晶石榴的研究还很少。本文提取云南水晶石榴皮中的多酚物质,用Folin-Ciocalteu及HPLC法测定其多酚的含量、分析多酚的组成,并测定提取物的还原能力、DPPH自由基清除能力、抑制脂质体过氧化能力和清除亚硝酸能力等体外抗氧化活性。
1 材料与方法
1.1 材料与仪器
采集云南产新鲜水晶石榴,收集果皮,60℃烘干,粉碎,过40目筛,备用。
甲醇,色谱级;大豆卵磷脂、1,1-diphenyl-2-picrylhydrazyl radicals(DPPH·)、没食子酸、芦丁、绿原酸、原儿茶酸、山萘酸、槲皮素、水杨酸、苯甲酸、香兰素、木犀草素、咖啡酸、儿茶素、丁香酸、香豆酸、鞣花酸和阿魏酸,标准品级;其他为试剂为分析纯。
Agilent1200高效液相色谱仪(美国 Agilent公司),TU1901型双光束紫外可见光光度计(北京普析通用仪器有限责任公司),78-1型磁力搅拌器(深圳市国华仪器厂),LXJ-IIB型离心机(上海安亭科学仪器厂),SB-5200DTD超声波清洗器(宁波新芝生物有限公司)等。
1.2 实验方法
1.2.1 多酚的微波辅助提取
准确称取一定量果皮粉,按1∶20(g:mL)料液比,加入体积分数为65%的乙醇溶液,480 W输出功率下微波处理45 s,过滤,取滤液定容至50 mL,制备多酚提取液。
1.2.2 多酚总量的测定[6]
采用Folin-Ciocalteu法测定果皮中多酚含量,以没食子酸为标准品。准确吸取不同浓度没食子酸标准工作液和多酚提取液各1 mL于10 mL试管中,然后依次加入1 mL去离子水,0.5 mL Folin-Ciocalteu试剂,1.5 mL Na2CO3(7.5%)溶液,最后用水定容至10 mL,在50℃水浴下保持10 min,冷却,在760 nm测吸光值。标准工作曲线方程为:y=0.008 6x+0.006 7,R2=0.998 6,其中 y为吸光度,x为没食子酸含量。果皮中多酚含量表达为mg/g(干重)。
1.2.3 多酚组成的测定
将1.2.1制备的多酚提取液进行微孔(0.45 μm)过滤,滤液进行酚类物质组成分析。色谱条件:Agilent1200高效液相色谱仪,配备自动进样器和光电二级阵列检测器;Agilent C18色谱柱(250 mm×4.6 mm i.d.,5 μm);流动相:A甲醇,B 0.3%磷酸溶液;梯度洗脱:0~70 min,A从0% ~100%,100%A保持10 min;流速:1.0 mL/min;柱温:25℃;检测波长:280 nm。不同浓度的没食子酸、芦丁、绿原酸、原儿茶酸、山萘酸、槲皮素、水杨酸、苯甲酸、香兰素、木犀草素、咖啡酸、儿茶素、丁香酸、香豆酸、鞣花酸和阿魏酸建立标准工作曲线,出峰时间定性,峰面积定量,分析提取液中多酚类物质的组成及含量。
1.2.4 提取液抗氧化活性测定
1.2.4.1 还原能力的测定
取1 mL稀释为一定浓度梯度的提取液,加入1 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6)和1 mL 1%铁氰化钾溶液,混匀,50℃水浴20 min,取出,加入1 mL 10%三氯乙酸溶液,混匀,迅速冷却。取1 mL混合液于5 mL离心管中,加入1mL超纯水和0.2 mL 0.1%的三氯化铁溶液,混匀,蒸馏水代替样品为空白,测定溶液在700 nm处的吸光度(A700)。以A700表示样品的还原能力,EC50值表示A700为0.500时多酚的浓度。
1.2.4.2 清除DPPH自由基能力测定
取0.4 mL稀释为一定浓度梯度的提取液,加入2 mL 0.1 mmol/L DPPH甲醇溶液,混匀,暗处放置30 min并不断振荡,在517 nm处测其吸光度。0.4 mL水+2 mL甲醇为空白,0.4 mL蒸馏水代替样品为对照。清除率计算公式为:
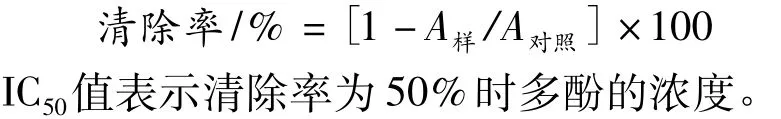
1.2.4.3 抑制脂质体过氧化能力的测定
取1 mL稀释为一定浓度梯度的提取液,依次加入1.0 mL脂质体磷酸盐缓冲液分散系,1.0 mL 40 μm/L 三氯化铁溶液,1.0 mL 400 μm/L L-抗坏血酸,混匀,避光37℃水浴中60 min,再加入2.0 mL三氯乙酸-硫代巴比妥酸-盐酸混合液,沸水浴反应15 min,立即冷却,5 000 r/min离心10 min,取上清液在532 nm下测定吸光值。1 mL蒸馏水代替样品+1 mL磷酸盐缓冲溶液代替脂质体分散体系为空白,1 mL蒸馏水代替样品为对照,抑制率计算公式为:
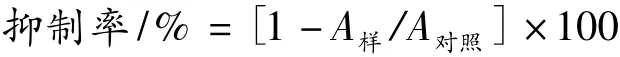
1.2.4.4 亚硝酸盐清除能力的测定
取1 mL稀释为一定浓度梯度的提取液,加入2 mL 5 μg/mL亚硝酸钠溶液,沸水浴30 min,取出,加入1 mL0.4%对氨基苯磺酸,混匀,静置5 min,加入0.5 mL 0.2%盐酸萘乙二胺,混匀,定容至25 mL,静置15 min后,在538 nm处测其吸光度。3 mL蒸馏水代替1 mL样品和2 mL 5 μg/mL亚硝酸钠溶液为空白,1 mL体积分数65%乙醇溶液代替样品为对照,清除率计算公式为:

1.2.5 数据统计方法
每个实验至少3次重复,测定结果表达为平均值±标准偏差。采用SPSS11.5软件对数据进行方差分析,差异显著性水平为P<0.05。
2 结果与讨论
2.1 云南水晶石榴果皮中多酚含量及其组成
云南水晶石榴果皮中的多酚含量及其组成见表1。总酚含量为99.60 mg/g(干重),高于新疆和田产石榴[46.58 mg/g(干重)][3]、陕西汉中产石榴[0.84 mg/g(干重)][5]以及 Singh 等[7]和 Li等[8]报道的石榴果皮中多酚含量(4.13%和7.86%),但低于陕西临潼产石榴(23.68%)[4]。其原因既与种属、产地有关,也与储运及提取方法的不同有关[9]。

表1 云南水晶石榴果皮中总酚含量、多酚组成及其含量
表1结果显示,云南水晶石榴果皮中共检出16种标准品的9种,其中香豆酸、儿茶素和原儿茶酸为主要成分,含量分别为4.80、3.96和1.96 mg/g(干重)。李国秀[4]在陕西产的石榴果皮中未检测到儿茶素,原儿茶酸含量也极低。
2.2 云南水晶石榴果皮多酚提取物的抗氧化活性
多酚类物质具有活泼的多羟基结构,从而具有较强供电子能力,使其成为有效的抗氧化活性成分,但多酚提取物抗氧化能力的强弱与其多酚组成及其配比有关[10]。由图1可以看出,云南水晶石榴果皮多酚提取物表现出很强的抗氧化活性,提取物在其还原能力EC50值时的浓度为23.00 μg/mL,在DPPH自由基清除能力、抑制脂质体过氧化能力和清除亚硝酸能力IC50值时的浓度分别为10.10、350.00和182.00 μg/mL。
由图1相关性分析可知,云南水晶石榴果皮多酚提取物的抗氧化活性与其浓度均在P<0.01水平上显著相关,还原能力、DPPH自由基清除能力、抑制脂质体过氧化能力和清除亚硝酸能力的相关性系数(R2)在0.888 1~0.995 8。与陕西临潼产石榴果皮多酚提取物的抗氧化能力相比[4],本文中云南水晶石榴果皮多酚提取物的还原能力较强,但是对DPPH的清除能力和脂质体过氧化抑制能力较弱,这可能是多酚提取物的组成不同及测定方法不一样[10]。

图1 云南水晶石榴果皮多酚提取物的抗氧化活性及其相关性
3 结论
(1)云南产水晶石榴果皮中富含多酚类物质,其总酚含量为99.60 mg/g(干重)。HPLC法检出提取物中有9种酚类物质,其中香豆酸、儿茶素和原儿茶酸是主要成分,含量分别为4.80、3.96和1.96 mg/g(干重)。
(2)云南水晶石榴果皮多酚提取物表现出很强的抗氧化活性,且多酚提取物的抗氧化活性与其浓度相关性显著(P<0.01),R2分别为0.995 8、0.888 1、0.983 3和0.985 6。结果表明,云南产水晶石榴果皮是一种很好的天然抗氧化物质资源。
[1] 刘家富,周家齐,李晚谊,等.云南蒙自石榴主要成分分析[J].云南农业科技,1995(6):20-23.
[2] 胡淳淳,邵建柱,徐继忠,等.不同石榴品种及器官多酚含量的比较研究[J].河北农业大学学报,2010,33(2):17-20.
[3] 田树革,魏玉龙,刘宏炳.Folin-Ciocalteu比色法测定石榴不同部位总多酚的含量[J].光谱实验室,2009,26(2):341-344.
[4] 李国秀.石榴多酚类物质的分离鉴定和抗氧化活性研究[D].西安:陕西师范大学,2008.
[5] 李志洲,刘海军.石榴皮中多酚类物质的提取及其抗氧化性研究[J].食品与发酵工业,2009,35(11):152-155.
[6] Singleton V L,Rossi J A.Colorimetry of total phenolics with phosphomolybdicphosphotungstic acid reagent[J].A-merican Journal of Enology and Viticulture,1965,16:144-158.
[7] Singh R P,Chidambara Murthy K N,Jayaprakasha G K.Studies on the antioxidant activity of pomegranate(Punica granatum)peel and peed extracts using in vitro models[J].Journal of Agriculture and Food Chemistry,2002,50:81-86.
[8] Li Y F,Guo C J,Yang J J,et al.Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranate pulp extract [J].Food Chemistry,2006,96:254-260.
[9] Thomas-Barberan F,Espin J C.Phenolic compounds and related enzymes as determinants of quality of fruits and vegetables[J].Journal of the Science of Food and Agriculture,2001,81:853-876.
[10] Kalt W,Ryan D A J,Duy J C,et al.Interspecific variation in anthocyanins,phenolics and antioxidant capacity among genotypes of high bush and low bush blueberries(Vaccinium section Cyanococcus spp.) [J].Journal of Agriculture and Food Chemistry,2001,49:4 761 -4 767.
