玉米原料超高浓度酒精发酵
2012-01-12许宏贤段钢
许宏贤,段钢
(杰能科(中国)生物工程有限公司亚太谷物加工酶应用中心,江苏无锡,214028)
由于石油危机而造成的国家能源安全、农民收入和环境等问题而使得生物酒精的生产日益受到重视,近几年发展较快,中国已成为世界上第三大生物酒精生产国。现在工业上的生物酒精绝大部分属第一代燃料乙醇,即用淀粉质原料来生产[1]。据酿酒协会酒精分会的统计,2004年我国酒精生产玉米原料占50.3%,经过近几年的发展,玉米现在已经占到65%[2]。适度发展玉米燃料乙醇有益于粮食供需平衡,依然可以起到玉米供需平衡蓄水池的作用。同时玉米也是深加工链条最长、产品系列最丰富的粮食品种[3],因此相对于其他淀粉质原料,玉米酒精发酵的研究意义更大。
高浓度酒精发酵工艺具有高发酵率、高转化率、低残糖和节约能源等特点,可大幅度增加产量,显著提高经济效益[3-4]。据哈尔滨中国酿酒有限公司的生产实践表明,按年产6万t酒精计算,实施浓醪发酵后年节约一次水12万t,吨酒精节电62.5°,吨酒精节约煤160 kg,年节约资金675万元,减排废水15万t[5]。因此,酒精浓醪发酵是发酵酒精工艺的重大技术进步,已经成为酒精行业清洁生产重点推广的技术之一。
中国开展生料酿酒研究始于20世纪70年代。以节能、减排、高出酒率、高浓度发酵为特点的无蒸煮生料发酵工艺是燃料乙醇生产技术的未来发展方向[1]。近期的研究增多[6-12],商业化过程进展也加快[10]。但相对而言,生料超高浓度酒精发酵的研究并不多[11-12]。
若采取传统的蒸煮工艺进行超高浓度酒精发酵,由于黏度问题,在配料浓度很高的情况下,会造成液化非常不彻底,并且浓醪的换热和输送在工厂会变得异常困难,同时也影响发酵体系的传质,而使过程效率降低[7-8];即便不考虑黏度问题,在这种条件下往往需要特别的耐高糖度、耐高酒度的酵母[13-15]。
生料工艺除了可以节约能量外,由于整个系统中温度远远低于淀粉的糊化温度,没有剧烈的反应,体系黏度比传统过程低得多[7-8],因此可以大幅提高发酵浓度而不必过分担心黏度问题。同时由于生料过程中,葡萄糖是逐步缓慢释放的,因此可以进行浓醪发酵而减轻高初糖浓度和高渗透压对酵母的生长抑制。
相关研究表明,传统的浓醪发酵温度对酵母的生长和发酵效率非常重要[16-18],采用温度梯度培养方式进行的研究近期有所报道[12,19],而针对玉米生料浓醪发酵过程中温度影响的研究尚未见报道,对酵母在不同工艺中的数量和形态的研究也未见报道。本文以玉米为原料,对不同过程的黏度变化与酵母情况进行考察,同时研究不同温度控制方式对玉米超高浓度酒精发酵的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验原料
全磨40目玉米粉,中粮肇东酒精厂试验室提供;安琪牌酿酒高活性干酵母(耐高温型)。
1.1.2 主要酶制剂
颗粒淀粉水解酶(STARGEN 001),酶活力443 GAU/g;高温淀粉酶(SPEZYME ALPHA),酶活力15170AAU/g;糖化酶(GA-L-NEW),酶活力100000wu/g;酸性蛋白酶(FERMGEN),酶活力1000SAPU/g。均为杰能科国际公司产品。
1.1.3 主要试剂
无水乙醇(HPLC),北京色谱中心;葡萄糖(HPLC),Sigma公司;麦芽糖(HPLC),Sigma公司;甘油(HPLC),北京色谱中心;乳酸(HPLC),北京色谱中心;乙酸(HPLC),北京色谱中心;纯水,Millipore制备,纯水电阻18.2 MΩ。
1.2 实验设备
高压液相色谱,Agilent 1100系列;快速黏度仪,Perten RVA 4500;显微镜,OLYMPUS CX40,配DT2000真彩色图像分析系统;Brix计,Mettler Toledo RE40D折光计;天平,Sartorius系列;移液枪,热电(上海)仪器有限公司;酸度计,Mettler Toledo Delta 320系列;冷却电热恒温水浴锅,常州澳华仪器有限公司特制。
1.3 分析方法
1.3.1 醪液黏度测定
Perten RVA 4500快速黏度仪,程序根据试验需求设定,醪液量28.00g。
1.3.2 酵母测定
OLYMPUS CX40显微镜下观察,血球计数板计数,大小由DT2000真彩色图像分析系统分析。
1.3.3 发酵醪组成测定
高效液相色谱法HP1100高效液相色谱仪,HP Chemstations色谱工作站,色谱柱Bio-Rad 87H。色谱分离操作条件(常温下进行)流动相0.01 mol/L H2SO4;流速 0.6 mL/min;柱温 60℃;进样量 20 μL。
1.3.4 乙醇体积分数测定
蒸馏-比重法。
2 结果与讨论
2.1 不同工艺对黏度的影响
生料工艺:取一定量全磨玉米粉,全部通过40目筛(即颗粒度<0.420 mm),测定水分,配制成绝对干物。浓度为35%的玉米醪液,用26%H2SO4将料液pH调整至4.5,加入颗粒淀粉水解酶STARGEN 001 1.5G AU/g,编辑程序如表1所示,取28.00 g醪液进行测量,结果详见图1。可溶性干物用Mettler Toledo RE40D折光计测量,结果如图2所示。
传统工艺:取一定量全磨玉米粉,全部通过40目筛(即颗粒度<0.420 mm),测定水分,配制成绝对干物浓度为35%的玉米醪液,用26%H2SO4将料液pH调整至 5.6,加入高温淀粉酶 SPEZYME ALPHA 0.04%,编辑程序如表1所示,取28.00 g醪液进行测量,结果详见图1。可溶性干物用Mettler Toledo RE40D折光计测量,结果如图2所示。

表1 不同工艺黏度测定程序

图1 玉米超高浓度醪液传统工艺与生料工艺粘度对比
如图1所示,在醪液浓度为35% 的情况下,即便采用生料工艺,即恒定温度32℃,由于醪液非常浓,(按玉米粉水分16%计,料水比达到1∶1.46),醪液的黏度可达530×10-3Pa·s左右。若采取传统工艺,由于反应剧烈,醪液的黏度在整个过程中有着巨大的变化。在50℃预热阶段传统工艺的黏度低于生料工艺32℃的黏度;这是由于流体的黏度从结构上被认为是由于分子间的相互作用力限制分子的运动产生的。这些作用力取决于决定分子自由空间度的分子间的相互距离,同时分子间距受温度影响显著。在较高的温度下,随着分子间距的增加,分子热运动能提高,提供分子跃迁的孔穴增多,流动阻力减小,故体系黏度下降[20];随着温度进一步升高,淀粉颗粒开始迅速膨胀,当温度升高到60~80℃,淀粉颗粒的体积可膨胀到原来的50~100倍,淀粉分子间的作用力减弱,引起淀粉颗粒的部分解体,醪液由原来的固、液两相形成均一的黏稠液体[21],在此糊化过程中,尽管高温淀粉酶SPEZYME ALPHA的添加量达到0.04%,醪液黏度的峰值仍达到9.2 Pa·s以上;在90℃液化过程中,淀粉被酶分子水解,不断变成小的葡萄糖聚合体,醪液黏度显著降低;但在随后的降温过程中,流动阻力不断加大,醪液黏度逐步上升,当醪液温度降至32℃时,黏度值达到2.5 Pa·s以上。在酒精行业,一般认为醪液黏度超过2 Pa·s,会造成过程料液输送困难和发酵传质困难[21],故对于超高浓度35%来讲,糊化、液化变得非常困难,高黏度的液化液会引起一系列的问题,如输送困难,换热效率大大下降,发酵的传质不好从而影响整个工厂的运转等等。

图2 传统工艺与生料工艺玉米超高浓度醪液可溶性干物质对比
如图2所示,传统工艺的可溶性干物达到34.5Brix,生料工艺的可溶性干物仅为6.5Brix,高浓度的可溶性物质会对体系中的渗透压、水活度、溶氧、酵母的活性等各方面产生负面影响,从而不利于发酵的进行。
2.2 不同工艺玉米高浓度酒精发酵
考虑到35%绝干浓度的料液即便是在实验室的研究过程中传质也已经非常困难,故采用绝干浓度为31%的料液对2种工艺进行比较。
生料工艺:取一定量全磨玉米粉,全部通过40目筛(即颗粒度<0.420 mm),测定水分,配制成绝对干物浓度为31%的玉米醪液,用26%H2SO4将料液pH值调整至4.5,加入颗粒淀粉水解酶STARGEN 001 0.785GAU/g,接入0.4%活化好的干酵母于32℃发酵,不同时间取样进行色谱分析结果如表2所示;发酵结束时对酵母显微镜观察,用DT2000真彩色图像分析系统计数并统计大小,结果如图2所示。
传统工艺:取一定量全磨玉米粉,全部通过40目筛(即颗粒度<0.420 mm),测定水分,配制成绝对干物浓度为31%的玉米醪液,用26%H2SO4将料液pH调整至 5.6,加入高温淀粉酶 SPEZYME ALPHA 0.04%,于90℃水浴中维持90 min,取出先粗调pH,灭酶,冷却至室温,并补水至记录的体积以补充在此过程中蒸发的水分,调节pH至4.2,灭酶,添加新型液体糖化酶GA-L-NEW,添加量为0.1%;酸性蛋白酶,添加量0.01%;接入0.4%活化好的干酵母于32℃发酵,不同时间取样进行色谱分析结果见表2。发酵结束时对酵母显微镜观察,用DT2000真彩色图像分析系统计数并统计大小,结果如图3所示。
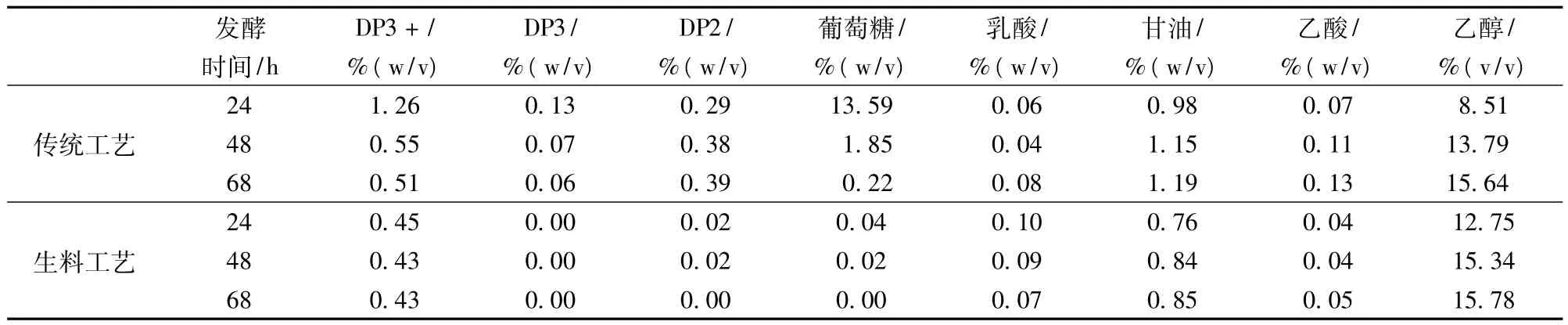
表2 传统工艺与生料工艺HPLC对比
如表2所示,对传统工艺来讲,三糖以上的含量由24 h的1.26%降低到68 h的0.51%,表明随着发酵的进行,糖化酶逐步把糊精/淀粉水解成葡萄糖;三糖的含量也从0.13%降低到0.06%;二糖的含量总体变化不大,发酵结束时有0.39%的残余;葡萄糖的含量变化较大,24h高达13.59%,表明即使采取边糖化边发酵工艺,由于发酵前期糖化酶释放葡萄糖的速度远比酵母将葡萄糖转化为酒精的速度快,会形成一定程度的葡萄糖积累,而相关研究表明,较高的糖浓度会产生底物抑制作用,使酵母生产能力降低[19],随着发酵的进行糖化酶释放出的葡萄糖被酵母逐步转化为酒精,发酵结束时残余的葡萄糖含量为0.22%;而对生料工艺来讲,整个发酵过程中三糖以上几乎没有变化,表明淀粉是在颗粒状态下(完全没有溶出)被生料颗粒酶水解的,麦芽三糖含量始终为0,二糖和葡萄糖的含量在整个发酵过程中一直维持很低水平,发酵结束时均为0,也就是说整个过程中没有糖的累积,酵母始终处于一种饥饿并代谢旺盛的状态,生料酶水解出来的葡萄糖完全被酵母利用;2个工艺的乳酸含量接近,乙酸含量生料工艺略低于传统工艺,表明生料过程没有发生染菌,并且减少了有机酸的产生;值得一提的是。甘油的产量,生料工艺远低于熟料工艺,表明由于生料工艺不会产生可溶性干物质,体系中的渗透压很低,生料过程中酵母细胞内的受氢体乙醛的产生比传统工艺快且多,代谢途径不再朝甘油方向进行,与传统工艺相比,生料过程的副产物大幅降低,由于甘油非常好的保湿性,甘油产量的减少还意味着DDGS干燥过程的改善;生料过程的酒精产量高于传统工艺,这意味着出酒率的提高和粮耗的降低,导致这一结果的原因分析见后。
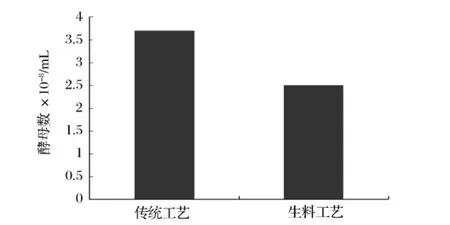
图3 传统工艺与生料工艺发酵终点酵母数对比
如图3所示,发酵结束时传统工艺的酵母数为3.7×108/mL,生料工艺为2.5×108/mL,生料工艺的酵母数比传统工艺少很多,表明生料过程用于合成酵母的糖耗低于传统过程。

图4 传统工艺DT2000真彩色图像分析系统统计
由图4和图5所示,传统过程的酵母平均面积为21.61μm2,生料过程的酵母平均面积为13.21μm2,传统过程有约40%的酵母平均面积大于20.0μm2,生料过程大于20.0μm2的仅为13%左右。传统过程的酵母比生料过程大很多。相关研究表明,在传统工艺中,液化后进行糖化的过程比边糖化边发酵的流加糖过程提供了更高的初糖,但营养过剩反而会造成酵母过快生长,体积较大,后期产生酒精的能力不强[22]。综合色谱结果,在生料过程与传统的边糖化边发酵过程的对比中,发现了相似的现象,传统过程的酵母个头大但产酒能力不如生料过程中个头小的酵母,由此可见,在酒精生产上,在保证酵母菌能达到一定的数量后,酵母菌的个体质量更为关键!
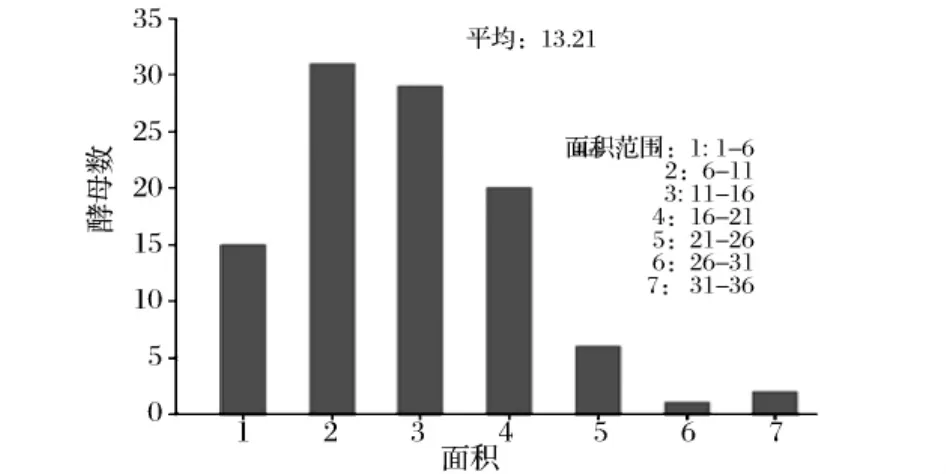
图5 生料工艺DT2000真彩色图像分析系统统计图
综上所述,以下因素可能是导致生料过程的酒精产量高于传统过程的原因:
(1)相关研究表明,玉米中的游离糖含量为1.0% ~3.0%[23],如果采用传统蒸煮过程,这些游离糖有相当量会与蛋白发生反应,或在高温下发生其它变化而变为不可发酵性糖,生料过程由于避免了高温,使这部分糖得以利用;
(2)由于生料工艺不会产生可溶性干物质,体系中的渗透压很低,发酵过程的副产物如甘油、有机酸减少,能使更多的葡萄糖转化成酒精;
(3)生料过程中的酵母数少于传统过程,酵母小于传统过程,表明用于合成酵母的葡萄糖少于传统过程,使得更多的糖转化成酒精。
2.3 温度梯度控制超高浓度酒精发酵
前期相关研究表明[12],对于超高浓度生料酒精发酵,在恒定培养温度条件下,发酵温度越高前期酒精的生产速率越高,但酵母衰老的也越早,酒精的产物抑制也越严重;低温发酵虽然非常有利于发酵后期酒精的生产,但前期产酒较慢,发酵周期偏长。温度梯度控制是实现高强度超高酒精发酵的重要途径。本文将继续探讨温度梯度控制对玉米超高浓度酒精发酵的影响。
生料温度梯度控制工艺:取一定量全磨玉米粉,全部通过40目筛(即颗粒度<0.420 mm),测定水分,配制成绝对干物浓度为35%的玉米醪液,用26%H2SO4将料液pH调整至4.5,加入颗粒淀粉水解酶STARGEN 001 1.5GAU/g,接入0.4%活化好的干酵母,发酵过程中对醪液分别在32、28、25、20℃恒温水浴锅中进行温度梯度控制(详见图6)。不同时间取样用HPLC测定发酵醪组成,发酵结束采样进行蒸馏测定醪液在标准条件下的酒精含量,结果如图7所示。
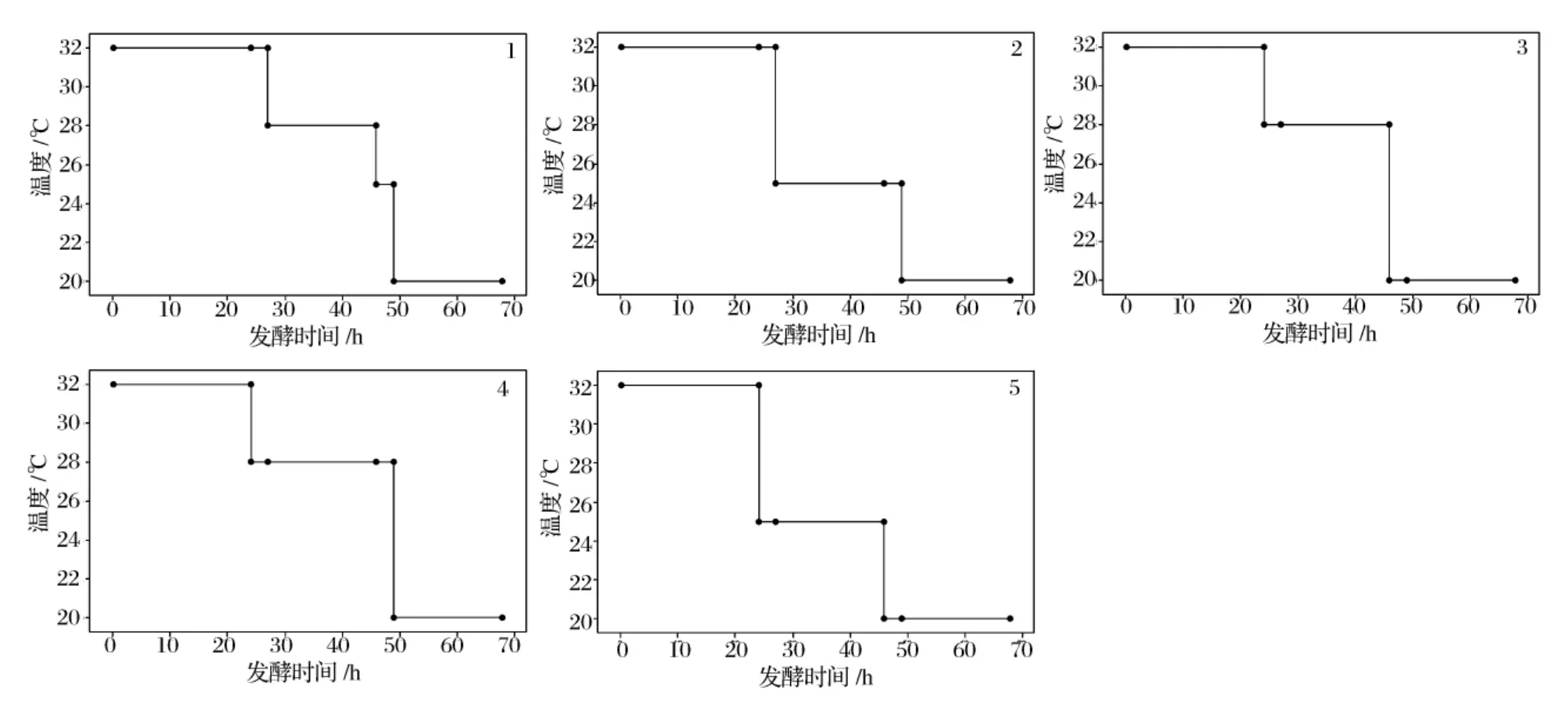
图6 生料工艺不同方式温度梯度控制
图6显示了不同温度梯度控制的方式,其中方式一为3次降温,其余为2次降温。

图7 梯度降温策略对玉米超浓醪生料酒精发酵的影响
图7显示了浓度为35%生料浓醪酒精发酵采取不同方式温度梯度控制过程中葡萄糖浓度和酒精的变化。由图7可知,采取方式一(0~27 h 32℃,27~46 h 28℃,46~49 h 25℃,49~98 h 20℃)的培养方式,葡萄糖浓度在72 h出现下降,说明整个过程降温不够及时,导致最终乙醇含量较低(20.06%),且残余葡萄糖最高(2.01%);采取方式二(0~27 h 32℃,27~46 h 25℃,49~98 h 20℃)和采取方式三(0~24 h 32℃,24~46 h 28℃,46~98 h 20℃)以及方式四(0~24 h 32℃,24~46 h 28℃,46~98 h 20℃)的培养方式,葡萄糖浓度从46 h出现下降,残余葡萄糖分别为1.03%,1.15%,1.67%,乙醇分别为20.45%,20.53%,20.13%,若采取方式五(0~24 h 32℃,24~46 h 25℃,46~98 h 20℃)的培养方式,葡萄糖浓度在24 h达到高点后持续降低,最终乙醇达到20.79%,残余葡萄糖仅0.46%。由此可见,温度是超高浓度酒精发酵过程中影响菌体生长的重要因素,对于超高浓度玉米酒精生料发酵,及时合理调整发酵温度至关重要,方式三和方式五的发酵效果较为理想。
总体来讲,由于采取生料无蒸煮工艺,葡萄糖逐步缓慢释放,淀粉未溶出,整个体系的渗透压非常低;采取适当的温度梯度控制策略,使酵母细胞的活力得以长久维持,增强了酵母生产乙醇的能力和对酒精的耐受性,采取生料无蒸煮工艺,使用普通市售酒用干酵母,在98 h内发酵醪液乙醇体积分数可达20%以上。
3 总结与展望
高浓发酵,节能、高效、减少投资、减少操作单元、更好的副产品是酒精工业化生产的期望,酶制剂的进步使得本来非常困难的问题在新的工艺过程中不再成为制约的瓶颈,如超高浓度发酵时的黏度问题,超高浓度发酵所需的特殊耐高酒度的酵母等等。本文通过温度梯度控制策略,采取玉米生料无蒸煮工艺,使用普通市售酒用干酵母,在98 h内发酵醪液乙醇体积分数可达20%以上,为进一步深入研究超高浓度酒精发酵提供了新的思路。
[1] 段钢.新型工业酶制剂的进步对生物化学品工业生产过程的影响[J].生物工程学报,2009(12):1 808-1 818.
[2] 张国红.我国和世界酒精工业现状[J].酒精,2010(4):1-9.
[3] 岳国君.玉米链,玉米恋[J].生物产业技术,2010(15):72-74.
[4] 岳国君,武国庆,郝小明.我国燃料乙醇生产技术的现状与展望[J].化学进展,2007,19(718):1 084-1 090.
[5] 哈尔滨中国酿酒有限公司.酒精浓醪发酵与清洁生产[J].酒精,2010(4):10-14.
[6] 段钢,许宏贤,孙长平,等.乙醇生产的技术进步——新型酶技术给乙醇生料发酵生产带来的突破[J].食品与发酵工业,2006,32(7):65-70.
[7] 许宏贤,段钢.以小麦为原料的乙醇生产方法[J].食品与发酵工业,2006,32(12):98-103.
[8] 段钢,许宏贤,阮振华.新鲜木薯直接转化生产乙醇[J].食品与生物技术学报,2009,28(3):413-417.
[9] 许宏贤,阮振华,段钢.高粱生料酒精发酵植酸酶的应用研究[J].食品科学,2010(5):248-251.
[10] 段钢,许宏贤.大米生料发酵酒精生产的研究[J].食品与生物技术学报,2008,27(1):95-102.
[11] 许宏贤,段钢.固态间歇补料乙醇生料发酵新工艺[J].生物工程学报,2009,25(2):200-206.
[12] 许宏贤,段钢.温度对超高浓度酒精生料发酵体系的影响[J].生物工程学报,2009(2):330-334.
[13] Dinh T N,Nagahisa K,Hirasawa T,et al.Analysis of adaptation to high ethanol concentration in Saccharomyces cerevisiae using DNA microarray[J].Bioprocess and Biosystems Engineering,2009,32(5):681 -688.
[14] Abe H,Fujita Y,Takaokay,et al.Ethanol-tolerant Saccharomyces cerevisiae strains isolated under selective conditions by over-expression of a proofreading-deficient DNA polymerase delta[J].J Biosci Bioeng,2009,108(3):199-204.
[15] Aldiguier A S,Alfenore S,Cameleyre X,et al.Synergistic temperature and ethanol effect on Saccharomyces cerevisiae dynamic behaviour in ethanol bio-fuel production.Bioprocess Biosyst Eng,2004,26(4):217 -222.
[16] Jacques K A.The Alcohol Textbook(4th ed.)[M].Nottingham:Nottingham University Press,2003:129.
[17] Wang S,Thomas K C,Sosulski,et al.Grain pearling and very high gravity(VHG)fermentation technologies for fuel alcohol production from rye and triticale[J].Process Biochemistry,1998,34(5):421-428.
[18] Wang S,Ingledew W M,Thomas K C,et al.Optimization of fermentation temperature and mash specific gravity for fuel alcohol production.Cereal Chem,1999,76(1):82-86.
[19] 申乃坤.木薯粉与甘蔗汁混合发酵生产高浓度乙醇[J].生物工程学报,2010,26:1269-1275.
[20] Holdsworth S D.Applicability of rheological models to the interpretation of flow and processing behaviour of fluid food products[J].Journal of Texture Studies,1971,2(4):393-418.
[21] 段钢.新型酒精工业用酶制剂技术与应用[M].北京:化学工业出版社,2010.
[22] 贾树彪,李盛贤,吴国峰.新编酒精工艺学[M].北京:化学工业出版社,2004.
[23] Karel K.Handbook of Cereal Science and Technology Second Edition[M].CRC Press,2000.
