糖蜜原料培养高核酸酵母NY-1培养条件优化
2012-01-12王媛媛曹春红杨旭肖冬光
王媛媛,曹春红,杨旭,肖冬光
(天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津,300457)
核苷酸类物质及其衍生物是遗传工程、医药、食品、农业生产和科研领域十分重要的生化试剂和原料[1],核苷酸几乎在所有的细胞结构、代谢、能量和调节功能等方面起着重要作用[2]。Uauy表明[3]将核苷酸添加到以牛奶为基础的代乳品中,对婴幼儿的胃肠道发育、胃肠道健康的维持以及血浆脂蛋白的组成都有有利的影响,Brunser[4]研究结果表明外源核苷酸能减少婴儿腹泻的发生。从全球来看,核苷酸供不应求,是很有发展潜力的项目。
核酸酵母是工业上制取核酸的常用材料[5-6],目前核酸酵母的培养多数采用以糖蜜为碳源的培养基,糖蜜内除了含有大量可发酵糖(主要是蔗糖)外,还含有丰富的矿物质与维生素,是培养酵母较好的碳源。工业生产中核酸酵母菌体培养浓度偏低,大多在10g/L左右,主要原因是核酸酵母只有在对数期收获才可得到较高核酸含量,延长培养时间提高细胞浓度,往往不能保证在对数生长期收获菌体,致使菌体细胞内的核酸含量下降。本研究通过对糖蜜原料处理工艺及对核酸酵母的培养条件进行优化,旨在延长酵母生长的对数期,在保证高核酸含量的同时,提高酵母细胞浓度。
1 材料与方法
1.1 材料
1.1.1 菌株
高核酸酵母NY-1(High nuclear Saccharomyces NY-1)天津科技大学微生物菌种中心保藏。
1.1.2 实验材料
工业糖蜜;尿素,NaCl、ZnSO4、FeSO4、MgSO4、KH2PO4,等均为化学纯试剂;琼脂、酵母浸粉为生化试剂。
1.1.3 实验仪器
UV757型紫外光栅分光光度计、752N可见分光光度计,上海精科上海分析仪器厂;GHP-9050生化培养箱,上海精密仪器厂;HH-2数显温控水浴锅,苏州学森仪器设备有限公司;TDZ5-WS高速离心机,上海卢湘仪离心机仪器有限公司。
1.1.4 液体发酵培养基
总糖 40 g/L,MgSO41.2 g/L,尿素 1.2 g/L,(NH4)2SO40.3 g/L,ZnSO40.15 g/L,无水 FeSO40.15 g/L,NaCl0.1 g/L,H3PO41.8 mL,用氨水调节至pH 5.0。
1.2 方法
1.2.1 酵母泥RNA含量测定[7]
吸取4 mL发酵液于4 000r/min、10 min离心,弃上清液,称菌体湿重;用生理盐水洗涤菌体2次,再加入2 mL生理盐水振荡均匀,再加入2 mL 10%的高氯酸溶液,摇匀,于70℃水浴锅保温20 min(每5 min振摇1次);再于10 000 r/min、5 min条件下离心。将上清液稀释50倍后于紫外分光光度计260 nm处测光密度OD值,计算干菌内含RNA的质量分数(%)。
空气开关属于一种电器元件,其存在优势的同时也存在着一定的缺点,也并不是在任何条件下都能将其自身的优势发挥出来。笔者在多年的实践工作中发现使用空气开关保护变压器时,如果变压器的输出端出现短路的现象,空气开关将不能起到保护的作用。因此为了能够将此类问题解决,应从空气开关的自身工作原理与变压器的工作参数和结构角度出发,分析其不能对变压器起到保护作用的因素。[1]
1.2.2 发酵液菌体干重的测定
取定量发酵液离心洗涤2次,将湿菌体于105℃烘干箱内烘干至恒重。
1.2.3 残余还原糖测定方法
取发酵液样品,离心,将上清液用斐林滴定法测定。
1.2.4 总糖的测定方法[8]
用4 mol/L的盐酸将待测样品在68℃水浴下进行水解,待温度达到68℃开始计时10 min,间断摇匀,冷却后,用NaOH溶液中和至中性并定容至100mL,然后用斐林滴定法测定。
1.2.5 糖蜜原料的处理工艺优化
1.2.5.1 糖蜜初始处理条件[9]
1.2.5.2 糖蜜优化处理条件
方案1:用浓H2SO4调节至pH 3.8,在电炉上煮沸1 h。
方案2:用浓H2SO4调节至pH 4.0,在电炉上煮沸1 h。
方案3:用浓H2SO4调节至pH 4.0,在电炉上煮沸1.5 h。
冷却后将3个样品进行离心,取上清分别进行还原糖及总糖测定。
2 结果分析
2.1 氮源优化
在以糖蜜为碳源的液体发酵培养基中,添加5种不同的氮源,(NH4)2SO4、尿素、酵母粉3种单一氮源及(NH4)2SO4与酵母粉、尿素与酵母粉2种复合氮源分别进行发酵培养,选出最适合酵母生长的氮源。
2.1.1 氮源种类的选择
氮源总添加量与1.1.4中氮源的添加量相同,其中,酵母粉以含氮量12%,菌体利用率50%计算。

图1 氮源种类选择实验结果
由图1知,添加了酵母粉的实验组在菌体干重、发酵液中RNA含量及RNA理论产量上都明显优于其他实验组,但是由于酵母粉的价格较高,因此应选择酵母粉和尿素的复合氮源培养该菌,并在此基础上优化酵母粉和尿素的添加比例,以在提高酵母产量的同时尽可能减少酵母粉用量,从而降低生产成本。
2.1.2 复合氮源比例的选择

图2 复合氮源最适添加量的优化选择
总氮源添加量相同的前提下,将酵母粉与尿素以不同比例混合添加,接种高核酸酵母菌株进行液态发酵,结果见图2。由图2可以看出,随着酵母粉添加量的增加,菌体的干重和RNA含量都有所提高,但提高幅度都不是很明显,从节约成本考虑,采用酵母粉添加量为2 g/L,尿素添加量为2.5 g/L。
2.2 培养基初始pH值优化
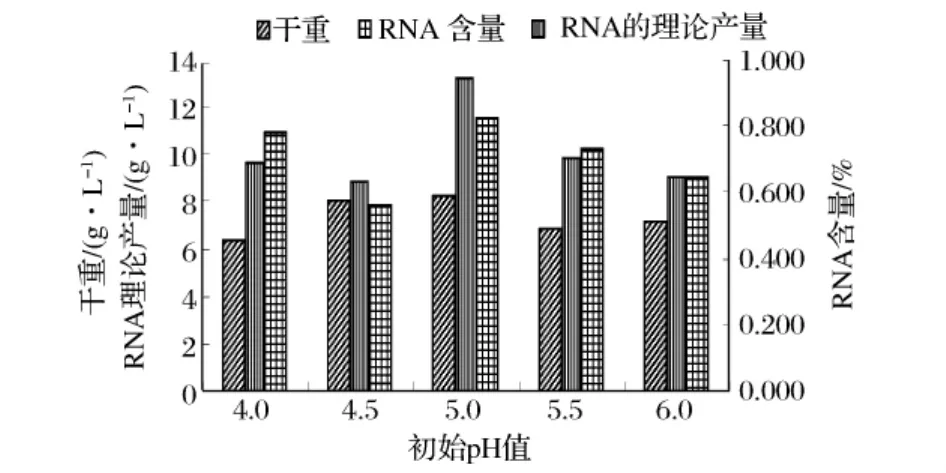
图3 培养基初始pH值优化结果
由图3可以看出初始pH 5.0的实验组,其RNA理论产量最高,菌体干重也相对较高,因此选取培养基的初始pH值为pH5.0。
2.3 投糖浓度对NY-1生长的影响
图4所示为3种糖浓度下酵母的生长曲线,从图4可以看出,该菌在3种投糖浓度下生长时均在6h进入减速生长期,且菌体生物量没有显著差别,糖浓度为40、50和60g/L时,菌体浓度分别为8.72、8.34和8.66g/L。投糖浓度越高,酵母对糖的利用率就越低,说明培养基中的糖未得到有效利用。
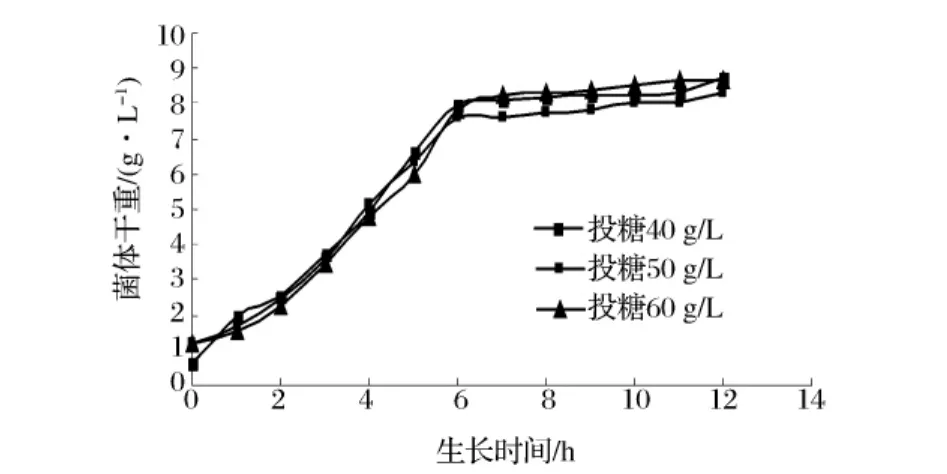
图4 三种投糖浓度下菌体的生长曲线
糖浓度为60 g/L时发酵过程中发酵液总糖和还原糖的变化情况见表1。从表1看,发酵至6 h时,发酵液中还原糖的含量降至6.95 g/L,糖浓度较低可能是酵母进入减数生长期的原因之一。另一方面,发酵至6 h时的总糖浓度为25.1 g/L,糖蜜中的蔗糖基本上没有水解,这说明该菌体的蔗糖酶活性偏低,对蔗糖的利用速率较慢。因此要延长菌体生长的对数期,应先从糖蜜的预处理方法上着手,即提高糖蜜处理完后总糖的水解率。

表1 投糖60 g/L时发酵过程中发酵液总糖和还原糖的变化情况
2.4 糖蜜处理工艺优化
2.4.1 不同糖蜜处理方法下总糖的水解情况
表2为不同糖蜜处理工艺下总糖的水解情况,由表2知,加热时间相同,酸度越低,蔗糖水解率越高;酸度相同,加热时间越长,蔗糖水解率越高。本实验中总糖水解率最高的糖蜜处理条件为方案3,即用H2SO4调节至pH4.0,煮沸1.5 h,此时总糖的水解率可达到75%。
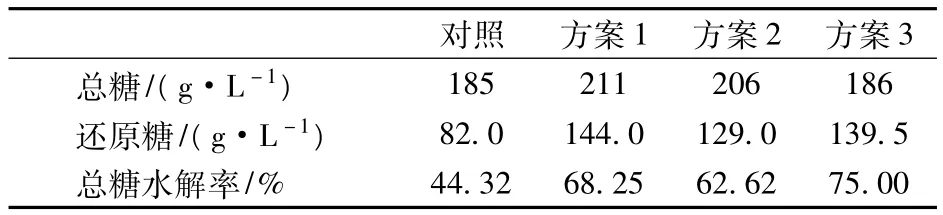
表2 不同糖蜜处理方法下总糖水解情况
2.4.2 提高糖蜜水解率前后菌体培养结果
图5为提高糖蜜水解率后菌体的生长曲线,从图5看,提高糖蜜水解率后,相同投糖浓度(60 g/L),菌体生长的对数期被延长大约3 h,菌体浓度提高约25%。表3为提高糖蜜水解率后发酵过程中总糖与还原糖的情况,从表3看,发酵至6 h时还原糖含量为12.4 g/L,明显高于提高水解率前的糖浓度;发酵至9 h时,发酵液中还原糖含量下降至6.5 g/L,与未处理糖蜜时发酵6 h时还原糖浓度相当,酵母进入减速生长期,说明提高糖蜜中总糖的水解率后可以延长酵母对数生长期,提高糖的利用率。

图5 提高糖蜜中蔗糖水解率前、后核酸酵母的生长曲线
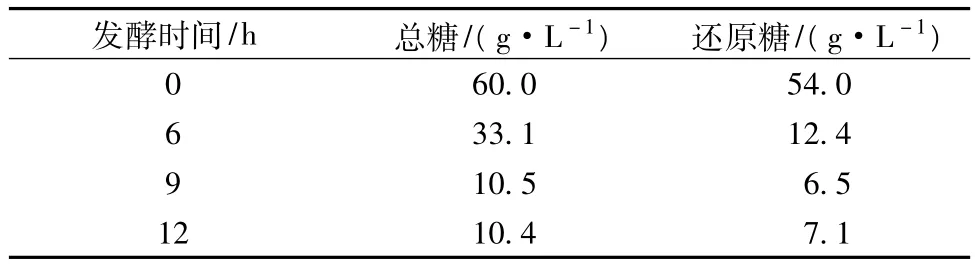
表3 提高糖蜜总糖水解率后发酵液总糖和还原糖的变化情况
表4为提高糖蜜总糖水解率前后培养核酸酵母的结果,由表4可知,提高糖蜜总糖水解率后,菌体RNA含量提高了16.5%,但菌体浓度基本不变,酵母对糖的得率仍然较低。

表4 提高糖蜜总糖水解率前后60 g/L投糖时菌体生长情况对比表
2.5 溶氧对菌体生长的影响
表5为溶氧对菌体生长的影响,由表5可以看出,在普通的三角瓶内,减少装液量可以提高菌体的生物量,用挡板瓶代替普通的三角瓶提高溶氧效果,可明显提高菌体的生物量,可见提高溶氧有利于菌体生物量的增加。
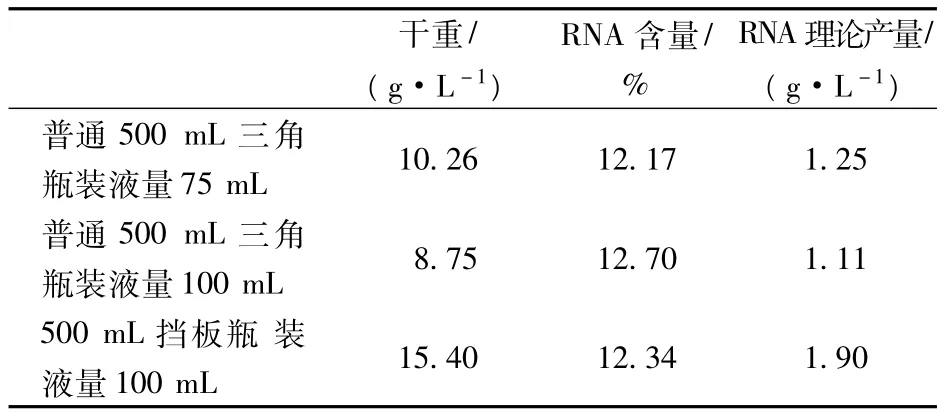
表5 溶氧对菌体生长的影响
3 结论
实验证明,核酸酵母在生长过程中对溶氧的需求较高,其内的蔗糖酶活性较低,因此,在工业生产中要着重完善供氧设备,同时采用较高的糖蜜水解率。另外,可从菌种出发,筛选出蔗糖酶活性高的核酸酵母,这样在工业生产过程中可大大减少糖蜜原料处理过程中的用酸量,有利于进一步降低生产成本。
[1] 娄永江,吴汉民,王海洪.从桔青霉M71生产核酸酶P1及酶活提高途径[J].宁波大学报,1997,10(3):21-28.
[2] 汪余勤,程五凤,李宣海.核苷酸与营养[J].国外医学卫生学分册,1999,26(5):257 -260.
[3] Uauy R,Quan R.Role of nucleotides in intestinal development and repair:implications for infant nutrtion[J].J Nutr,1994,124:1 436 -1 441.
[4] Brunser D,Espinoza J.Effect of dietary nucleotide supplimentation on diarrhoeal disease disease in infants[J].Acta Paedia,1994,83(2):188 - 191.
[5] 宋思扬,楼士林.生物技术概论[M].北京:科学教育出版社,1999:80-120.
[6] 桂建芳.RNA加工与细胞周期调控[M].北京:科学出版社,1998:20-128.
[7] 盛建国,李灵敏.K-79高核酵母发酵废糖蜜制备核糖核酸的研究[J].食品工业科技,2007,28(1):140-142.
[8] 于景芝,陈尧燊,俞学锋.酵母生产与应用手册[M].北京:中国轻工业出版社,2005.
[9] 肖冬光,丁匀成,邹海晏.酿酒活性干酵母的生产与应用技术[M].呼和浩特:内蒙古人民出版社,1994.
