大豆蛋白水解物促酸奶乳酸菌增殖及生长动力学*
2012-01-12白凤翎张柏林赵宏飞
白凤翎,张柏林,赵宏飞
1(渤海大学化学化工与食品安全学院,辽宁省食品安全重点实验室,辽宁锦州,121013)2(北京林业大学生物科学与技术学院,北京,100083)
酸奶是由保加利亚乳杆菌(Lactobacillus delbrueckii bulgaricus)和嗜热链球菌(Streptococcus thermophilus)混合发酵牛奶形成的发酵乳制品,目前用于酸奶生产的发酵剂主要为直投式发酵剂(Directed Vat Set,DVS),其中乳酸菌的细胞数量是决定发酵剂性能的关键因素。由于乳酸菌缺乏一些生物代谢途径,不能合成生长必需的氨基酸、维生素等物质,营养要求十分苛刻。同时,乳酸菌具有很弱的蛋白分解能力,必需依赖生长环境提供必需氨基酸、维生素等生长因子才能获得高密度细胞培养。本研究根据van Niel等[1]关于乳酸菌的营养需要,并参考Zhang等的研究结果[2],设计嗜热链球菌和保加利亚乳杆菌生长的化学限定培养基(Chemically Defined Media,CDM),以小于5 ku分子量的大豆蛋白水解物(soy protein hydrolysates,SPH)作为氮源生长添加物促进乳酸菌细胞增殖,从生长动力学、产酸能力等分析SPH中多肽、氨基酸对乳酸菌生长的促进作用机制,为生产高密度乳酸菌直投式发酵剂奠定基础。
1 材料与方法
1.1 菌种
嗜热链球菌(Streptococcus thermophilus)S1菌株,德式乳杆菌保加利亚亚种(Lactobacillus delbrueckii bulgaricus)L2菌株,北京林业大学食品发酵实验室保存菌种。冷冻干燥的供试菌株首先接种11%的脱脂乳培养基,在MRS琼脂上划线分离,37℃培养24~48 h。每次试验取单菌落经MRS液体培养基中活化3次,以充分恢复菌株活力。
1.2 大豆蛋白水解物制备
大豆蛋白水解物以大豆分离蛋白为基质,按5%底物浓度90℃水浴中预热15 min,冷却,调节pH值至pH 8.0。按4 000 U/g加入碱性蛋白酶,50℃水浴作用6 h。在反应过程中,滴加2.0 mol/L NaOH维持pH值稳定。反应结束后在85℃下加热10 min钝化酶,离心取上清液。经Millipore Labscale TFF System Kit超滤获得小于5 ku分子质量的大豆蛋白水解物,经测定其中多肽和氨基酸含量为3.02 g/100 mL。
1.3 培养基
1.3.1 保加利亚乳杆菌培养基
1.3.1.1 基本培养基
保加利亚乳杆菌的基本培养基配方见表1。配制过程中,维生素和无机盐用0.22 μm滤膜过滤除菌,其余溶解后115℃ 20 min灭菌。临用时按比例混合。
1.3.1.2 复合氨基酸培养基
用20种氨基酸代替表1中的8种氨基酸,其中每升培养基中加入半胱氨酸0.4 g,天门冬氨酸0.3 g,谷氨酸0.3 g,另外16种氨基酸各加0.2 g,氨基酸添加总量为4.2 g/L。其余成分和配制方法与基本培养基相同。
1.3.1.3 蛋白水解物培养基

表1 保加利亚乳杆菌生长基本培养基组成
用大豆蛋白水解液代替基本培养基中的8种氨基酸,添加量为5.0 mL/100mL,多肽和氨基酸添加总量为1.51 g/L。其余成分和配制方法同基本培养基。
1.3.2 嗜热链球菌培养基
1.3.2.1 基本培养基
嗜热链球菌的基本培养基配方见表2。

表2 嗜热链球菌生长的基本培养基组成
配制时,维生素和无机盐用0.22 μm滤膜过滤除菌,其余溶解后115℃ 20 min灭菌。临用时按比例混合。
1.3.2.2 复合氨基酸培养基
用20种氨基酸代替基本培养基中的7种氨基酸,其中培养基中加入半胱氨酸0.4 g/L,天门冬氨酸0.3 g/L,谷氨酸0.3 g/L,另外16种氨基酸按0.2 g/L添加,氨基酸添加总量为4.2 g/L。其余成分与配制方法同基本培养基。
1.3.2.3 蛋白水解物培养基
配制方法同1.3.1.3。
1.4 方法
1.4.1 乳酸菌化学限定培养基生长分析
将活化3代的保加利亚乳杆菌和嗜热链球菌MRS 12 h培养物3 000 r/min离心10 min,去上清液,沉淀细胞洗2次后,调整细胞浓度为106~107个/mL。以2%接种量分别接种保加利亚乳杆菌基本培养基、复合氨基酸培养基和蛋白水解物培养基,充分摇匀。无菌条件下分装于灭菌的试管中,每管5.0 mL,置37℃培养。从0 h开始每隔2 h以3种空白培养基调零,在600 nm处测定OD值,同时测定pH值。
按μ=(X2-X1)/T,计算生长速率
式中:μ为生长速率;X2和X1分别为T时间的OD值。
1.4.2 乳酸菌在蛋白水解物培养基与MRS培养基中的生长比较分析
将活化3代保加利亚乳杆菌和嗜热链球菌MRS 12 h培养物离心去上清液,细胞洗2次后,调整细胞浓度为106~107个/mL。以2%接种量分别接种MRS培养基和蛋白水解物培养基,充分摇匀。无菌条件下分装于灭菌的试管中,每管5.0 mL,37℃培养。从0h开始每隔4h按文献[5]进行乳酸菌计数。
1.4.3 实验数据处理
实验数据采用Microsoft Office Excel 2003处理。
2 结果与讨论
2.1 保加利亚乳杆菌L2生长曲线
2.1.1 L2在基本培养基中的生长曲线
保加利亚乳杆菌在含有8种氨基酸的基本培养基中的生长结果见图1,细菌密度的OD值始终维持在一个很低的水平,总体看来细菌在该培养基中生长情况很差。0~4 h有一个上升阶段,然后维持一个水平线上,最后迅速下降。pH值的变化与OD值同步,虽有一个下降过程,但幅度很小,一直维持在pH 6.2以上,说明该菌的产酸能力很有限。
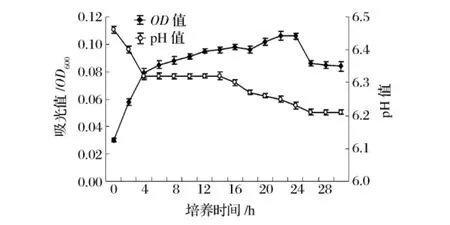
图1 L2在基本氨基酸培养基中的生长曲线
2.1.2 L2在20种氨基酸培养基中的生长曲线
在含有20种氨基酸CDM上,保加利亚乳杆菌生长过程如图2所示。与基本培养基相比,细胞生长量可增加3倍,最大生长速率μmax在0.02/h左右。pH值从初始的pH 6.41下降到pH 4.92,从细胞密度和产酸量来看,虽然含有全价氨基酸,但细菌生长状况不是很好,表明氨基酸并不是保加利亚乳杆菌生长最佳氮源。
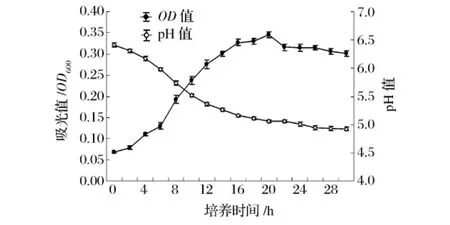
图2 L2在20种氨基酸培养基中的生长曲线
2.1.3 L2在SPH培养基中的生长曲线
L2在含有SPH培养基上生长状况如图3所示,生长量比20种氨基酸有很大改善,可达到1.425,分别是8种和20种氨基酸培养基的13.4倍和4.1倍。pH值下降到pH 3.94,产酸水平基本可与乳培养基相近。最大生长速率μmax为0.10/h,是20种氨基酸的5倍。
2.1.4 保加利亚乳杆菌3种培养基生长曲线比较

图3 L2在SPH培养基中的生长曲线
保加利亚乳杆菌在3种培养基中的生长状况结果见图4和图5,基本培养基生长量和产酸量维持一个很低的水平,说明8种氨基酸作为氮源能够提供细菌的最低生长要求。20种氨基酸为细菌生长提供比较丰富的氮源,使保加利亚乳杆菌生长提高3倍。产酸量也有大幅度提高,pH值下降到pH 5.0以下。
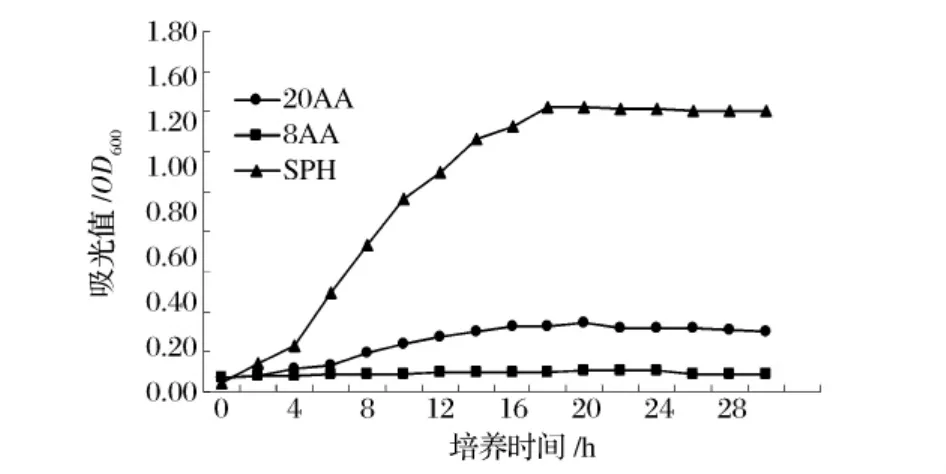
图4 保加利亚乳杆菌在3种培养基中的生长曲线

图5 保加利亚乳杆菌在3种培养基的pH值变化
与MRS和脱脂乳培养基相比还相差很多,说明全价氨基酸并不能为保加利亚乳杆菌菌株获得最适生长氮源。用分子量小于5 ku的SPH替代氨基酸作为氮源使保加利亚乳杆菌的生长状况大为改观,最大生长速率是20种氨基酸的5倍,pH值可下降到pH4.0以下。由此说明大豆蛋白水解物是保加利亚乳杆菌生长的最佳氮源,可获得相对较大的生长量。
2.2 嗜热链球菌S1生长曲线
2.2.1 S1基本培养基中的生长曲线
嗜热链球菌在基本氨基酸培养基中的生长结果如图6所示,S1在该培养基中生长的状况很差,最大吸光值和最大生长速率仅为0.046/h和0.0028/h。培养基的pH值经过20 h从pH 6.30下降到pH 6.18,表明含7种氨基酸的基本培养基仅能维持细菌的最低生长水平。

图6 嗜热链球菌在基本氨基酸培养基中的生长曲线
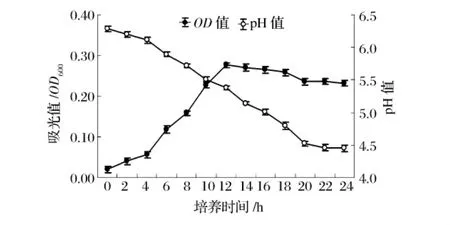
图7 嗜热链球菌在20种氨基酸培养基中的生长曲线

图8 嗜热链球菌在SPH培养基中的生长曲线
2.2.2 S1在20种氨基酸培养基中的生长曲线
在20种氨基酸培养基上嗜热链球菌的生长状况和7种氨基酸相比有很大增长,结果见图7。最大OD值和最大生长速率分别为0.277/h和0.024/h。在生长过程中,乳酸菌的产酸量也大幅增加,pH值从起初的pH 6.29下降到pH 4.45。
2.2.3 嗜热链球菌在SPH培养基中的生长曲线
图8是嗜热链球菌在添加SPH的培养基中的生长状况,与20种全价氨基酸培养基相比细胞生长量大幅度提高,在稳定期时OD值最高达到1.434,为20种氨基酸培养基的5倍多。最大生长速率达到0.12/h,也为20种氨基酸培养基的5倍。
2.2.4 嗜热链球菌在3种培养基中的生长状况比较
图9和图10分别是嗜热链球菌在3种培养基中生长的细胞量和pH值变化图,可以看出,嗜热链球菌在基本培养基上细胞量只维持最低生长水平,20种氨基酸培养基虽能够为细菌生长提供全价的氨基酸,但是生长状况远不如添加SPH的培养基。

图9 嗜热链球菌在3种培养基生长量的比较

图10 嗜热链球菌在3种培养基中的pH值的比较
由图10可知,pH值与生长量变化之间存在同步关系。在基本培养基上生长水平很低,所反映的pH值变化是一条水平直线。在全价氨基酸培养基上,pH值呈现出一个缓慢的下降通道,说明随着细菌生长有个逐渐形成乳酸的过程。在SPH培养基上,pH值变化是由一个迅速的下降阶段和一个平缓的延伸阶段组成,说明乳酸形成过程首先是一个与对数生长期相对应的快速产酸期,然后当细菌生长进入稳定期后产酸趋于平缓。
2.3 乳酸菌在MRS培养基的生长状况
图11和图12是保加利亚乳杆菌和嗜热链球菌在MRS培养基中的生长曲线和pH值变化关系图。从生长量来看,两种细菌的最大生长速率分别可达到0.215/h和0.262/h,与图3和图8中二菌在SPH培养基的最大生长速率0.10/h和0.12/h相比,两者存在倍增关系,表明MRS更适合乳酸菌生长。

图11 保加利亚乳杆菌在MRS培养基中的生长曲线
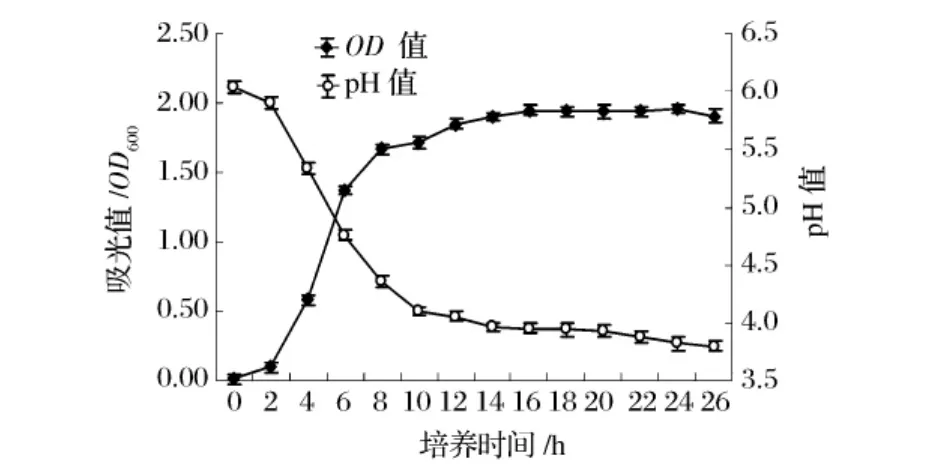
图12 嗜热链球菌在MRS培养基中的生长曲线
从pH值的变化情况来看,保加利亚乳杆菌从2 h开始时迅速下降,到达14 h后呈现一个平缓下降过程,最终稳定在pH 3.6左右。嗜热链球菌产酸相对于保加利亚乳杆菌虽然下降也较迅速,但到达10 h后仍有一个缓慢的下降过程,最终定位在pH 3.8左右。二者相比保加利亚乳杆菌产酸能力较强一些。
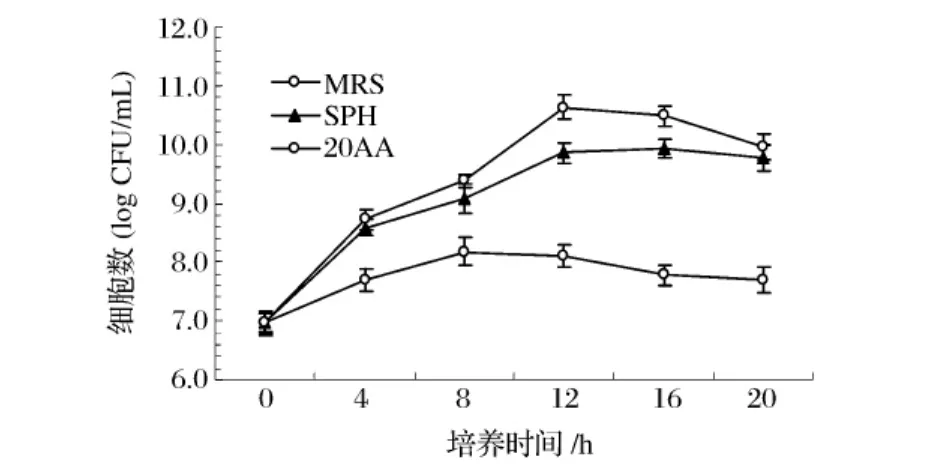
图13 S1在3种培养基中的细胞生长数量

图14 L2在3种培养基中的细胞生长数量
图13和图14分别是嗜热链球菌和保加利亚乳杆菌在全价氨基酸培养基、SPH培养基和MRS培养基中细菌细胞数量结果比较图,在MRS培养基中两种乳酸菌的细胞数量可达1010CFU/mL以上,SPH培养基的乳酸菌数量在109~1010CFU/mL,且接近1010数量级,20种全价氨基酸培养基的细胞数量在108CFU/mL以下。
2.4 乳酸菌生长对氮源的需要
从L2和S1在基本氨基酸、全价氨基酸和SPH 3种培养基中的生长状况来看,基本氨基酸包括谷氨酸、组氨酸、异亮氨酸、亮氨酸、甲硫氨酸、缬氨酸和精氨酸等是乳酸菌生长的必需氨基酸[2],只满足乳酸菌生长氮源的最低要求。对于部分乳酸菌,同时添加天冬酰胺和谷氨酰胺后生长达到基本要求[4]。20种全价氨基酸与富含有分子量低于5ku短肽和游离氨基酸的大豆蛋白水解物相比,虽然添加大豆蛋白水解物的量只是20种氨基酸的1/3,但其最大生长速率是全价氨基酸的5倍,说明蛋白水解物中富含有更易被乳酸菌生长利用的最佳氮源。
2.4.1 乳酸菌的氮源转运系统
乳酸菌的氮源转运系统主要包括3种体系,一是以游离氨基酸的方式进入细胞,二是通过二肽或三肽转运系统,三是依靠寡肽转运系统。转运系统一是依靠质子动力二肽载体,另一是依靠能量转运系统,后者主要转运4~6个氨基酸的寡肽,系统极大可能由ATP驱动或与富含能量的磷酸盐中间底物有关[5]。通过恒化培养生长细胞内部的氨基酸池分析显示,芳香族氨基酸主要以高稀释比率通过被动扩散的方式进入细胞[6]。在乳中,乳酸菌利用蛋白酶水解乳蛋白形成多肽生长,多肽被吸收后被水解成氨基酸释放到培养基中供细菌内生长需要,生长依赖寡肽作为氮源占98%,其寡肽转运系统在利用肽方面起到至关重要的作用[7]。2种乳酸菌在3种培养基中的状况说明,乳酸菌在SPH培养基中比在全价氨基酸培养基中获得更好的生长,与其乳酸菌氮源转运系统密切相关。
2.4.2 化学限定培养基与MRS培养基的比较
虽然富含有5 ku多肽和氨基酸的SPH能够使乳酸菌获得很好生长,但乳酸菌生长比MRS培养基低0.5~1个数量级,培养基的综合效能不及半合成培养基MRS,这可能是由于在MRS培养基中的蛋白胨、牛肉膏和酵母膏中的组成成分如蛋白质、多肽、氨基酸和维生素等对满足乳酸菌生长更全面、有效。然而从生长曲线的走势来看,乳酸菌在SPH培养基中的细胞活性维持在一水平线上,MRS和全价氨基酸培养在进入稳定期后细胞数量呈下降趋势,这也许是蛋白水解物中形成对细菌有毒副作用的产物相对少的缘故[8]。
3 结论
利用化学限定培养基对酸奶乳酸菌进行增殖作用研究,结果表明必需氨基酸只能满足乳酸菌生长的基本氮源需要,20种全价氨基酸虽然可使保加利亚乳杆菌和嗜热链球菌的最大生长速率显著提高,产酸能力明显增强,但远不及大豆蛋白水解物的增殖效果。用分子质量小于5ku的SPH代替全价氨基酸可使乳酸菌细胞密度增加4倍,最大生长速率增加1倍。因此说明能够使乳酸菌迅速增殖的最佳氮源是蛋白水解物中的寡肽,而不是氨基酸,大豆蛋白水解物可以用作乳酸菌高密度培养添加物。
乳酸菌作为一特殊的细菌类群在食品发酵、保健医疗等领域具有非常重要的作用,由于乳酸菌的代谢特征,一直限制乳酸菌的高密度细胞培养技术。本研究通过化学限定培养基应用大豆蛋白水解物对保加利亚乳杆菌和嗜热链球菌进行增殖作用研究,结果表明含有寡肽和氨基酸的大豆蛋白水解物对乳酸菌的生长具有明显的促进作用,可以用来作为乳酸菌高密度细胞培养体系的生长促进剂。
[1] van Niel E W J,Hahn-Hägerdal B.Nutrient requirements of lactococci in defined growth media [J].Applied Microbiology and Biotechnology,1999,52(5):617-627.
[2] Zhang G,Mills D A,Block DE.Development of chemically defined media supporting high-cell-density growth of lactococci,enterococci,and streptococci[J].Applied and Environmental Microbiology,2009,75(4):1 080-1 087.
[3] Radke-Mitchell L,Sadine W E.Associative growth and diferential enumeration of Strptococcus thermophilus and Lactobacillus bulgaricus:a review[J].Journal of Food Protection,1984,47:245-248.
[4] Jensen P R,Hammer K.Minimal requirements for exponential growth of Lactococcus lactis[J].Applied and Environmental Microbiology,1993,59(12):4 363-4 366.
[5] Kunji E R S,Smid E J,Plapp R,et al.Di-tripeptides and oligopeptides are taken up via distinct transport mechanisms in Lactococcus lactis [J].Journal Bacteriology,1993,175(7):2 052-2 059.
[6] Poolman B,Konings W N.Relation of growth of Streptococcus lactis and Streptococcus cremoris to amino acid transport.[J].Journal of Bacteriology,1988,170(2):700-707.
[7] Juillard V,Laan H,Kunji E R S,et al.The extracellular PI-type proteinase of Lactococcus lactis hydrolyzes beta-casein into more than one hundred different oligopeptides[J].Journal Bacteriology,1995,177(12):3 472-3 478.
[8] Kunji E R S,Jeronimus-Stratingh C M,Bruins AP,et al.Reconstruction of the proteolytic pathway for use of β-casein by Lactococcus lactis [J].Molecular Microbiology,1998,27:1 107-1 118.
