BAT2缺失酿酒酵母基因工程安全菌株的构建及其杂交育种*
2012-01-12张艳英肖冬光张翠英王文阳汪东升李月强
张艳英,肖冬光,张翠英,王文阳,汪东升,李月强
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津,300457)
白酒是中国特有的蒸馏酒,风味独特,深受人们喜爱。高级醇类物质是形成白酒风味的重要物质之一,若含量适宜,可使白酒口感柔和丰满、味道独特;但如果含量过高,会使白酒产生异杂味,影响酒的风味和品质,并且饮用后易上头,危害身体健康;反之,高级醇含量不足,酒味将变得稀薄单调。因此,必须控制白酒中高级醇的含量。而我国目前以玉米等蛋白质含量丰富的原料发酵生产的白酒中高级醇含量较高,发酵结束后总含量通常在300 mg/L(或300 mg/kg,以异丁醇和异戊醇计)以上。
酿酒酵母酒精发酵过程中,高级醇主要有两条形成途径,分别为氨基酸分解代谢途径(Ehrlich途径)[1]和糖代谢合成途径[2]。BAT2 是控制酵母细胞质中氨基酸转氨酶的编码基因,本实验室前期通过同源重组构建了BAT2缺失单倍体突变株A8-B和C22-B,但其染色体上带有G418抗性基因KanMX且酵母单倍体突变株不稳定,不能应用到工业生产中,因此必须去除A8-B和C22-B基因组上的G418抗性基因KanMX,并且将它们杂交成双倍体,构建优良的低产高级醇基因工程安全菌株。
大肠杆菌P1噬菌体Cre基因的38.5ku产物(该产物是一种重组酶 ,recombinase)能识别并催化loxP位点间的重组;loxP位点含34bp,包括被8bp间隔的2个13bp反向重复,每个反向重复及其临近的4bp 构成一个 Cre 蛋白的结合区[3-4]。Hegemann[5]等人构建了loxP-Marker-loxP系列基因敲除体系,通过PCR反应将loxP-Marker-loxP基因片段从模板质粒pUG6扩增出来,同时在两端带上拟敲除基因约50bp的同源区,此基因片段进入酵母后与拟敲除基因发生同源重组,根据G418抗性筛选出阳性克隆。然后将带有Cre重组酶的质粒导入阳性转化子,通过半乳糖的诱导表达将两个loxP位点间的抗性基因去除。文献[6-7]就是利用Cre/loxp系统实现loxP位点间目的片段的精确去除。
本文以2株BAT2缺失单倍体突变株为出发菌株,利用重组质粒pGAPZA中的Cre重组酶编码基因去除G418抗性基因KanMX,然后将这2株单倍体杂交成双倍体菌株ΔBAT2,该菌株具有良好的遗传稳定性,以野生菌株和出发菌株为对照,通过白酒发酵试验测定了其主要发酵指标。
1 材料与方法
1.1 菌株
大肠杆菌(Escherichia coli)JM109、酿酒酵母(Saccharomyces cerevisiae)AY15及其生孢子得到的单倍体菌株A8和C22、BAT2缺失单倍体突变株A8-B和C22-B及质粒pGAPZA(带有Zeocin抗性和Cre重组酶基因)均为本实验室保存。
1.2 主要仪器
电热恒温水浴锅,电子天平,台式高速离心机,生化培养箱,HS-1300-V型超净台,恒温摇床,光学显微镜,全自动凝胶成像仪,GL20A型高速冷冻离心机,PCT-200型PCR基因扩增仪,P型移液器,DYY-4c型电泳仪,AgilentGC 7890,DL102x型电热鼓风干燥箱。
1.3 主要培养基
YEPD培养基,YPG诱导培养基(将YEPD培养基中葡萄糖改为半乳糖),LB培养基,棉子糖生孢培养基[8]
1.4 实验方法
1.4.1 引物
利用Primer5.0设计PCR反应引物(表1)。

表1 本文所用引物
1.4.2 酵母转化
利用醋酸锂转化法[9]将pGAPZA质粒转入A8-B和C22-B中,提取酵母质粒,PCR扩增验证pGAPZA质粒是否转入A8-B和C22-B中。
1.4.3 G418抗性基因的去除
已携带有pGAPZA质粒的A8-B和C22-B在半乳糖培养基中诱导表达4~5 h,稀释涂布,挑出单菌落于YEPD平板上,再影印到G418抗性平板上,30℃静置培养48 h。在YEPD上生长而在G418抗性平板上不生长即为所得到的菌株。提取酵母基因组,PCR扩增验证KanMX基因是否去除。
1.4.4 质粒pGAPZA的丢失
将带有质粒pGAPZA的酵母菌株接入10 mL YEPD液体培养基中,30℃、200 r/min摇瓶培养12 h。按1∶100的接种量,接到新的10 mL YEPD培养基中,同样条件下培养12 h,如此反复,直至pGAPZA质粒丢失。取适量每次传代的菌液稀释涂布于YEPD平板上,挑取单菌落于5 mL YEPD中,培养12 h,提取酵母质粒,PCR验证pGAPZA质粒是否丢失。
1.4.5 单倍体杂交
将单倍体菌株按照吴帅等所述方法[10]杂交成双倍体,提取其基因组,PCR验证BAT2缺失且无G418抗性基因。
1.4.6 双倍体的遗传稳定性
从斜面上挑取1环双倍体ΔBAT2于5 mL YEPD培养基中,每隔12 h转接1次,如此反复转接20次以上,对第 1、5、10、15、20 次的双倍体进行 PCR 验证。
1.5 分析方法
1.5.1 CO2失重的测定
接种二级种子于玉米糊培养基中,30℃静置培养,按照文献[11]描述的方法每隔12 h测CO2失重。
1.5.2 还原糖的测定
斐林试剂法[11]。
1.5.3 酒精度的测定
酒精计比重法[11]。
1.5.4 高级醇测定方法[12-13]
发酵结束后蒸馏发酵液得到含有高级醇的待测样品。本试验测定高级醇的最佳条件为:色谱柱Agilent1909N -213:260℃;30 m ×320 μm ×0.5 μm;柱温55℃保持5 min,然后以15℃/min的速度升温至100℃,再保持6 min;进样口温度230℃;检测器温度250℃;载气流速1.000 mL/min保持5 min,然后以1.000 mL/min的速度升至5.000 mL/min,再保持1 min;氢气流速30 mL/min;空气流速400 mL/min;尾吹速度 25 mL/min;分流比 20∶1;进样量 1 μL。
2 结果与分析
2.1 G418抗性基因的去除
2.1.1 pGAPZA质粒转化突变株A8-B和C22-B
将质粒 pGAPZA分别转化 A8-B和 C22-B,在Zeocin抗性平板上挑转化子,提取酵母质粒,通过PCR验证筛选出带有pGAPZA质粒的菌株,PCR结果如图1所示。
由图1可知pGAPZA质粒上存在大小为1100bp的Cre基因和1200bp的 Zeocin抗性基因;未携带pGAPZA质粒的A8-B和C22-B酵母质粒上不存在Cre基因和Zeocin抗性基因;携带pGAPZA质粒的A8-B和C22-B酵母质粒上PCR扩增的Cre基因和Zeocin抗性基因片段与阳性对照pGAPZA质粒上扩增到的片段大小一致。这些结果证明pGAPZA质粒已成功转入酿酒酵母A8-B和C22-B中。
反映其成矿是在基性火山熔岩喷发间歇期沉积形成,其围岩为基性火山岩(斜长角闪岩)。说明其成矿物质来源除部分来自陆源外,大部分与其中火山沉积建造有关。
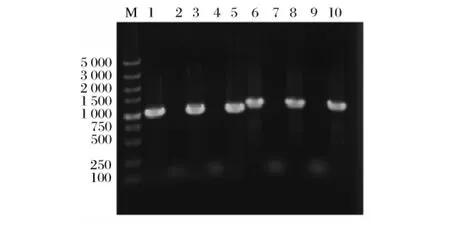
图1 携带pGAPZA质粒的酿酒酵母A8-B和C22-B的PCR验证
2.1.2 单倍体菌株ΔBAT2a和ΔBAT2α的获得
半乳糖培养基诱导已携带pGAPZA质粒的A8-B和C22-B,利用影印平板法筛选出YEPD平板上生长而G418平板上不生长的菌株,分别命名为ΔBAT2a和ΔBAT2α,并通过PCR验证G418抗性基因是否去除,结果如图2所示。
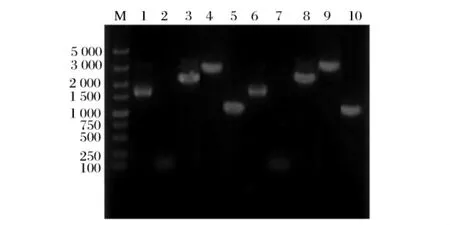
图2 KanMX基因去除的PCR验证
由图2可知,A8和C22基因组上存在完整的BAT2基因,PCR扩增的BA-BAT2-BB片段大小为2100bp;BAT2缺失突变株A8-B和C22-B基因组上BAT2基因被抗性基因KanMX替代,PCR扩增得到2600bp的BA-KanMX-BB重组盒和1 600bp的KanMX基因;ΔBAT2a和 ΔBAT2α 基因组上去除KanMX基因后PCR扩增得到1100bp的BA-BB片段。这些结果证明已成功获得了无G418抗性基因的菌株 ΔBAT2a和 ΔBAT2α。
2.1.3 pGAPZA质粒的丢失
在YEPD培养基上连续传代 ΔBAT2a和ΔBAT2α,PCR验证pGAPZA质粒是否丢失,结果如图3所示。

图3 pGAPZA质粒丢失PCR验证
由图3可知,从ΔBAT2a和ΔBAT2α酵母质粒上扩增不到Zeocin抗性基因片段,证明pGAPZA质粒已丢失。
2.2 单倍体ΔBAT2a和ΔBAT2α的杂交
将单倍体 ΔBAT2a和 ΔBAT2α 进行杂交(图4 A),获得双倍体菌株ΔBAT2,并进行生孢验证(图4 B)。提取双倍体菌株ΔBAT2的基因组,以BA-U和BB-D为引物进行 PCR扩增,结果如图2泳道5(略)。
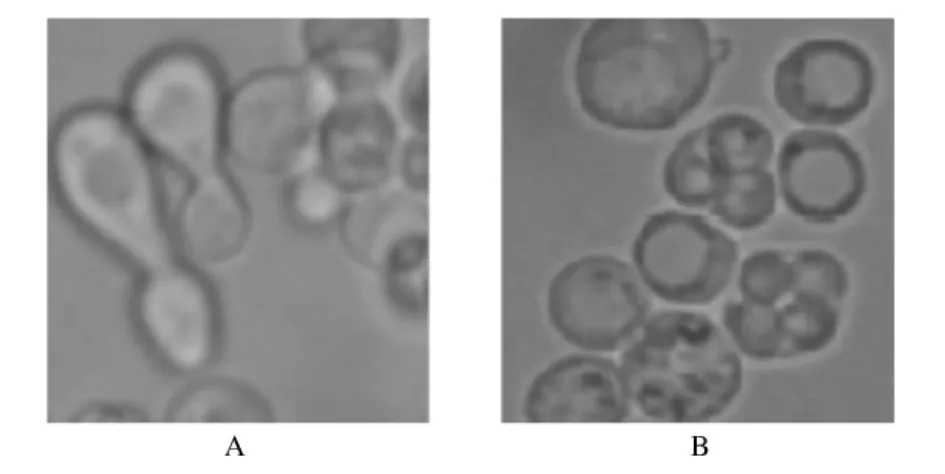
图4 A,单倍体ΔBAT2a和ΔBAT2α的融合;B,双倍体ΔBAT2的生孢验证
2.3 双倍体的遗传稳定性
提取第1、5、10、15、20 次转接的 ΔBAT2 的基因组,以BA-U和BB-D为引物进行PCR扩增,结果得到大小为1 100bp的BA-BB片段,如图2第5个泳道(略),这就证明了单倍体ΔBAT2a和ΔBAT2α杂交的双倍体ΔBAT2具有很好的遗传稳定性。
2.4 发酵试验
将野生菌株、出发菌株与BAT2缺失且无G418抗性基因的ΔBAT2同时进行白酒发酵试验,发酵结束后测定菌株的主要发酵指标(表2)。

表2 菌株主要发酵指标
由表2可以看出,BAT2缺失且无G418抗性基因的ΔBAT2与出发菌株A8-B和C22-B相比,CO2失重高,残糖低,乙醇含量高;野生菌株AY15的异丁醇、异戊醇、总高级醇含量分别为 8.60 mg/100 mL、20.81 mg/100 mL、33.89 mg/100 mL,突变株 ΔBAT2的异丁醇、异戊醇、总高级醇含量分别为4.30 mg/100 mL、13.86 mg/100 mL、23.53 mg/100 mL,分别比野生菌株AY15降低50.00%、33.40%、30.57%。
3 讨论
高级醇是白酒中重要的风味物质之一,但是其含量超过一定量又会影响到白酒风味。在酵母菌发酵过程中,高级醇主要有两条代谢途径,一是氨基酸转氨途径(Ehrlich代谢途径),另一是糖代谢途径(Harris途径),分别由 BAT基因编码的氨基酸转氨酶[14-15]和YDL080C基因编码的类丙酮酸脱羧酶调控[16]。本实验室前期敲除了野生菌株AY15的单倍体A8和C22基因组上的YDL080C基因,但获得的突变菌株生成的异丁醇、异戊醇及总高级醇与野生菌株相比没有明显变化[17];因此又构建了氨基酸分解代谢途径中细胞质氨基酸转氨酶的编码基因BAT2完全缺失的突变株A8-B和C22-B[18],但突变株染色体上带有G418抗性基因KanMX且单倍体突变株不稳定,不能进行工业生产,因此必须去除抗性基因KanMX并将其杂交成双倍体,构建优良的低产高级醇基因工程安全菌株。
本实验通过Cre/loxp系统去除BAT2完全缺失的突变株A8-B和C22-B染色体上的G418抗性基因KanMX,并将其杂交为双倍体ΔBAT2,且双倍体具有良好的遗传稳定性。白酒发酵试验结果显示,构建的基因工程安全菌株ΔBAT2与出发菌株A8-B和C22-B相比,CO2失重高,残糖低,乙醇含量高;与野生菌株AY15相比,高级醇明显降低。ΔBAT2生成的异丁醇、异戊醇、总高级醇分别为4.30 mg/100 mL、13.86 mg/100 mL、23.53 mg/100 mL,比野生菌株分别降低了50.00%、33.40%、30.57%。
基因工程安全菌株ΔBAT2的构建不仅实现了低产高级醇,而且去除了G418抗性基因,具有双倍体的遗传稳定性,可直接用于白酒工业生产,这个实验成果对改善白酒品质,提高我国酿酒工业的生产技术水平和国际竞争力具有重要意义。
[1] Lucie A Hazelwood,Jean-Marc Daran,Antonius J A van Maris,et al.The Ehrlich pathway for fusel alcohol production:a century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbilolgy,2008,74(8):2 259 -2 266.
[2] Ough C,Guymon F.Formation of higher alcohols during grape juice fermentation at various temperatures[J].Journal of Food Science,1966,31(4):620 -625.
[3] Hoess R,Abremski K,Sternberg N.The nature of the interaction of the P1 recombinase Cre with the recombining site loxP [J].Cold Spring Harb Symp Quant Biol,1984,49:7 612-7 681.
[4] Hoess R H,Wierzbicki A,Abremski K.The role of the loxP spacer region in P1 site-specific recombination[J].Nucleic Acids Research,1986,14(5):2 287 -2 300.
[5] Johannes H Hegemann,Ulrich Güldener,Susanne Heck,et al.A new efficient gene disruption cassette for repeated use in budding yeast[J].Nucleic Acids Research,1996,24(13):2 519-2 524.
[6] Gueldener U,Heinisch J,Koehler G J,et al.A second set of loxP marker cassettes for Cre-mediated multiple gene knockouts in budding yeast[J].Nucleic Acids Research,2002,30(6):e23.
[7] Jan Faix,Lisa Kreppel,Gad Shaulsky,et al.A rapid and efficient method to generate multiple gene disruptions in dictyostelium discoideum using a single selectable marker and the Cre-loxP system[J].Nucleic Acids Research,2004,32(19):e143.
[8] 肖冬光,刘 青,李 静,等.酿酒酵母单倍体制备方法的优化[J].酿酒科技,2004,124(4):21 -22.
[9] Gietz R D,Woods R A.Yeast transformation by the LiAc/SS Carrier DNA/PEG method[J].Methods Mol Biol,2006,313:107-120.
[10] 吴帅,陈叶福,沈楠,等.高耐性酿酒酵母的杂交育种[J].酿酒科技,2006,148(10):20 -22.
[11] 王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005:110-112.
[12] 陈贻文.有机仪器分析[M].长沙:湖南大学出版社,1996:150-151.
[13] 李斌,帅桂兰,赵光鳌,等.猕猴桃酒中高级醇的研究[J].食品与发酵工业,2003,29(12):83 -86.
[14] Eden A,Simchen G,Benvenisty N.Two yeast homologs of ECA39,a target for c-Myc regulation,code for cytosolic and mitochondrial branched-chain amino acid aminotransferases[J].Journal of Biological Chemistry,1996,271(34):20 242-20 245.
[15] Kispal G,Steiner H,Court D A,et al.Mitochondrial and cytosolic branched-chain amino acid transaminases from yeast,homologs of the myc oncogene-regulated Eca39 protein[J].Journal of Biological Chemistry,1996,271(40):24 458-24 464.
[16] Dickinson J R,Lanterman M M,Danner D J,et al.A 13C nuclear magnetic resonance investigation of the metabolism of leucine to isoamyl alcohol in Saccharomyces cerevisiae[J].Journal of Biological Chemistry,1997,272(43):26 871-26 878.
[17] 郝欣,肖冬光,张翠英.酿酒酵母类丙酮酸脱羧酶基因缺失对高级醇生成量的影响[J].微生物学报,2010,50(8):1 030-1 035.
[18] Hao Xin,Xiao Dong-guang,Zhang Cui-ying,et al.Decreased higher alcohols production by BAT2 gene deletion mutants of industrial Saccharomyces cerevisiae[J].European Food Research and Technology,Applied Microbiology and Biotechnology,to be submitted.
