claR基因的扩增对棒状链霉菌棒酸合成的影响*
2012-01-12左志晗赵海龙
左志晗,赵海龙
(天津师范大学生命科学学院,天津市细胞遗传与分子调控重点实验室,天津,300387)
克拉维酸又名棒酸,是棒状链霉菌(Streptomyces clavuligerus)的代谢产物。其分子式为C8H9NO5,分子质量为199[1],在分子结构上是由β-内酰胺环与噻唑环构成的双环体系,为一稠合双环 β-内酰胺结构[2-3]。克拉维酸本身的抗菌活性很弱,但它具有强力、广谱且不可逆的β-内酰胺酶抑制活性[4]。
由于抗生素的大量使用,导致了细菌对很多药物的抗药性,这己成为临床上治疗细菌性疾病的一个越来越棘手的问题。克拉维酸因其独特的抑制β-内酰胺酶的活性,既抑制了耐药细菌的酶活性,又增强了这类抗生素的广谱抗菌作用。我国细菌耐药的严重程度已位居世界前列,但当前在我国临床上使用的上述复方β-内酰胺类抗生素来源主要是进口产品和合资企业的产品,并且微生物发酵是目前克拉维酸生产的主要途径[5]。因此提高棒状链霉菌克拉维酸产量的研究目前备受关注。
随着克拉维酸生物合成途径及基因调控的逐渐明确,在常规诱变、原生质体融合的基础上可以寄希望于通过基因工程的方法来获得克拉维酸高产菌株。由于克拉维酸的生物合成受到级联调控,故某些调控基因的变化可能会使克拉维酸产量获得提高[6]。
claR基因,位于克拉维酸基因簇中orf-7的下游,方向与cas2相反。它编码一个46.6 ku的多肽,该物质同许多LysR家族的转录调控因子具有同源性[7],其中与SnpR最相似,SnpR是S.lividans产生的一种蛋白,该蛋白可对编码一种中性蛋白水解酶的基因进行调控[8]。研究表明,claR的C末端与其它所有LysR的N末端具有相似性,
该区域包含一螺旋-转角-螺旋基元,起结合靶DNA从而激活转录的作用。claR的失活将产生头霉素C合成增加,克拉维酸合成缺失的突变,这种突变可积累克拉维胺酸。这表明claR影响克拉维酸后面合成步骤的基因,即由克拉维胺酸向克拉维酸的转化。
本研究选取棒状链霉菌的claR为目标基因,构建了含claR基因的重组质粒pSET152-claR,对棒状链霉菌的claR基因进行了扩增,并对所得的突变菌株的克拉维酸产量变化进行了研究。
1 材料与方法
1.1 菌株与质粒
克拉维酸产生菌棒状链霉菌S.clavuligerus NRRL3585,由沈阳药科大学何建勇教授惠赠;大肠杆菌DH5α和ET12567(pUZ8002)均为本实验室保存菌种。
PCR产物克隆载体 pUCm-T(AmpR),购自Sangon公司;大肠杆菌-放线菌穿梭质粒表达载体pSET152,由加拿大阿尔伯塔大学Annie教授惠赠提供。
1.2 培养基
LB培养基[9],用于大肠杆菌的培养,ET12567 培养基是在LB培养基中加入阿泊拉霉素(Am)、氯霉素(Cml)和卡那霉素(Km),使其终浓度分别为25 μg/mL,25 μg/mL,50 μg/mL;YMGA 培养基[10]、TSB培养基[11]及SS培养基[11]分别用于棒状链霉菌的产孢培养、种子培养及发酵培养。大肠杆菌-链霉菌接合培养基采用改良AS-1培养基[12],即参照Baltz等人[13]的方法进行了改良。筛选接合转移子是在改良AS-1培养基中添加阿泊拉霉素和萘啶酮酸,二者的使用浓度均为25 μg/mL。
1.3 酶和试剂
限制性内切酶、T4-DNA连接酶、Taq DNA聚合酶均购自大连宝生物工程有限公司;Long Taq DNA聚合酶购自天为时代;溶菌酶、蛋白酶K购自上海生工生物工程有限公司;克拉维酸标准品购自中央药品检定所,其他试剂均购自Sigma公司。
1.4 DNA体外重组
链霉菌总DNA提取、大肠杆菌和链霉菌属间接合转移方法参照文献[14]和文献[11]进行;大肠杆菌质粒提取和转化参照文献[15]进行。DNA限制性酶解片段的分离纯化及PCR产物的纯化均采用宝生物工程有限公司的DNA凝胶回收试剂盒,按其产品说明书进行。
以棒状链霉菌的总DNA为模板,利用 PCR扩增技术获得1.7kb的一段带有启动子的claR基因片段。参照文献[16]报道的棒状链霉菌调节基因claR的相应核苷酸序列,设计上下游引物(引物委托北京奥科生物工程有限公司合成):引物1:5'-CGGGACCGTATGTCCCGGGGCCGGA-3',引物 2:5 '-CGCCCCACCGACCAGGTCTGACACC-3'。PCR 反应条件:94℃ 2 min,61℃1 min,72 ℃ 2 min,30 个循环;72 ℃延伸15 min。
1.5 棒状链霉菌的发酵培养及发酵液中克拉维酸的检测
挖取YMGA斜面上的Streptomyces clavuligerus菌丝体接于TSB种子培养基中,于180r/min,28℃培养48h,然后转接于装有SS发酵培养基的挡板三角瓶中,180 r/min,28℃培养,分别在不同培养时间取样检测棒酸含量。
发酵液中克拉维酸的检测采用HPLC方法检测,具体步骤参照文献[17]。
2 结果
2.1 PCR克隆及重组质粒pSET152-claR构建
按图1所示技术路线构建基因表达载体pSET152-claR。以棒状链霉菌的染色体为模板,claR基因的上下游引物进行PCR扩增,得到1.7 kb的一段带有启动子的claR基因片段,将该PCR反应产物用T4 DNA连接酶连接到pUCm-T载体上,得到重组质粒pUCm-T-claR,转化E.coli DH5α感受态细胞,涂布于含 IPTG(终浓度1 mmol/L)、X-gal(终浓度40 μg/mL)和Amp(终浓度100 μg/mL)抗性的LB平板上筛选蓝白斑。随机挑取10个单克隆白斑,扩大培养后提取质粒,EcoRI-BamHI双酶切鉴定后,DNA测序。
对经测序正确的pUCm-T-claR进行EcoRIBamHI酶切,回收1.7 kb的claR基因片段,与经过同样酶切的载体pSET152进行连接,连接产物转化E.coli DH5α,经质粒提取,对重组质粒进行酶切验证,结果见图2。
由图 2可知,采用 EcoRI-BamHI双酶切pSET152-claR后得到1条1.7kb的DNA片段和1条5.5kb的 DNA片段,分别与 claR基因及载体pSET152的理论大小相吻。并且以EcoRI和BamHI分别单酶切pSET152-claR,产物大小一致且均在7~8kb之间,与理论值 7.2kb相符,表明重组质粒pSET152-claR结构正确。
2.2 接合转化子的获得
将质粒pSET152-claR转化到大肠杆菌ET12567(pUZ8002)中,与棒状链霉菌进行属间接合转移,得到较多的接合转化子,挑取阿泊拉霉素抗性接合子至含有25 μg/mL萘啶酮酸和含有25 μg/mL阿泊拉霉素的培养基上进行纯化,纯化后的接合转移子在无抗生素的YMGA培养基上进行松弛培养至充分产孢。收集孢子,进行系列梯度稀释。选择合适浓度的孢子涂布在不含阿泊拉霉素的培养基上进行连续传代,最后影印到含有抗生素阿泊拉霉素的培养基上,筛选得到仍具有阿泊拉霉素抗性的菌株1株,命名为S.clavuligerus∷claR。
2.3 转化子的验证
重组质粒pSET152-claR转入 S.clavuligerus后,通过pSET152上的attP位点,整个质粒可以特异性的插入到链霉菌基因组中的attB位点,从而将其携带的claR同时插入到S.clavuligerus的attB位点(图3),从而使其增加了一个拷贝的 claR基因。pSET152-claR与出发菌株的染色体同源区域发生同源双交换的示意图如图3所示。
参照棒状链霉菌attB位点两侧的序列设计一对引物(图3)P3:5’-AGCGGCCAAAGGGAGCAGACTGTAA-3’;P4:5’-CAGGATTCGAACCTGGGAAGGCTGA-3’,对出发菌株 S.clavuligerus及 S.clavuligerus∷claR的基因组 DNA分别进行 PCR验证,结果如图4。

图1 重组质粒pSET152-claR的构建过程
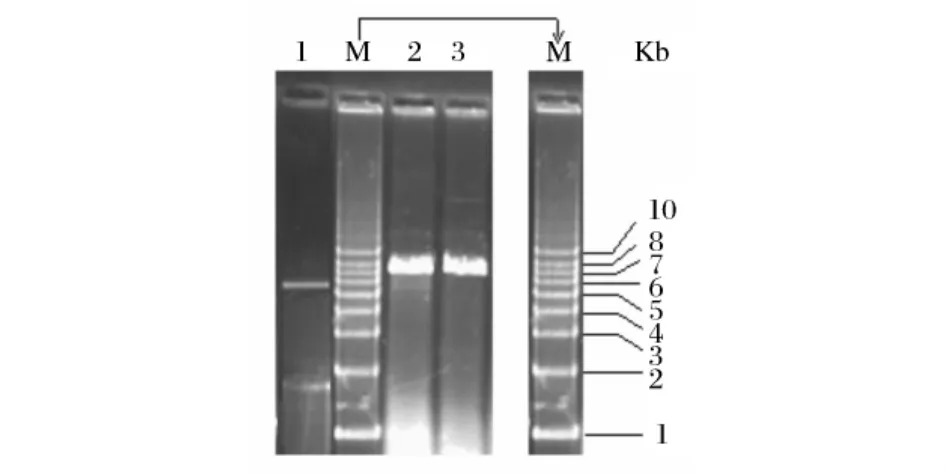
图2 重组质粒pSET152-claR的验证
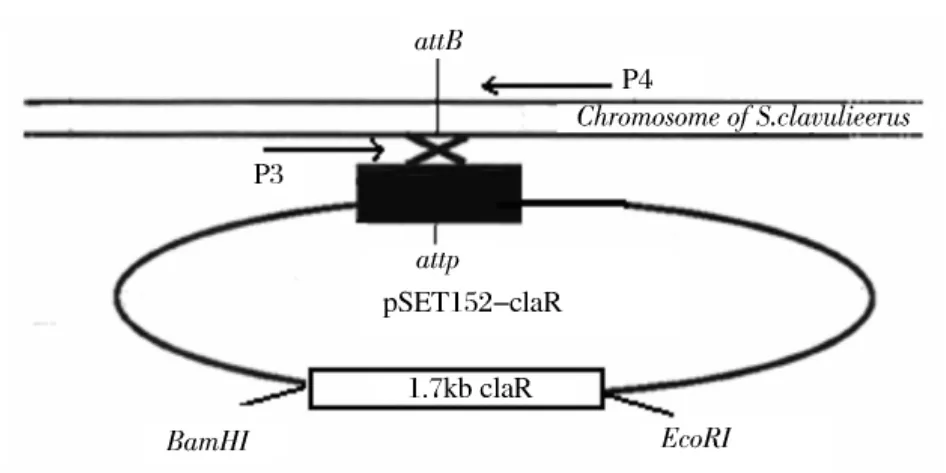
图3 pSET152-claR插入 S.clavuligerus染色体的示意图

图4 突变株S.clavuligerus∷claR的PCR验证
由图4可知,以引物3和引物4对出发菌株S.clavuligerus的基因组DNA进行PCR结果未能检测到PCR产物(attB两引物之间只有60bp),而以S.clavuligerus∷claR的基因组DNA为模板的PCR产物在7~8kb之间,与理论值7.2kb(7.2kb的pSET152-claR插入 S.clavuligerus的 attB位点)相吻合,说明pSET152-claR已整合插入到S.clavuligerus的attB位点。
2.4 S.clavuligerus claR产酸能力的测定
对出发菌株 S.clavuligerus及 S.clavuligerus∷claR分别进行发酵培养,不同发酵时间取样测定其克拉维酸产量,结果见表1:突变菌株S.clavuligerus:claR的克拉维酸产量在发酵120 h时达到最高,可达606.06 mg/L,较原始对照菌株提高了86%。
2.5 S.clavuligerus∷claR的遗传稳定性实验
将突变菌株S.clavuligerus∷claR在YMGA培养基斜面上进行传代培养,每转接一次同时转入发酵培养基中,摇瓶发酵培养120h后HPLC法测定克拉维酸的效价,结果如表2所示。

表1 突变菌株及原始菌株发酵液中克拉维酸产量的HPLC测定结果

表2 S.clavuligerus∷claR的遗传稳定性
由表2的传代实验结果可知,S.clavuligerus∷claR在6代之内产酸量较稳定,继续传代,则虽然菌种的抗性标记非常稳定但产酸量呈下降趋势,所以发酵培养应尽量控制传代次数在6代以内。
3 讨论
对于日益严重的β内酰胺类抗生素的耐药问题,棒酸因其具有强力、广谱且不可逆的β-内酰胺酶抑制活性,已作为特效药物被广泛用于临床,本研究尝试用分子生物学的方法定向改造原始生产菌的基因组:棒状链霉菌的claR基因拷贝对其克拉维酸的产量具有正调控作用,因此本实验尝试增加棒状链霉菌中的claR基因拷贝以提高克拉维酸的产量。采用接合转移的方法将重组质粒pSET152-claR转入了野生型S.clavuligerus中,由于载体pSET152含有一个attP位点,可以特异性的插入到链霉菌基因组中的attB位点,实现了在S.clavuligerus基因组中增加一个拷贝claR基因的目的,所得的突变株S.clavuligerus∷claR产酸量最高可达606.06 mg/L,较出发菌株提高了85.8%,菌株在6代之内的产酸量基本稳定,表明所构建的基因工程菌株稳定性较高,易于进行工业化生产。本研究为从分子水平改造菌种提供一个例证,对棒酸产量的提高提供一种可行的依据。
要实现ccaR基因的高效表达,选择合适的表达载体至关重要,本实验曾分别选择了链霉菌表达载体pIJ86和pSET152对claR进行表达,两种表达载体均为接合转移型质粒,其中pIJ86为高拷贝大肠杆菌-链霉菌穿梭质粒,其多克隆位点上游带有ermEp*强启动子,可实现克隆基因的高拷贝表达,采用pIJ86作为表达载体,让重组质粒在棒状链霉菌中复制,可以获得多个拷贝的claR基因,有效提高克拉维酸产量,但缺点是重组质粒在链霉菌中不稳定,容易丢失,且在菌体的培养过程中要始终加入抗性筛选压力,不利于工业化规模的生产;而载体pSET152含有一个attP位点,可以特异性的插入到链霉菌基因组中的attB位点,该方式是整合到基因组上的插入方式,所构建的基因工程菌株稳定性较高,易于进行工业化生产。
本研究曾选择了对棒状链霉菌紫外诱变所得的克拉维酸高产菌株S.clavuligerusB71-14的ccaR进行表达,实现了在S.clavuligerusB71-14基因组中增加一个拷贝ccaR基因的目的,所得的突变株S.clavuligerus∷ccaR 较出发菌株提高了 54%[18];S.clavuligerus的claR扩增后与经紫外诱变获得的高产菌株S.clavuligerusB71-14的ccaR扩增后相比克拉维酸产量提高的幅度更高,并不能表明扩增claR比扩增ccaR提高克拉维酸产量的能力更强,因为相对高产的克拉维酸产生菌S.clavuligerusB71-14,已经经过了反复的菌种诱变和筛选过程,其生物合成克拉维酸的能力已经有所提高,或者受过诱变处理的菌株,某些基因己经发生突变,使得克拉维酸合成提高的幅度不大,要想解释清楚这一现象,还需要进一步研究。
[1] Cole.Process for production of clavulanic acid[P].United States Patent,4110165.1978 -8 -29.
[2] Higgens C E,Kastner R E.Streptomyces clavuligerus sp.A-lactam antibiotic producer[J].International Journal of Systematic Bacteriology,1971,21(4):326 -330.
[3] Pitlik J,Townsend C A.The fate of[2,3,3 -2h3,1,2 -13C2 ],D,L-glycerate in clavulanic acid biosynthesis[J].Journal of the Chemical Society.Chemical Communications,1997,32(2):225 -234.
[4] 纪淳安.阿莫西林/克拉维酸和替卡西林/克拉维酸的作用特点和临床应用[J].国外医药.抗生素分册,1998,19(6):438-440.
[5] 白国义,马桂秋,侯曼玲.β-内酰胺酶抑制剂的研究进展[J].化学工业与工程,2001,18(6):395 -399.
[6] Liras P,Rodriguez-Gracia A.Clavulanic acid,a β-lactamase inhibitor:biosynthesis and molecular genetics[J].Applied Microbiology and Biotechnology,2000,54(4):467-475.
[7] Henikoff S,Haughn G W,Calvo J M,et al.A large family of bacterial activeator proteins[J].Proceedings of the National Academy of Sciences,1988,85(18):6 602 -6 606.
[8] Butler M J,Davey C C,Krygmsan P,et al.Cloning of genetic loci involved in endoprotease activity in Streptomyces lividans 66:a novel neutral protease gene with an adjacent divergent putative regulatory gene.[J].Canadian Journal of Microbiology,1992,38(9):912 -920.
[9] H C Lynch,Y Yang.Degradation products of clavulanic acid promote clavulanic acid production in cultures of Streptomyces clavuligerus[J].Enzyme and Microbiology Technology,2004,34(1):48 -54.
[10] Salowe S P,Marsh E N,Townsend CA.Purification and characterization of clavaminate synthase from Streptomyces clavuligetus:an unusual oxidative enzyme in natural product biosynthesis[J].Biochemistry,1990,29(27):6 499-6 508.
[11] Tobias K,Bibb M J,Mark J B,et al.Practical Streptomyces genetic:A Laboratory Manual[M].2 ed.London:John Innes Foundation Press,2000:311-334.
[12] Zuo Zhi-han,Wang Yan-ping.Application of lat gene disruptionto increase the clavulanic acid production of Streptomyces clavuligerus[J].Journal of Molecular Catalysis B:Enzymatic,2006,43(1 -4):102 -107.
[13] Baltz R H.Genetic recombination by protoplast fusion in streptomyces[J].Developments in Industrial Microbiology,1980,21:43 -54.
[14] Flett F,Mersinias V,Smith C P.High efficiency intergeneric conjugal transfer of plasmid DNA from Escherichia coli to methyl DNA - restricting Streptomycetes[J] .FEMS Microbiology Letters,1997,155(2):223 -229.
[15] Sambrook J,Russell D W编著.黄培堂等译.分子克隆实验指南(第三版)[M].北京:科学出版社,2002.
[16] Aidoo K A,Wong A,Alexander D C,et al.Cloning,sequencing and disruption of a gene from Streptomyces clavuligerus involved in clavulanic acid biosynthesis [J].Gene,1994,147(1):41 -46.
[17] Wang Yong-hua,Yang Bo,Ren Jie,et al.Optimization of medium composition for the production of clavulanic acid by Streptomyces clavuligerus[J].Process Biochemistry,2005,40(3/4):1 161-1 166.
[18] 白小佳,左志晗,王艳萍.增加ccaR基因剂量提高棒状链霉菌克拉维酸产量的研究[J].食品研究与开发,2008(8):67-70.
