响应面法优化Vc二步发酵新菌系产2-酮基-L-古龙酸的培养基
2012-01-12徐婷婷高明吕淑霞于晓丹张忠泽陈宏权
徐婷婷,高明,吕淑霞*,于晓丹,张忠泽,陈宏权
(1.沈阳农业大学生物科学技术学院,辽宁沈阳110866;2.中国科学院沈阳应用生态研究所,辽宁沈阳110016;3.东北制药总厂Vc公司,辽宁沈阳110028)
维生素C又称L-抗坏血酸(L-Ascorbic Acid),作为人体必需的维生素及抗氧化类物质,受到人们普遍关注,广泛应用于食品、医药、农产品开发等多个领域,需求量与日俱增[1]。上世纪70年代我国学者尹光琳发明了“二步发酵法”生产Vc[2],该方法工艺简单、成本低、“三废”少,已成为我国Vc工业生产的主要方法[3]。其中第2步将L-山梨糖转化为Vc前体2-酮基-L-古龙酸,由产酸菌—氧化葡萄糖酸杆菌(Gluconobacter oxydans)和伴生菌—巨大芽胞杆菌(Bacillus megaterium)共同完成。产酸菌单独生长和传代困难,对伴生菌依赖性较强。目前已知具有伴生能力的菌属有芽胞杆菌、假单胞菌、欧文氏菌、微球菌、荧光杆菌、变形菌、肠杆菌和酵母菌[4]等,但由于伴生能力较差,促产酸不稳定,菌株易污染等多方面因素,生产中常用的依然是巨大芽胞杆菌(Bacillus megaterium),菌种较单一。本文以短小芽胞杆菌(Bacillus pumilus)HJ-04作为伴生菌与产酸菌搭配,发现其能更好地促进产酸菌生长及产酸,经响应面优化[5]后新菌系的产酸量进一步提高,产酸周期缩短,具有良好的科研价值及应用前景。
1 材料与方法
1.1 材料
1.1.1 菌种巨大芽胞杆菌(Bacillus megaterium)B2980和氧化葡萄糖酸杆菌(Gluconobacter oxydans),由东北制药总厂提供。短小芽胞杆菌(Bacillus pumilus)HJ-04由沈阳农业大学生化实验室提供。1.1.2培养基(g/L)①种子培养基:山梨糖20,葡萄糖2,尿素1,玉米浆5,CaCO31,用H2O定容到1 L;pH 6.7,121℃灭菌30 min;②发酵培养基:优化前:山梨糖80(单独灭菌),尿素12,玉米浆10,KH2PO41,MgSO40.2,CaCO35,用H2O定容到1 L;pH 6.7,121℃灭菌30 min。优化后:山梨糖94.95(单独灭菌),尿素11.99,玉米浆14.13,KH2PO41,MgSO40.2,CaCO35,用H2O定容到1 L;pH 6.7,121℃灭菌30 min。
1.2 方法
1.2.1 菌种培养①混合菌种子培养:150 mL三角瓶装液量20 mL,向混合菌斜面中加入少量无菌水,刮下菌苔并混匀。吸取1 mL菌液接种到种子培养基中,29℃、180 r/min振荡培养24 h;②混合菌发酵培养:150 mL三角瓶装液量10 mL,吸取1 mL产酸菌种子培养液接种到发酵培养基中,29℃、180 r/min振荡培养48 h。
1.2.2 2-KGA含量的测定取2 mL发酵液于试管中,加入2 mL 7 mol/L H2SO4,100℃煮沸30 min。冷却后以1%淀粉作指示剂,用0.05 mol/L I2溶液滴定至蓝色为反应终点。按以下公式计算2-KGA生成量。

其中,M为I2溶液浓度(0.05 mol/L×2);V为I2溶液消耗体积(mL);A为2-KGA转化为Vc的转化率(%)(以63.1%计算);B为所取发酵液体积(mL);0.907 2为Vc分子量/2-KGA分子量;0.088 06为1 mL I2溶液相当于8.806 mg Vc[6]。
1.2.3 响应面分析使用Design-Expert软件进行响应面设计及分析[7-8]。
1.2.4 试验设计①单因素试验设计:其他因素不变,对发酵培养基主要营养物质L-山梨糖、尿素、玉米浆、碳酸钙分别设计5水平的单因素试验,接种后,28℃,180 r/min摇床培养48 h,每组重复3次,测定2-KGA含量,并计算糖酸转化率,分析各因素对混菌发酵产酸的影响;②Plackett-Burman试验设计:除碳源、氮源外,混菌生长产酸还需要多种无机盐及生长因子,利用Plackett-Burman试验可有效筛选对产酸影响显著的因素,进行响应面优化。根据文献记载[9-10],选择L-山梨糖、尿素、玉米浆、KH2PO4、MgSO4、CaCO36个因素作为考察对象,设计12组的Plackett-Burman试验,接种后,28℃,180 r/min摇床培养48 h,测定2-KGA含量,重复3次,分析数据筛选显著影响因子,各因素水平选择见表1;③响应面试验设计:筛选出显著影响因子后,以L-山梨糖、尿素、玉米浆浓度为自变量,2-KGA产量为响应值,采用Box-Behnken设计法设计3因素3水平的17组试验。根据单因素试验结果,以产酸量最大值对应的各因素浓度作为自变量中心点,利用公式xi=(Xi-X0)/ΔX对自变量进行编码,其中xi为自变量编码值,Xi为自变量真实值,X0为中心点处自变量真实值,ΔX为自变量变化步长,编码水平见表2。发酵液接种后,28℃,180 r/min摇床培养48 h,测定2-KGA含量,重复3次,进行响应面分析。

表1 Plackett-Burman试验因素水平表Table 1 Factors and levels of Plackett-Burman design

表2 Box-Behnken试验因素水平表Table 2 Factors and levels of Box-Behnken design
2 结果与分析
2.1 不同伴生菌对产酸菌产酸的影响
以实验室筛选的短小芽胞杆菌HJ-04和工业生产用菌株巨大芽胞杆菌B2980作为伴生菌分别与氧化葡萄糖酸杆菌搭配,测定发酵产2-酮基-L-古龙酸(2-keto-L-gulonic acid,2-KGA)量随时间变化(图1)。结果显示,HJ-04与B2980相比能够更好的促进产酸菌产酸,产酸量提高26%,产酸终点提前12 h,具有重要应用价值,为进一步提高2-KGA产量,对新组合菌系发酵培养基进行优化。

图1 不同伴生菌对产酸菌产酸的影响Fig.1 Effect of different strains on
2.2 发酵培养基的单因素分析
单因素试验结果显示,作为发酵培养基中的主要碳源及产酸菌产酸的底物,增加L-山梨糖浓度可增大2-KGA产量,但转化率相应降低,发酵终点延后,发酵成本增加,且高浓度L-山梨糖抑制2-KGA的合成[11](图2)。
尿素作为培养基中的氮源及pH调节剂参与菌体的生长及代谢,随尿素浓度的增加产酸量呈现先升后降的趋势,尿素浓度过高,明显抑制产酸(图3)。

图2 L-山梨糖浓度对新菌系产酸的影响Fig.2 Effect of L-sorbose concentration on
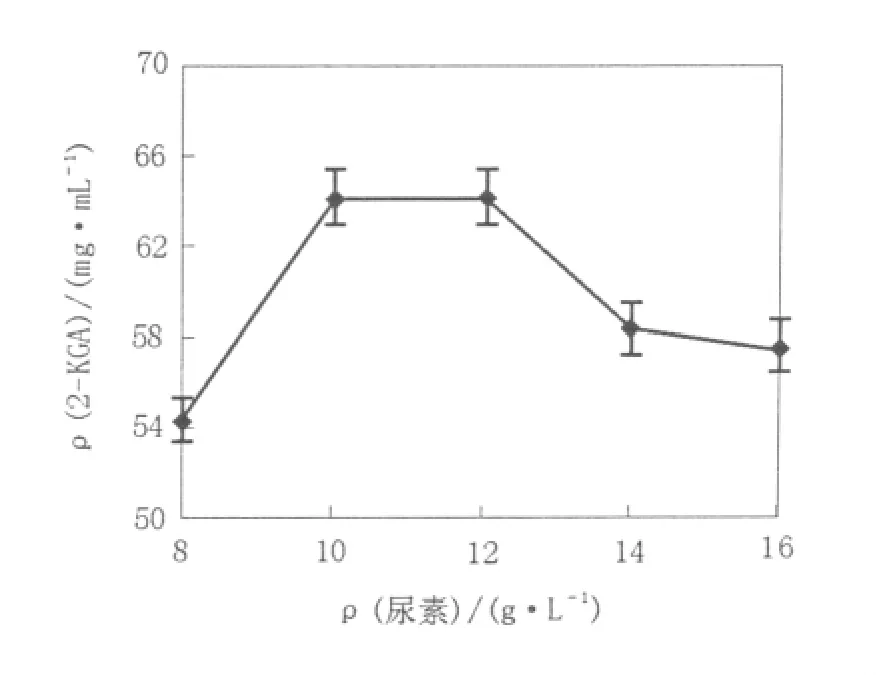
图3 尿素浓度对新菌系产酸的影响Fig.3 Effect of urea concentration on

图4 玉米浆浓度对新菌系产酸的影响Fig.4 Effect of corn steep liquor concentration on
玉米浆含有菌体生长所需的氨基酸、微量元素和天然物质,是产酸菌生长和产酸不可缺少的组分[12]。随玉米浆浓度的增加产酸量上升,达到一定浓度后受其他营养物质限制积累量不再提高(图4)。
已知伴生菌适合在偏碱性环境下生长,CaCO3的主要作用是中和发酵过程中产生的酸,避免pH过低抑制伴生菌生长进而影响产酸菌生长与产酸,适量的碳酸钙能够促进混合菌系发酵产酸(图5)。
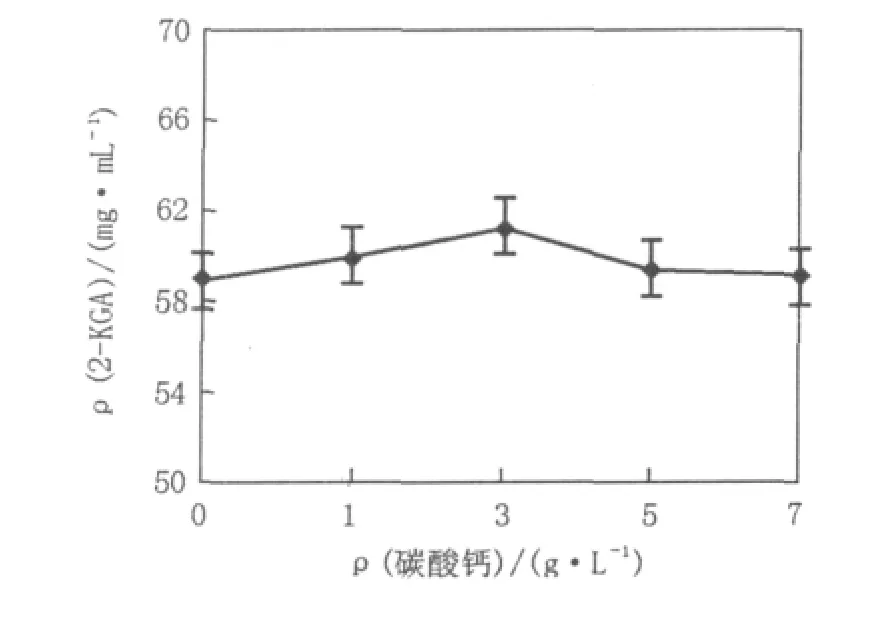
图5 碳酸钙浓度对新菌系产酸的影响Fig.5 Effect of CaCO3concentration on
2.3 显著影响因子的筛选
Plackett-Burman试验设计及结果见表3。
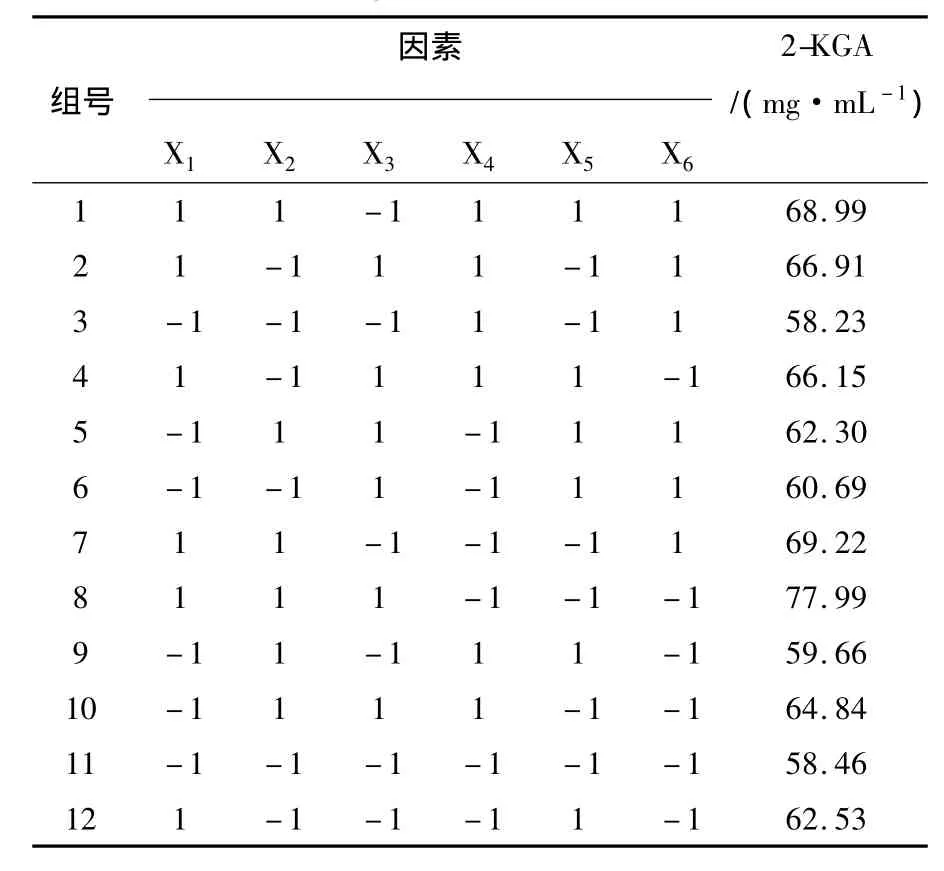
表3 Plackett-Burman试验设计及结果Table 3 Design and result of Plackett-Burman
对试验结果进行分析,各因素正负效应及显著性评价见表4,数据表明:在所选水平中,L-山梨糖、尿素、玉米浆为正效应因素,增大其浓度促进产酸,KH2PO4、MgSO4、CaCO3为负效应因素,浓度过高抑制产酸。依据显著性判断标准(P<0.05),L-山梨糖、尿素、玉米浆均为显著影响因子,因此选择此3因素进行响应面优化。

表4 各因素效应及显著性Table 4 Stdized effects and p-value
2.4 发酵培养基的响应面优化
2.4.1 Box-Behnken试验3因素3水平17组的Box-Behnken试验设计及结果见表5,其中12组试验为析因点,自变量取值在x1、x2、x3所构成的三维顶点,其余5组试验为零点,自变量取中心点,用以估计试验误差。

表5 Box-Behnken试验设计及结果Table 5 Design and result of Box-Behnken design
2.4.2 回归方程的方差分析对Box-Behnken
试验结果进行二次多项回归拟合,得到回归方程:

转化为真实值得到方程:Y=-369.621 25

其中Y为2-KGA产量预测响应值,x1、x2、x3为L-山梨糖、尿素、玉米浆编码值,X1、X2、X3为L-山梨糖、尿素、玉米浆真实值。
对回归模型方程(1)进行方差分析(表6)可知:二次回归模型极显著(P<0.000 1)。失拟项F=2.44,P=0.204 8>0.1,失拟项不显著,说明模型与试验不相符的概率较低,模型可信。模型相关系数R2=0.978 9,说明预测值与真实值之间有良好的拟合度,信噪比为16.192(>4),模型可用于预测。
分析模型一次项、二次项、交互项可知:一次项x1、x2、x3和二次项、、对产酸量影响均显著(P<0.05);交互项中,x1x3最为显著,x1x2次之,x2x3不显著,说明L-山梨糖与玉米浆、L-山梨糖与尿素对产酸量均会产生交互影响,尿素与玉米浆交互作用较小。
2.4.3 响应面交互作用及优化固定3因素之一在中心点,根据方程(2)做另外2因素对2-KGA产量的响应曲面图(图6~8)。由图可见,各因素曲面坡度均较陡,说明L-山梨糖、尿素、玉米浆对2-KGA产量影响显著,且产酸量都呈先升后降趋势,与单因素试验结果一致。L-山梨糖与尿素对2-KGA产量的交互影响如图6所示。尿素浓度较低时增加L-山梨糖浓度对2-KGA产量影响较小,产酸量较低,说明尿素供应不足严重抑制产酸,尿素浓度达到11 g/L以上,L-山梨糖方向曲面变陡,此时碳源及底物成为影响产酸的关键因素,且随L-山梨糖浓度增大,高浓度尿素对产酸的抑制作用减弱。固定尿素浓度在中心点,考察L-山梨糖与玉米浆的交互作用(图7)可知:L-山梨糖与玉米浆均处于较低浓度时,对产酸抑制明显,此时增加二者任一浓度都可有效提高2-KGA产量,推测二者含有混菌产酸所必须的类似营养物质;当玉米浆浓度小于14 g/L时,增加L-山梨糖浓度可持续提高产酸量,玉米浆浓度达到14 g/L以上,高浓度L-山梨糖对产酸呈现抑制作用,即高浓度L-山梨糖与高浓度玉米浆共同抑制产酸。
尿素与玉米浆交互作用对2-KGA产量的影响见图8。图中曲面较规则,等高线中心近似圆形,交互作用不明显。
曲面图均有最高点,求导方程(2)可知响应值存在极值点,此时L-山梨糖、尿素、玉米浆浓度分别为94.95、11.99、14.13 g/L,极值点处2-KGA预测产量为75.742 3 g/L。

2.5 优化结果验证
采用响应面优化后的培养基(L-山梨糖94.95 g/L、尿素11.99 g/L、玉米浆14.13 g/L、KH2PO41 g、MgSO40.2 g、CaCO35 g)进行摇瓶发酵,重复3次,测定2-KGA含量随时间变化曲线(图9),48 h达产酸终点,2-KGA平均产量76.9 mg/mL,与模型预测结果基本一致。相比优化前2-KGA产量提高12.31 mg/mL,产酸终点提前,产酸周期缩短约6 h,原料利用率提高,节约了发酵时间及成本。
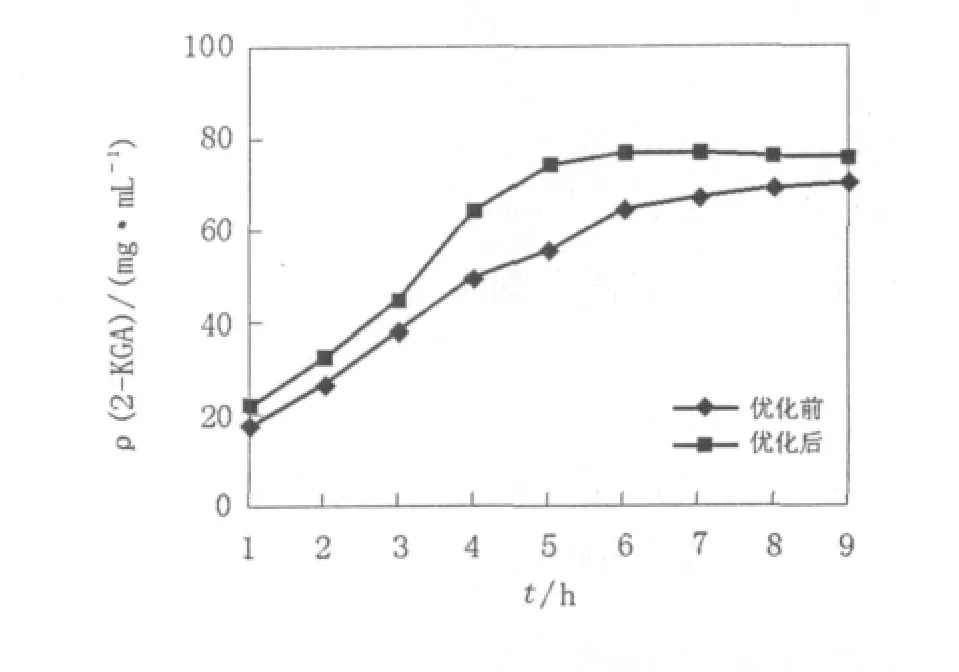
图9 优化前后新菌系2-KGA产量随时间变化曲线Fig.9 Time-course of 2-keto-L-gulonic acid production of new strains before and after optimization
3 讨论
以短小芽胞杆菌HJ-04作为Vc二步发酵中的伴生菌,国内外未见报道,丰富了伴生菌菌种资源。HJ-04促进产酸菌产酸的能力明显强于工业生产用菌株—巨大芽胞杆菌B2980,经响应面优化后,新组合菌系产酸量进一步提高,产酸周期缩短,具有广阔应用前景。
多种因素相互作用对混菌发酵产酸会产生不同程度的影响,考察单因素对产酸的影响缺乏交互信息,响应面法可精确考察各因素对响应值的综合作用。作为发酵培养基中的主要碳源及产酸菌产酸的底物,L-山梨糖浓度对2-KGA产量影响显著;尿素作为培养基中的无机氮源及pH调节剂,供应不足严重影响产酸;玉米浆含有菌体生长所需的多种天然物质,是产酸菌生长和产酸不可缺少的组分;CaCO3通过调节发酵液pH影响产酸。L-山梨糖、尿素、玉米浆是影响产酸的显著因素,对2-KGA合成有交互作用:增加L-山梨糖浓度可减弱高浓度尿素对产酸的抑制,高浓度L-山梨糖与高浓度玉米浆共同抑制产酸。响应面优化后确定L-山梨糖、尿素、玉米浆最佳浓度分别为94.95、11.99、14.13 g/L,48 h发酵终点2-KGA产量达到76.9 mg/mL,与预测吻合,模型可靠。
[1] 戴伟国.中国维生素C生产现状,动态及对策[J].上海医药,2003,24(10):460-461.
[2] 尹光琳,陶增鑫,于龙华,等.L-山梨糖发酵产生维生素C前体2-酮基-L-古龙酸的研究[J].微生物学报,1980,20(3):246-251.
[3] 宋文新,邵庆均.维生素C二步发酵合成法的研究进展[J].中国饲料,2008,(19):9-12.
[4] 李义,周彬,刘耀平,等.二步发酵新组合菌系的研究[J].微生物学通报,2002,22(2):26-32.
[5] 刘志祥,曾超珍.响应面在发酵培养基优化中的应用[J].北方园艺,2009,(2):127-129.
[6] 牛建双,吕淑霞,赵朔,等.玉米浆对Vc二步发酵产2-酮基-L-古龙酸影响的研究[J].微生物学杂志,2011,31(2):29-31.
[7] 方妍煜,冯志彬,张玉香,等.响应面分析法优化丹贝固体发酵条件[J].食品工业科技,2009,(4):168-170.
[8] Zhu Tao,Heo Hyojung,Row Kyungho.Optimization of crude polysaccharides extraction from Hizikia fusiformis using response surface methodology[J].Carbohydrate Polymers,2010,82(1):106-110.
[9] 李强,刁劲羽,向波涛.山梨糖发酵产生2-酮基-L-古龙酸氮源代谢规律[J].微生物学报,1996,36(1):19-24.
[10] 路新利,赵士豪,李宝库.维生素C二步发酵菌发酵条件的优化[J].食品科技,2008,(3):34-38.
[11] 路新利,马珦玻,赵士豪,等.山梨糖流加发酵高效生产2-酮基-L-古龙酸[J].中国食品添加剂,2005,3:33-36.
[12] Zhang Jing,Zhou Jingwen,Liu Jie,et al.Development of chemically defined media supporting high cell density growth of Ketogulonicigenium vulgare and Bacillus megaterium[J].Bioresource Technology,2011,102(7):4807-4814.
