思茅松毛虫肠道产脂肪酶菌株的筛选鉴定及酶学性质初步研究
2012-01-12孙佑赫周开艳熊智
孙佑赫,周开艳,熊智
(西南林业大学林学院,云南昆明650224)
昆虫肠道内寄居着大量的细菌,正常的肠道细菌是昆虫寄主生长发育、繁殖所必须的。近年来随着胃肠道微生态理论研究的逐步深入,对昆虫肠道菌群结构和产酶菌株的研究,已成为新的研究热点。目前,对白蚁、家蚕[1-3]等肠道菌群的研究报道较多,同时亦发现各类产酶菌株的存在,并对酶学性质进行了研究[4-5]。脂肪酶(Lipase,EC 3.1.1.3)是一类在油水界面催化天然底物油脂(甘油三脂)降解为甘油和游离脂肪酸的酶,广泛存在于动物、植物和微生物中[6]。微生物脂肪酶比动植物脂肪酶作用的温度和pH范围宽,易获得较高纯度酶制剂,适合于工业上大规模生产[7]。以往,研究者多从土壤、淤泥中采集样品筛选产酶微生物,本实验以思茅地区严重危害各类松树的思茅松毛虫为实验材料,分离其肠道内产脂肪酶菌株。通过纯培养和16S rDNA序列分析,对产酶菌株进行初步鉴定和酶学性质研究,为开发新的具有应用价值的资源微生物增加新的认识。
1 材料与方法
1.1 材料
1.1.1 培养基①分离培养基(g/L):牛肉膏5,蛋白胨10,NaCl 5,琼脂18,pH 7.0~7.2;②脂肪酶筛选培养基(g/L):牛肉膏5,蛋白胨10,橄榄油10,琼脂15,pH 7.0~7.2;③种子培养基(g/L):同分离培养基,不加琼脂;④产酶发酵培养基[8-9](g/L):牛肉膏5,蛋白胨5,橄榄油10,KH2PO41,MgSO4·7H2O 0.5,(NH4)2SO41,pH 7.0~7.2。
1.1.2 主要试剂和仪器DNA提取试剂盒(天根公司)、2×Power Taq PCR MasterMix(BIOTEKE公司)、通用引物(TaKaRa公司),其余试剂均为分析纯;PCR仪(Biometra公司,TGRADIENT),高速离心机(Eppendorf公司)、凝胶成像分析仪(Bio-Rad公司,Gel-Doc XR+);电泳仪、灭菌锅、超净工作台、摇床、培养箱、紫外分光光度计等均为国产仪器。
1.2 方法
1.2.1 菌株的分离筛选采自云南普洱的思茅松毛虫幼虫,无菌水饲养24 h,排尽其肠道残余食物。无菌条件下解剖虫体取其肠道,研磨后,梯度稀释法涂布于分离培养基,37℃培养48 h。挑取表征形态各异的单菌落划线纯化,镜检至纯菌株后,使用点接法接种到筛选培养基,37℃培养48 h。然后观察记录筛选培养基中能产生透明圈的菌株。将初筛菌株接种于种子培养基,37℃、180 r/min摇床培养过夜。种子液以2%的接种量接种于产酶液体发酵培养基,相同条件下培养48 h。发酵液经10 000 r/min离心10 min,取上清液作为粗酶液测酶活。
1.2.2 酶活力测定及酶学性质研究采用经典的聚乙烯醇橄榄油乳化液法[10-11]测酶活,每分钟催化脂肪水解产生1 μmol脂肪酸所需的酶量为1个酶活力单位(U/mL)。相对酶活力是指实验中所测得的酶活力值与最高酶活力值的百分比。酶的最适温度:分别测定不同反应温度下(25、30、35、40、45、50℃)酶活力,确定最适温度。酶的最适pH:PBS缓冲液调节底物pH为5.0、6.0、7.0、8.0、9.0、10.0,在最适温度下测酶活力,以确定最适pH值。
1.2.3 产酶菌株的分子生物学鉴定细菌DNA试剂盒提取产酶菌株基因组DNA,作为反应模板进行PCR基因扩增。体系:2×Power Taq PCR MasterMix 25 μL,通用引物(正向引物27f:5'-AGA GTT TGA TCC TGG CTC AG-3',反向引物1492r:5'-TAC GGC TAC CTT GTT ACG ACT T-3')各2 μL,DNA模板1 μL,无菌水补足50 μL;条件:94℃预变性5 min;94℃变性1 min,56℃复性1 min,72℃延伸3 min,30个循环;72℃最终延伸5 min。取50 μL PCR扩增产物,送华大基因公司测序。得到测序结果后登陆NCBI(http://www.ncbi.nlm.nih.gov/),在GenBank数据库中进行BLAST比对分析[12],寻找最相似的已知分类地位的序列。使用MEGA4.1软件的Neighbor-Joining法[13]构建系统发育树(bootstrap重复次数为1 000),以确定菌株的分类地位。
2 结果与分析
2.1 产脂肪酶菌株的筛选
从思茅松毛虫幼虫肠道内筛选出7株产脂肪酶菌株(D2、D7、D9、D12、D16、D17、D19),部分水解透明圈如图1所示。

图1 产脂肪酶菌株在筛选培养基上形成的透明圈Fig.1 Transparent hydrolysis circle by lipase-producing strains
2.2 产酶菌株酶学性质分析
2.2.1 酶最适作用温度各产酶菌株在不同的反应温度下测得的酶活力值如图2所示:这7株产酶菌所产脂肪酶的最适温度在30~40℃之间。D9、D16的最适温度是30℃,D7、D17的最适温度是35℃,D2、D12、D19的最适温度为40℃。其中D9和D16酶促反应的热稳定性稍差,在最适温度附近变化幅度大,相对酶活力达60%左右。
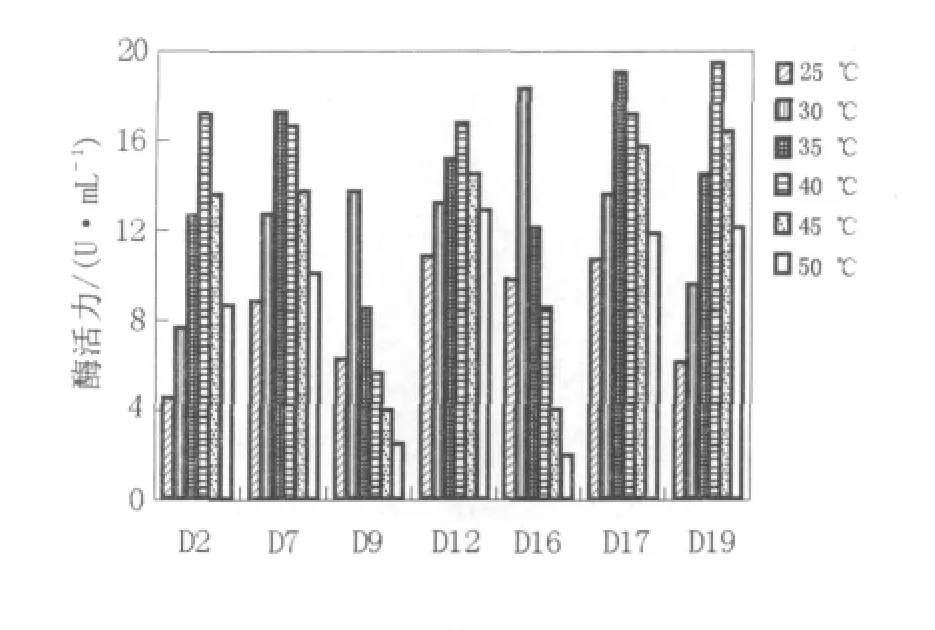
图2 温度对脂肪酶活力的影响Fig.2 Effect of temperature on the activity of lipase
2.2.2 酶最适作用pH在最适温度和不同pH条件下各产酶菌株的酶活力如图3所示:产酶菌株的最适pH集中在8.0~9.0之间,为碱性脂肪酶,在pH 8.0~10.0的范围内相对酶活力都比较高,达到80%以上,说明pH稳定性都比较好。
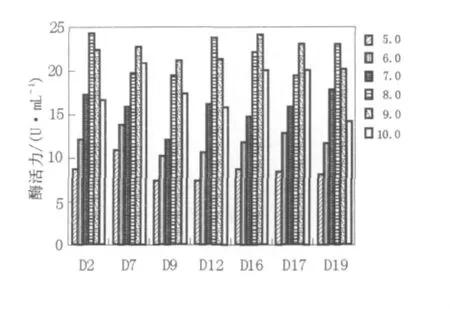
图3 pH对脂肪酶活力的影响Fig.3 Effect of pH on the activity of lipase
2.3 产酶菌株的鉴定结果
提取产酶菌株的基因组DNA并进行16S rDNA PCR扩增,通过BLAST比对分析,选取同源性在98%以上的序列构建系统发育树(图4)。由系统发育树可知7株产酶菌株分属3个属:D2、D12、D19属于假单胞菌属(Pseudomonas sp.),D7、D17属于芽胞杆菌属(Bacillus sp.),D9、D16属于克雷伯氏菌(Klebsiella sp.)。
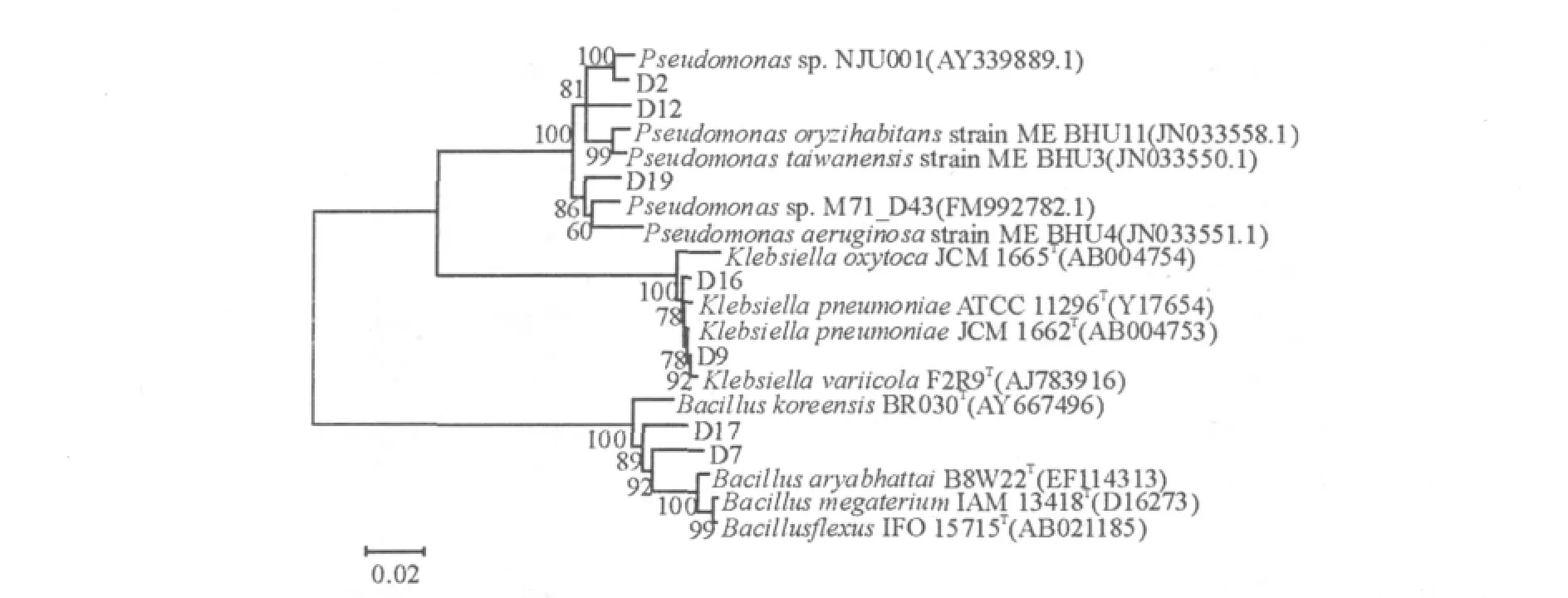
图4 产酶菌株的16S rDNA基因序列系统发育树Fig.4 Phylogenetic tree derived from 16S rDNA gene sequence of lipase-producing strains
3 讨论
本实验从思茅松毛虫幼虫肠道内分离筛选出7株产脂肪酶的菌株,经过对所产脂肪酶酶学性质的初步研究,确定这些酶作用的最适温度是30~40℃,最适pH是8.0~9.0,属于中温碱性脂肪酶,这与鳞翅目昆虫碱性(pH 8.0~10.0)肠道环境相关联。通过研究产酶菌株的产酶温度和pH,发现产酶菌株的酶活力与已报道的高产酶菌株酶活力[14]还有一定的差距,有待于进一步的实验研究,优化产酶条件或诱变育种等手段,提高产酶能力和酶活性。
对产酶菌株的16S rDNA基因序列测定和比对后,构建系统发育树,初步将这7株产酶菌株归属为假单胞菌属、芽胞杆菌属和克雷伯氏菌。这些种属细菌在天牛、家蚕、白蚁、蝗虫[15]等昆虫的肠道菌群中都有存在,此外常见的昆虫肠道细菌还有葡萄球菌属、链球菌属、微球菌属、肠杆菌属、乳杆菌属、变形杆菌属、不动杆菌属、气单胞菌属、埃希氏菌属、沙雷氏菌属等。
目前发现能产脂肪酶和用于工业生产的细菌有28个属,主要有伯克霍尔德氏菌、无色杆菌属、芽胞杆菌属、色杆菌属、产碱菌属、节杆菌属和假单胞菌属[16]。本实验筛选出的产脂肪酶细菌除包括2种常见的菌属外,还有一种克雷伯氏菌,从该属中分离到产脂肪酶菌株的研究很少见报道[17]。本实验中发现克雷伯氏菌产脂肪酶性质在开发新颖的资源微生物方面具有积极的研究意义。
[1] Thongaram T,Hongoh Y,Kosono S,et al.Comparison of bacterial communities in the alkaline gut segment among various species of higher termites[J].Extremophile,2005,9(3):229-238.
[2] 袁志辉,蓝希钳,杨廷,等.家蚕肠道细菌群体调查与分析[J].微生物学报,2006,46(2):285-291.
[3] Lehman R M,Lundgren J G,Petzke L M.Bacterial communities associated with the digestive tract of the predatory ground beetle,Poecilus chalcites,and their modification by laboratory rearing and antibiotic treatment[J].Microbial Ecology,2009,57(2):349-358.
[4] 邹昌瑞,魏国清,刘朝良,等.柞蚕肠道菌群分析及产酶菌的筛选与鉴定[J].中国农业科学,2011,44(12):2575-2581.
[5] 高绘菊,路国兵,查传勇,等.家蚕肠道产酶菌的分离与筛选[J].蚕业科学,2007,33(2):228-233.
[6] Shimizu S,Nakano M.Structural characterization of triacylglycerol in several oils containing gamma-linolenic acid[J].Bioscience Biotechnology and Biochemistry,2003,67(1):60.
[7] 张树政.酶制剂工业[M].北京:科学出版社,1984.
[8] 董明奇,史岩,姜春雷,等.脂肪酶高产菌株的筛选及酶学特性研究[J].四川大学学报:自然科学版,2008,45(4):985-990.
[9] 张搏,杨江科,苏华武,等.脂肪酶产生菌的筛选、鉴定及其产酶条件优化[J].生物技术,2007,17(1):23-26.
[10] Macrae A R,Hammond A R.Present and future applications of lipase[J].Biotech Genetic Eng Rev.,1985,(6):855-863.
[11] Hobson P N,Summers R.Effect of growth rate on the lipase activity of a rumen bacterium[J].Nature,1966,209(5024):736-737.
[12] Altschul S F,Gish W,Miller W,et al.Basic local alignment search tool[J].Journal of Molecular Biology,1990,215(3):403-410.
[13] Thompson J D,Gibson T J,Plewniak F,et al.The CLUSTALX windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25(24):4876-4882.
[14] 孟玲,王惠.脂肪酶产生菌的筛选及产酶条件优化[J].沈阳化工大学学报,2010,24(1):15-19.
[15] 刘玉升,李明立,刘俊展,等.东亚飞蝗肠道细菌的研究[J].中国微生态学杂志,2007,19(1):51-54.
[16] Jaeger K E,Eggert T.Lipases for Biotechnology[J].Current Opinion in Biotechnology,2002,13(4):390-397.
[17] 谭有将,谢小燕,王群,等.克雷伯脂肪酶产生菌产酶条件优化及其粗酶性质研究[J].江苏农业科学,2010,(4):355-357.
