噪声对豚鼠耳蜗血管纹紧密连接蛋白claudin-5表达及血迷路屏障通透性的影响△
2012-01-11吴永翔朱国霞刘新秦米文娟刘顺利卢连军
吴永翔 朱国霞# 刘新秦 米文娟 刘顺利 卢连军
研究表明噪声可以引起血迷路屏障的改变,从而造成耳蜗内环境改变(如内耳内外淋巴液渗透压、离子浓度或/和代谢机制失衡),这与噪声导致听力损失的机制有关[1]。而血迷路屏障(blood-labyrinth barrier,BLB)是存在于血液和内耳迷路之间的具有选择通透性的一种生理屏障系统,其作用在于保持迷路成分的相对稳定,维持内耳微环境的平衡,从而保证内耳功能的正常[2,3],它主要由耳蜗外侧壁血管纹、螺旋韧带处连续无窗的毛细血管内皮细胞,边缘细胞之间和基底细胞之间的致密闭锁带以及蜗轴细胞间的紧密连接复合体构成[4]。而血管纹毛细血管是血迷路屏障重要的形态学基础,其血管内皮细胞接触面近管腔侧和边缘细胞之间均为紧密连接(tight junction,TJ),此外微血管的周细胞也通过紧密连接包绕血管内皮细胞[5]。
紧密连接结构中的核心部分是TJ相关蛋白,它包括咬合蛋白occludin、闭合蛋白claudins、连接粘附分子(junctional adhesion moleculos,JAM),以及闭合小环蛋白(ZO-1等),其中闭合蛋白claudins家族可以与其它连接蛋白形成致密的紧密连接复合体,从而保证血迷路屏障的结构与功能,其表达具有组织特异性,大多数组织表达多种claudins[6]。有研究指出claudin-5在内耳血管纹边缘细胞和基底细胞之间表达均为阴性[7],但其微血管内皮细胞之间是否存在claudin-5表达却鲜有报道。
本文拟观察噪声对豚鼠BLB中TJ及紧密连接蛋白claudin-5表达的影响,以期为临床噪声性聋的治疗提供理论依据。
1 材料与方法
1.1实验动物分组及噪声性聋模型的建立 40只健康成年雄性白化豚鼠,体重250~350 g, 耳廓反射灵敏,鼓膜完好(由第四军医大学实验动物中心提供),随机分为正常对照组(20只)和噪声暴露组(20只),正常对照组不予噪声暴露,噪声暴露组给予声强为115 dB SPL白噪声暴露,每天6小时,连续两天,噪声暴露期间,豚鼠均能自由活动和饮食饮水,与正常对照组豚鼠无异。
1.2实验方法
1.2.1听性脑干反应(ABR)检测 将各组豚鼠置于屏蔽隔声室内,用ABR检测仪(Bio-logic Systems,美国)检测双耳反应阈值。豚鼠腹腔注射2%戊巴比妥钠盐40 mg/kg麻醉,记录电极置于颅顶正中皮下,参考电极置于测试耳耳后皮下,接地电极置于鼻尖。采用click声刺激,频率13次/秒,由TDH49耳机输出,扫描时间为10 ms,滤波范围100~3 000 Hz,叠加256次,以波Ⅲ为标准判断反应阈。检测过程中保持豚鼠体温恒定。各组于实验前、噪声暴露后次日行ABR检测,检测完后进行后续实验。
1.2.2基底膜铺片FITC鬼笔环肽染色 每组豚鼠各取2只,快速断头取双侧听泡,圆窗、蜗尖刺开,4%多聚甲醛体外灌流,同样固定液固定2小时后,于体视显微镜下行基底膜全层剥离;将标本放入1%正常胎牛血清白蛋白封闭30分钟,FITC鬼笔环肽(Enzo,德国,1:50)孵育30分钟(避光),再用0.01 M PBS漂洗,铺片、甘油封片,显微镜(OLYMPUS BX-5,日本)下观察并照相。于基底膜底回三排外毛细胞处放大400倍,连续抽取5个视野进行外毛细胞计数并测量该视野下外毛细胞所占基底膜的面积,计算出单位面积外毛细胞数(外毛细胞数/外毛细胞所占基底膜面积)并进行统计学分析,如视野周边出现不完整的细胞则只记一边。
1.2.3硝酸镧透射电镜和常规透射电镜标本制备与观察 每组豚鼠各取2只,用新鲜配制好的硝酸镧-二甲胂酸钠固定液体内灌注充分后(目的在于检测血迷路屏障通透性),断头取双耳听泡。置入固定液后于4 ℃冰箱保存至少24小时,常规透射电镜标本则用2.5%戊二醛经蜗尖和圆窗膜体外灌流固定液固定2小时;固定好的标本经洗液漂洗4小时,于体视显微镜下取出耳蜗血管纹后,用1%锇酸固定2小时,梯度丙酮脱水,按照每回上半回、下半回的顺序放入平板中Epon812定向包埋。制作半薄切片、染色、定位后,超薄切片、铀染、铅染、滴网后,透射电镜观察。
1.2.4Western blot 检测 各组豚鼠取12只迅速断头,分别取出双侧听泡和眼球,于体视显微镜下迅速取出耳蜗外侧壁血管纹和视网膜后,将组织冻存于-80 ℃冰箱待测,整个取材过程均置于冰上或冰水中操作。
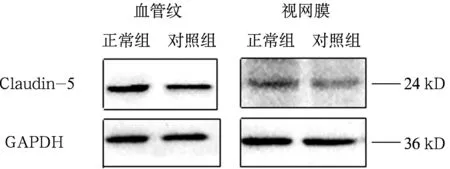
提取组织蛋白前,先将冻存于-80℃冰箱的两组血管纹和视网膜组织标本称重后,分别放入标记好的匀浆器中,加入事先配好的组织裂解液,冰上充分匀浆,12 000 rpm,4 ℃,离心10分钟,收集上清液后,所得即为制备好的蛋白样品。吸取少量的蛋白样品,按1:20稀释成工作液后,用BCA法进行蛋白定量。按每个泳道5 μg加载于SDS-PAGE凝胶电泳孔中,用恒压120 V/40 mA电泳至溴酚蓝位于凝胶底边,再用恒流300 mA转印于NC膜上。丽春红染色,TBST缓冲液配置的50 g/L脱脂奶粉室温下封闭2小时,然后加入兔抗豚鼠claudin-5一抗及兔抗GAPDH(Santa Cruz,美国,1:200),4 ℃过夜,TBST缓冲液洗膜2次,每次10分钟,再用TBS缓冲液洗膜1次,10分钟,加入HRP标记的二抗(Invitrogen,美国,1:5 000 ),37 ℃孵育1小时,洗膜3次,每次10分钟;然后ECL化学发光系统检测claudin-5及GAPDH的蛋白表达水平。用蛋白marker分析阳性条带的分子量大小,并用TANON高清晰度计算机图像分析系统进行灰度扫描分析,检测分析目的蛋白的表达量。其中视网膜组织为阳性对照,claudin-5抗体可识别相应的蛋白,GAPDH作为内参,分别于Mr 24KD和36KD出现阳性条带,灰度扫描软件系统分析。
1.2.5免疫组织化学染色 每组各取2只豚鼠,用新鲜配制的4%多聚甲醛体内灌注充分后,断头取双侧听泡。再刺开蜗尖和圆窗膜,用4%多聚甲醛分别从蜗尖和圆窗膜灌流数次,置入固定液后于4 ℃冰箱保存至少24小时;10%EDTA脱钙两周,置于30%蔗糖浸泡24小时;OCT胶包埋,平行蜗轴以10 μm为厚度连续冰冻切片后,室温过夜晾干。切片先用0.01 M PBS洗片数次,再用0 .3%甲醇双氧水浸泡放置于37 ℃湿盒,10分钟,灭活内源性过氧化物酶,用0.01 M PBS洗片,滴加羊血清抗体封闭液(Jackson Immunoresearch Lab, 美国)37 ℃封闭30分钟;然后滴加一抗兔抗豚鼠多克隆抗体(Santa Cruz,美国,1:200);正常组和噪声暴露组分别设阴性对照组,阴性对照组均加入0.01 M PBS 替代一抗,4 ℃过夜。0.01 M PBS洗片数次,滴加生物素化羊抗兔IgG(即用型),37 ℃孵育30分钟;0.01 M PBS洗片后,滴加SABC,37 ℃,30分钟;洗片后加入新鲜配制的0.05%DAB和0.03%双氧水混合液显色2~5分钟,蒸馏水终止,0.01 M PBS洗片;经苏木素复染核后,乙醇梯度脱水,二甲苯透明,树胶封片。待干燥后显微镜下观察。
光镜下,血管纹边缘细胞层、基底细胞层、微血管内皮细胞间和管周,以及螺旋韧带微血管处的棕黄色颗粒均为阳性着色。其染色结果采用灰密度分析法,通过在不同组别的组织切片上选择相同区域、相同条件下用Image J软件进行光密度分析后,将所得数据进行统计分析。
1.3统计学方法 计量资料用均数±标准差表示,数据应用SPSS13.0统计软件分析,采用两独立样本t检验或One-way ANOVA方差分析进行统计学检验。
2 结果
2.1两组豚鼠ABR反应阈 噪声暴露组豚鼠噪声暴露前后ABR波Ⅲ反应阈分别为17.08±2.52和61.88±10.41 dB SPL,其阈移超过40 dB,噪声暴露前后ABR反应阈比较差异有显著统计学意义(P<0.05);正常对照组为19.17±2.82 dB SPL,噪声暴露后两组反应阈差异也有统计学意义(P<0.05),说明造模成功。
2.2两组耳蜗基底膜FITC染色结果 正常对照组外毛细胞排列整齐,纤毛方向一致呈V或W型,而噪声暴露组可见基底膜毛细胞大量缺失,纤毛排列紊乱,出现倒伏或融合消失(图1)。正常组和噪声暴露组基底膜底回单位面积外毛细胞数分别为(5.83±0.22)×103、(4.07±0.26)×103个/mm2,后者明显少于前者(P<0.05)。
2.3透射电镜观察结果 常规透射电镜观察可见,噪声暴露组噪声暴露后血管纹结构紊乱,组织细胞有不同程度的变性水肿和坏死,微血管管腔变形,管壁基膜电子密度降低并出现复层化,腔内有大量膜性结构;同时,血管纹微血管内皮细胞之间和边缘细胞之间的紧密连接均有破坏和松解,细胞间双层结构消失,连接松散并间隙增大;而正常组血管纹结构正常(图2)。

图1 豚鼠基底膜铺片FITC染色(Scale bar: 20 μm)
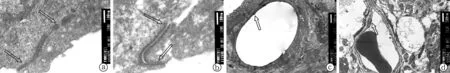
图2 正常组和噪声暴露组豚鼠耳蜗血管纹常规透射电镜结果(箭头所示处为细胞间紧密连接)
硝酸镧透射电镜下可见正常组镧颗粒均局限于微血管管腔内,部分内皮细胞间向管腔面可见少量镧颗粒但其均未穿过紧密连接;而噪声暴露组镧颗粒穿过受损的内皮细胞间紧密连接,大量沉积于微血管基膜的内外两侧和管腔外的中间细胞层(图3)。

图3 正常组和噪声暴露组豚鼠耳蜗血管纹微血管硝酸镧透射电镜结果(箭头所示处为镧颗粒渗透沉积部位)
a: 正常组镧颗粒大多位于微血管管腔内壁,未穿过内皮细胞间紧密连接;b: 噪声暴露组大量镧颗粒穿透受损的紧密连接,沉积于微血管基膜的两侧和微血管管腔外的中间细胞层
2.4两组血管纹紧密连接蛋白claudin-5的表达
Western blot结果分析示:两组血管纹中claudin-5均有较高表达,但噪声暴露组表达水平较正常组明显降低;而在阳性对照的视网膜中,两组claudin-5的表达并无明显不同(图4)。
2.5两组耳蜗免疫组织化学染色光镜观察结果
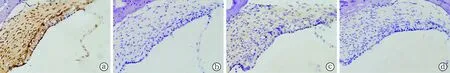
图5 正常组和噪声暴露组豚鼠耳蜗外侧壁中claudin-5的免疫组织化学染色(SABC×400)(Scale bar:100 μm)
正常组耳蜗血管纹毛细血管内皮、边缘细胞层、基底细胞层和螺旋韧带毛细血管内皮均有较强的棕黄色阳性颗粒着色;而噪声暴露组以上部位虽也有棕黄色颗粒着色,但染色深度较正常组明显浅。经图像采集分析系统软件分析各组免疫组化染色光密度值,结果示噪声组的光密度值[(23.50±0.74)×10-3]较正常组[(74.10±7.04)×10-3]明显下降,差异具有统计学意义(P<0.05)。两组阴性对照的耳蜗外侧壁处均未发现免疫信号(图5)。
3 讨论
噪声性聋的发生可能与机械损伤、氧化还原状态失衡、氧自由基损伤、微循环障碍、钙镁离子平衡失调、谷氨酸兴奋性中毒、毛细胞凋亡等因素有关[8.9]。耳蜗微血管内皮细胞的通透性正常对于维持内耳微环境的稳定极其重要,这对BLB功能意义重大,它同时也是内耳内淋巴液保持高K+、低Na+的前提。研究表明血迷路屏障的破坏与噪声性聋密切相关,耳蜗微血管内皮细胞通透性增高参与了噪声所致的早期听力损失[10]。本研究采用硝酸镧透射电镜和常规透射电镜观察,发现噪声破坏了豚鼠耳蜗血管纹处的紧密连接,使细胞间隙增大;正常情况下位于微血管管腔内的镧颗粒,通过受损的细胞间紧密连接,进入到微血管基膜内外两侧和中间细胞层中,表明噪声通过破坏细胞间的紧密连接,增加了BLB通透性。
正常耳蜗微血管内皮细胞间广泛存在的紧密连接保证了BLB的高选择通透性和内外淋巴液的正常循环,而紧密连接蛋白的高表达是内皮细胞间紧密连接结构和功能的基础;其中claudins对于屏障功能的维持和通透性的调节起着尤为突出的作用,它可以通过不同的信号通路,使自身蛋白发生磷酸化、去磷酸化或下调自身蛋白表达来实现调节屏障通透性的作用。claudins蛋白家族由24个跨膜蛋白亚型组成,分子量为20~27 kD,表达具有组织特异性,不同的claudin蛋白之间、claudin与occludin之间均能形成紧密连接复合物,从而发挥其功能[11~13]。claudin-5是紧密连接蛋白claudins家族中的一员,广泛存在于各种组织屏障中,它对紧密连接微环境极其敏感,并可通过与其它紧密连接蛋白相互作用,改变屏障的通透性。claudin-5在脑微血管循环内皮系统中表达丰富。研究认为claudin-5是脑血管内皮细胞通透性的最重要的调节因子,对血脑屏障通透性可能起着至关重要的调节作用[14,15]。大鼠脑缺血后,其血脑屏障可出现基质金属蛋白酶介导的紧密连接蛋白claudin-5下调[16]。
本研究通过Western blot染色分析,发现正常豚鼠耳蜗血管纹紧密连接蛋白claudin-5与视网膜相比有较高的表达,同时发现噪声可以下调其表达。免疫组织化学染色结果显示,正常豚鼠耳蜗外侧壁血管纹毛细血管内皮细胞、边缘细胞、基底细胞和螺旋韧带毛细血管内皮细胞处claudin-5免疫反应强阳性,噪声可以导致豚鼠耳蜗外侧壁血管纹上述细胞claudin-5免疫反应降低。进一步证实噪声负性调节了紧密连接蛋白claudin-5的表达。
因此,推测噪声可能激活了某些未知的细胞信号转导通路,致使紧密连接蛋白表达下调,导致细胞间的紧密连接破坏,进而引起血迷路屏障通透性增加,诱发一系列的病理性损害,如内耳内外淋巴液渗透压、离子浓度改变、代谢机制失衡等,从而导致噪声性听力损失。本研究结果提示紧密连接蛋白claudin-5的表达下调可能在噪声所致的BLB通透性改变中发挥一定作用,但其确切作用还有待于进一步的研究。
4 参考文献
1 Suzuki M, Yamasoba T, Ishibashi T, et al. Effect of noise exposure on blood-labyrinth barrier in guinea pigs[J]. Hear Res, 2002, 164:.12.
2 Juhn SK, Hunter BA, Odland RM. Blood-labyrinth barrier and fluid dynamics of the inner ear[J]. Int Tinnitus J, 2001, 7: 72.
3 Juhn SK, Rybak LP. Labyrinthine barriers and cochlear homeostasis[J]. Acta Otolaryngol, 1981, 91: 529.
4 白杨, 张学渊. 紧密连接蛋白occludin和ZO-1在豚鼠耳蜗外侧壁血管纹中的表达[J]. 第四军医大学学报, 2008, 29: 1 008.
5 Shi X. Cochlear pericyte responses to acoustic trauma and the involvement of hypoxia-Inducible factor-1α and vascular endothelial growth factor[J]. Am J Pathol, 2009, 174: 1 692.
6 Overgaard CE, Daugherty BL, Mitchell LA, et al. Claudins: Control of barrier function and regulation in response to oxidant stress[J]. Antioxid Redox Signal, 2011, 15: 1 179.
7 Kitajiri SI, Furuse M, Morita K, et al. Expression patterns of claudins, tight junction adhesion molecules in the inner ear[J]. Hear Res, 2004, 187: 25.
8 Le Prell CG, Yamashita D, Minami SB, et al. Mechanisms of noise-induced hearing loss indicate multiple methods of prevention[J]. Hear Res, 2007, 226: 22.
9 Prasher D. New strategies for prevention and treatment of noise-induced hearing loss[J]. Lancet, 1998, 352: 1 240.
10 Yang Y, Dai M, Wilson TM, et al. Na+/K+-ATPase a1 identified as an abundant protein in the blood-labyrinth barrier that plays an essential role in the barrier integrity[J]. PLoS One, 2011, 6: 16 547.
11 Florian P, Amasheh S, Lessidrensky M, et al. Claudins in the tight junctions of stria vascularis marginal cells[J]. Biochem Biophys Res Commun, 2003, 304: 5.
12 Lal-Nag M, Morin PJ. The claudins[J]. Genome Biol, 2009, 10: 235.
13 Findley MK, Koval M. Regulation and roles for claudin-family tight junction proteins[J]. IUBMB Life, 2009, 61: 431.
14 Nitta T, Hata M, Gotoh S, et al. Size-selective loosening of the blood-brain barrier in claudin-5-defcient mice[J]. J Cell Biol, 2003, 161: 653.
15 Liebner S, Fischmann A, Rascher G, et al. Claudin-1 and claudin-5 expression and tight junction morphology are altered in blood vessels of human glioblastoma multiforme[J]. Acta Neuropathol, 2000, 100: 323.
16 Yang Y, Rosenberg GA. MMP-mediated disruption of claudin-5 in the blood-brain barrier of rat brain after cerebral Ischemia[J]. Methods Mol Biol, 2011, 762:333.
