铬铁矿中铁的快速测定方法研究
2012-01-11李玉茹吴爱华喻星黄宝贵
李玉茹 吴爱华 喻星 黄宝贵
(长沙矿冶研究院,湖南长沙 410012)
铬铁矿中铁的快速测定方法研究
李玉茹 吴爱华 喻星 黄宝贵*
(长沙矿冶研究院,湖南长沙 410012)
研究了铬铁矿中铁的测定方法问题。基于测定铬铁矿中铬的溶样方法原理和对传统无汞测铁程序的改进研究,推荐了一个测定铬铁矿中铁的快速方法模式:试样经沸腾硫酸湿烧(~330℃)、磷-硫混合酸溶解、直接用三氯化钛溶液还原铁(Ⅲ→Ⅱ)、过量钛(Ⅲ)自然被氧化后,用常规法滴定之。所提供的快速方法测得之结果准确可靠(RSD=0.55%~0.80%,n=8),适于普遍推广应用。
铁;铬铁矿;无汞测铁方法;沸腾硫酸湿烧
1 引言
铬铁矿中的全铁(TFe)、氧化亚铁(FeO)以及总铬(TCr)等,在工业上都是重要的经济技术指标,故其在生产实践中均为必须检测的主要成分。但长期以来由于分解铬铁矿的溶样方法研究工作进展滞后而直接影响到简便、快速、实用检测方法的及时推出。因此,笔者通过对H2SO4高温湿烧铬铁矿的反应能使其物质结构发生相变反应机理研究和对相变反应过程原理应用的探讨等,相继成功解决了测定铬铁矿中FeO[1]和TCr量[2]的溶样方法问题,对测定其中TFe量的快速方法问题进行研究。
关于铬铁矿中TFe量的测定,在相关的报道[3-6]和标准分析方法[7-9]中所推荐的都是碱熔融法分解试样、沉淀Fe[Fe(OH)3]、过滤分离Cr(Ⅵ)、酸溶解之后再用常规方法测定之。显然,这对于大批量生产样品的分析,则很难适应。因此,快速溶样方法的推出与直接实现测Fe方法无汞化的问题,尤显重要。基于测定铬铁矿中TCr量的溶样方法原理[2]和对传统无汞测Fe程序[5-6,8-9]的改进研究,进而推荐了一个直接无汞测定铬铁矿中TFe量的快速方法模式。
2 实验部分
2.1 主要试剂及其质量(体积)浓度
H2SO4(AR);H3PO4(AR);中性红指示剂(1g/L);
TiCl3(A R)溶液[A液:原液(约15%)与HCl(1+1)溶液等体积稀释;B液:用HCl(10%)溶液将A液稀释至TiCl3(约1%)];CuSO4溶液(5g/L);二苯胺磺酸钠指标剂(5g/L);c(1/6K2Cr2O7)=0.03581和0.05mol/LK2Cr2O7标准溶液(用基准试剂配制)。
2.2 铬铁矿中TFe量的直接无汞快速测定方法模式
准确称取0.1~0.20g试样(粒度<75μm)于300mL三角瓶中,用少量水吹散试样,加入10mLH2SO4,摇动下于2000W电炉上加热至冒浓SO3白烟,并至烟雾腾空约6min,取下稍予冷却后加入10mLH3PO4,摇匀,再继续加热至冒浓烟(常摇动)并腾空至瓶壁的近2/3(或近瓶口)处时,取下冷却至60~70℃(其标志是手刚能持瓶的程度),摇动下沿瓶壁加入70mL水,充分摇匀后流水冷却至室温,加入1~2滴中性红指示剂(1g/L)(首先加入1滴,此时试液如呈蓝色或深蓝色,表明指示剂量已够,如呈淡蓝或绿蓝色,则需再补加入1滴),滴加TiCl3A液还原Fe(Ⅲ)至近终点时(试样呈现淡蓝或绿蓝色),改用滴加TiCl3B液还原至蓝色刚褪去并过量1滴(试液呈现亮绿色),加入2滴二苯胺磺酸钠指示剂,用少量水吹洗瓶壁,稍予放置,试液自然返回蓝色后即可用K2Cr2O7标准溶液滴定之(同时应带空白实验,因为市售的AR级H3PO4都含一定量的Fe,且每批H3PO4都不相同,故均应再检测其空白值。同时尚应指出,按照本文推荐的测定方法模式操作,空白值极易测得,毋需另添加Fe量)。
3 结果与讨论
3.1 存在问题
铬铁矿中TFe量的测定,需要解决的主要问题是如何实现溶样方法快速化和传统无汞测Fe方法简便化的问题等,所以将对其分别进行探讨和研究。
3.1.1 溶样方法改进问题
测定铬铁矿中的TFe量时,虽然碱熔融法分解试样最为彻底,且已广为应用[3-9],但由于操作周期长、劳动强度大、测定成本高等,直接影响其普遍推广应用。为能找到一种简便、实用的快速溶样方法,笔者对测定铬铁矿中TCr量时推荐的溶样方法原理[2]在TFe量测定中的具体应用以及其对含铁矿物溶解的完全程度问题等,进行了验证实验:选用不同矿区、不同含Fe量的铬铁矿试样,按2.2节所推荐的溶样模式,并参照文献[2]对溶后余渣中残留Cr量回收的检测方法,以便回收试样经沸腾H2SO4湿烧、H3PO4-H2SO4混合酸溶解后的余渣中残留的Fe量。对10个具代表性样品的检测结果(残Fe量分别为:0.0048%、0.0079%、0.014%、0.020%、0.0077%、0.012%、0.033%、0.011%、0.022%和0.033%等;试样中TFe量依次为:3.60%、9.80%、11.44%、14.84%、18.21%、22.80%、30.10%、32.16%、36.87%和44.36%等)指出,最终余渣中残留的Fe量都比较少,且已不影响常规量TFe测定结果的准确度;同时也证明,测定TCr量的溶样方法模式也适用于对其TFe量的测定。
3.1.2 传统无汞测Fe方法改进问题
传统的无汞法测定一般铁矿石中的TFe量时,操作程序比较简单,且存在的问题也比较少,但将其用于铬铁矿中TFe量测定时,除了必须解决溶样方法问题外,尚需解决共存的大量Cr(Ⅲ)离子自身颜色(绿色)对还原剂(TiCl3)还原Fe(Ⅲ→Ⅱ)反应终点(中性红或Na2WO4作指示剂)严重干扰的问题。目前普遍都采用的是碱溶样、沉淀Fe[Fe(OH)3]、过滤分离Cr(Ⅵ)、酸溶解之后再测定的方法[5-6,8-9]。显然,这种冗长的传统操作程序,既不宜于大批量生产样品之检测,更无法在本文所推荐的溶样方法模式中应用。因此,找到一种能克服大量Cr(Ⅲ)干扰的简便方法,尤为重要。所以笔者对传统无汞测Fe方法进行了筛选和验证,且已观察到,当用TiCl3作还原剂还原Fe(Ⅲ→Ⅱ)时,指示剂中性红溶液的加入量如能随试样中含Cr量的多少变化而予以适当控制,即可完全克服Cr(Ⅲ)的本底色对还原反应终点的干扰。实验同时指出,有一定量Cr(Ⅲ)存在时,试液呈绿色[Cr(Ⅲ)的本底色],当加入1滴中性红溶液(1g/L)后,试液即呈蓝色或深蓝色,如仍呈绿色或淡蓝色或绿蓝色,则表明指示剂的加入量不够,需再补加1滴。当试液中存在有<60mg(工业上要求均以Cr2O3量计[1])时,需加入指示剂量多少要视Cr2O3的存在量而定,当Cr2O3量≤28mg时,加1滴(~0.05mL),当Cr2O3量>28~55mg时,则需加2滴(~0.1mL)。因为实验同时也指出,中性红指示剂加入量只要能遮盖住Cr(Ⅲ)的本底颜色即可,其准确程度对检测结果并无明显影响,故对其加入的体积亦未作进一步量化规定,且在具体应用中也不必考虑Cr2O3存在量多少的问题,仅视加入中性红指示剂后试液所呈现的颜色正常与否,即可判断出其量够否,实际操作程序极易掌握。
在解决Cr(Ⅲ)离子对还原反应干扰问题的同时,也对消除过量还原剂(TiCl3)的简便方法问题进行了探讨。在无汞测Fe程序中,消除过量Ti(Ⅲ)的传统方法有两种类型:一是滴加氧化剂模式,即加入滴定Fe(Ⅱ)时所用的K2Cr2O7溶液(不计量)氧化过量Ti(Ⅲ)之后,试液返回蓝色(中性红作指示剂时)或蓝色褪去(Na2WO4作指示剂时),再用K2Cr2O7标准溶液滴定Fe(Ⅱ)[5-6,8-9];二是利用催化反应[加入Cu(Ⅱ)盐[10-12]或加热[13]催化]氧化模式,即催化试液中的溶解氧以及空气中的游离氧等氧化过量的少量Ti(Ⅲ),试液自然返蓝或蓝色自然褪去,继而测定之。考虑到前者引入了二次测定误差,加之Cr(Ⅲ)离子本底色的干扰,所以笔者对催化反应过程及其原理进行了探讨和研究。Cu(Ⅱ)盐催化反应在无汞测Fe中的应用研究,上世纪70年代已有报道[10-11],而且延续至今[12]。其原理是根据E0Ti4+/Ti3+电对的电位较低(-0.055V[14]),所以过量的少量Ti(Ⅲ)易被试液中的溶解氧氧化除去。但在该反应过程中存在有一个反应速度空间问题,故采用加Cu(Ⅱ)盐催化之。显然,反应速度的快慢与加入过量Ti(Ⅲ)量的多少以及催化剂Cu(Ⅱ)的存在量(μg)等,直接相关。实践表明,前者易于控制[采用两种不同浓度(v/v)的TiCl3溶液分段还原即可],而后者的存在量(μg)对催化反应过程速度空间变化影响的问题,则尚需作进一步探讨。
Cu(Ⅱ)盐作为催化剂,不仅存在有催化试液中的溶解氧氧化过量的少量Ti(Ⅲ)的反应,而且也可能有后催化Fe(Ⅱ)被氧化的反应存在[10];同时,由于Cu(Ⅱ)的存在量(μg)对催化反应过程有直接影响,所以报道中所加入的1滴CuSO4溶液(5g/L)的量为市售滴瓶1滴的量,其平均值约0.05mL,相当加入的Cu量约64μg[10]或者2滴(约0.1mL,相当Cu量约127μg)[11-12],且又指出了H3PO4的存在亦有可能引起Fe(Ⅱ)的后氧化反应产生[10]的问题等,所以特在H3PO4-H2SO4混合酸体系中对Cu(Ⅱ)盐催化氧化Ti(Ⅲ)和Fe(Ⅱ)的反应过程进行了研究。表1结果证明,按推荐的操作方法模式测TFe时,用约7.5%和约1%的TiCl3溶液分段还原Fe(Ⅲ→Ⅱ),至中性红的蓝色恰褪去,且后者稍过量(1~2滴)的条件下,加Cu(Ⅱ)盐与否,对其被氧化反应速度的催化作用,虽有一定影响,但不是特别明显,正如其中的1#和9#实验结果所指出的,少量过量的Ti(Ⅲ),即使无Cu(Ⅱ)盐存在,稍经放置(1~3min),试液中的溶解氧也能将其完全氧化(中性红指示剂自然返回蓝色)。笔者也注意到,这一有利因素在生产样品检测中表现尤为明显;其中可能有存在的H3PO4介质的影响,但更主要的似应来自试样本身可能含有的少量Cu的作用。所以本文对不同产地铬铁矿中Cu的分布率进行了考查(因工业上对其物质成分进行全分析时,一般都不要求检测Cu的含量[15])。表2结果指出,在Fe、Cr品位不同的铬铁矿中,均含有一定量的Cu(0.0016%~0.020%),其赋存状态规律虽不明显,但当1%的TiCl3溶液过量1滴时,基本上达到了表1指出的具催化剂作用的存在量(>15μg Cu)的水平。所以在生产样品检测中,似已无再添加Cu(Ⅱ)盐之必要。因此,推荐了不另加催化剂、还原后稍予放置、Ti(Ⅲ)即自行被氧化的操作模式,且其已被普遍推广应用(因已经过查证,在大多数铁矿石以及含铁的矿物原料中,都有一定量Cu的分布)。同时,表1中18~20#实验的结果也证明,大量H3PO4(~10%)的存在,对TFe量的准确测定并无明显影响。
3.2 样品测定结果
依2.2节推荐的方法模式,对铬铁矿国家一级标准物质和实验室管理样中的TFe量进行了测定,表3已证明本法所得结果的准确度比较理想(RSD=0.55%~0.80%,n=8);对各类生产样品中TFe量的测定结果(表4)同时也证明,本法与碱熔融法[6]数据一致,适于普遍推广应用。

表1 H3PO4-H2SO4混合酸体系中Cu(Ⅱ)的催化作用Table 1 The Catalytic effect of the Cu(Ⅱ)in the H3PO4-H2SO4mixed acidic system
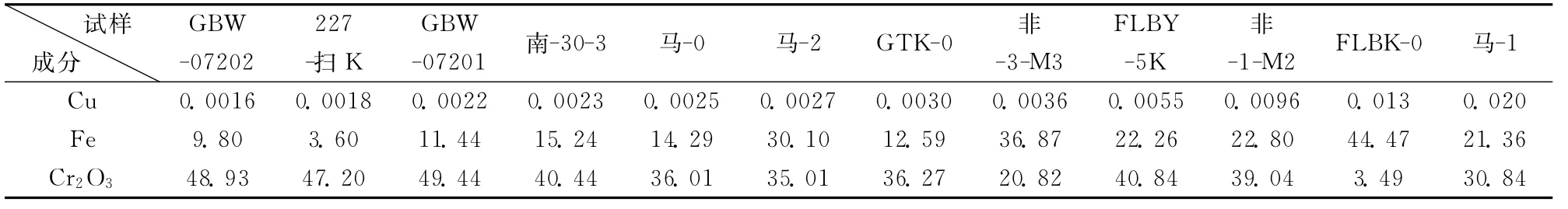
表2 不同地区铬铁矿中Cu的含量Table 2 The copper contents in the chromites collected from the different areas w/%
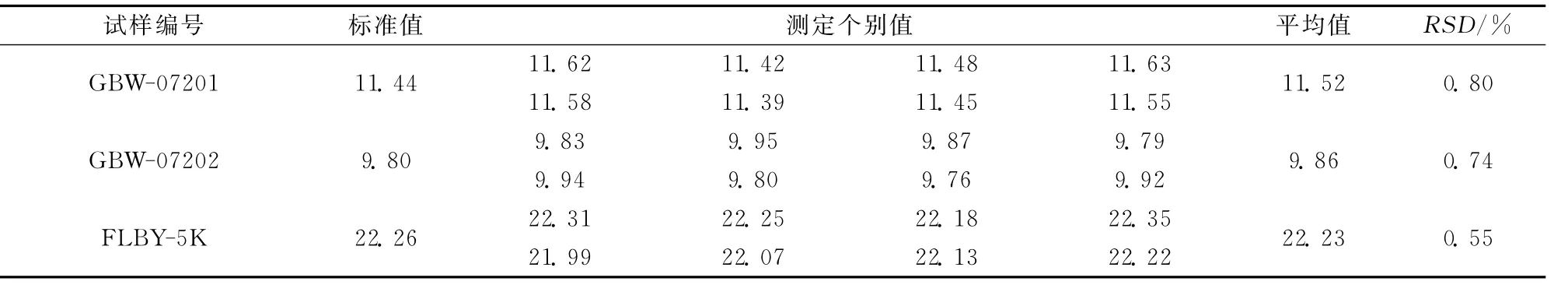
表3 标准物质与管理样中Fe的测定结果Table 3 Determination results of Fe in the reference materials and management samples w/%

表4 生产样品中TFe量的测定结果Table 4 Determination results of the TFe content in the production samples w/%
4 结语
铬铁矿的物质组成系尖晶石型结构[(Mg,Fe)(Cr,Al,Fe)2O4],属于难溶性物料,故对其主成分进行测定时,无论是专著或国标以及ISO方法等,均用碱熔融法分解试样。由于溶样方法的制约,致使其中的FeO到目前为止都未制定出标准分析方法来。笔者首次发现,H2SO4高温(~330℃)湿烧反应能使铬铁矿的物质结构发生相变,故其在H3PO4-H2SO4混合酸中的溶解反应明显变易,且在对其反应过程机理进行研究的基础上,先后解决了测定铬铁矿中FeO和TCr量的溶样方法问题;本文则是继其后,并结合对传统无汞测Fe程序的改进研究,从而推荐了一个直接无汞测定铬铁矿中TFe量的快速方法模式,适于各类化验室推广应用。
[1]李玉茹,周海波,吴爱华,等.测定铬铁矿中氧化亚铁的溶样方法研究[J].冶金分析,2011,31(3):55-59.
[2]周海波,李玉茹,吴爱华,等.快速测定铬铁矿中铬的溶样方法研究[J].中国无机分析化学,2011,1(4):29-32.
[3]西北地质科学研究所.铬铁矿石分析[M].北京:地质出版社,1977:53-54.
[4]岩石矿物分析编写组.岩石矿物分析(第一分册).第三版[M].北京:地质出版社,1991:327-328.
[5]王海舟,主编.冶金物料分析(上册)[M].北京:科学出版社,2007:322-325.
[6]曹宏燕,主编.冶金材料分析与技术[M].北京:冶金工业出版社,2008:799-801.
[7]ISO 6130:1985,Chromium ores-determination of total iron content[S].
[8]冶金工业信息标准研究院.YB/T 191.4—2001,铬铁矿化学分析方法-三氯化钛-重铬酸钾滴定法测定全铁量[S].北京:中国标准出版社,2001.
[9]中国钢铁工业协会.GB/T24225—2009铬矿石-全铁含量的测定-还原滴定法[S].北京:中国标准出版社,2009.
[10]杨汉清,岑块玲.三氯化钛-重铬酸钾容量法测定矿石中的铁[J].云南冶金,1975(10):61-63,60.
[11]马鞍山矿山研究院.黑色金属矿石分析[M].北京:冶金工业出版社,1977:11-13.
[12]薛明浩,王俊秀,张小燕,等.测定铁矿石中TFe的重铬酸钾滴定法改进实验[J].山东冶金,2009,31(2):49-50,53.
[13]黄宝贵,黄荣.加热催化法在无汞测铁中的应用[J].湖南冶金,1984,(3):56-58,63.
[14]Weast R C.CRC Handbook of Chamistry and Physics(70th ed.)[M].Florida:CRC press,Inc.1989:D-154,D-157.
[15]黄宝贵.化学物相分析在物料成分全分析数据处理中的应用[J].岩矿测试,2009,28(5):439-443.
Method Development for Rapid Determination of Iron in Chromite
LI Yuru,WU Aihua,YU Xing,HUANG Baogui
(ChangshaResearchInstituteofMiningandMetallurgy,Changsha,Hunan410012,China)
The problems existed in the method for determination of iron in chromite were studied.A new method for rapid determination of iron in chromite was developed based on the principle of the sample dissolution for determination of chromium in chromites and together with the improved procedure for rapid analysis of iron in chromites using the traditional mercury-free determination method.In this method,the sample first underwent wetting ablation(~330℃)in the boiled sulfuric acid and then was dissolved in the mixture of phosphoric acid and sulfuric acid.The iron(Ⅲ)was reduced to iron(Ⅱ)directly using titanium tri-chloride solution.After the excess titanium(Ⅲ)was naturally oxidized,the iron(Ⅱ)was titrated with the routine titration method.The results obtained by this newly developed method are accurate and reliable(RSD=0.55%~0.80%,n=8),thus,it is suitable to widely apply this method in the production practice.
iron;chromites;mercury-free determination of iron;boiled sulfuric acid wettingablation
O655.2;TD982
A
2095-1035(2012)01-0017-05
10.3969/j.issn.2095-1035.2012.01.0003
2011-09-29
2011-12-11
李玉茹,女,高工,主要从事化学物相分析测试及研究工作。E-mail:394105549@qq.com。
*通讯作者:黄宝贵,男,教授,主要从事化学物相及元素价态分析研究工作。E-mail:hbg8248@gmail.com。
