沉淀和络合反应体系中离子分布的计算方法研究
2012-01-11郑大录郑英勋范世华
郑大录 郑英勋 范世华
(1东北大学分析科学研究中心,沈阳 110819;2清津矿山金属大学,朝鲜清津)
沉淀和络合反应体系中离子分布的计算方法研究
郑大录1,2郑英勋1,2范世华1
(1东北大学分析科学研究中心,沈阳 110819;2清津矿山金属大学,朝鲜清津)
提出了一种计算方法,定量地计算了沉淀和络合化学反应体系中的金属阳离子和阴离子的分布,考察了影响沉淀和络合物形成的各种因素。基于提出的公式,计算了金、银、铜、镍阳离子和氰根阴离子的沉淀率,理论计算与实验结果一致。
离子沉淀率;络合物形成率;氰化物;分布
1 引言
同时形成沉淀和络合反应的多组分化学反应体系在有色金属化学选矿、湿法冶金、化学分析、废水处理等领域有着广泛应用。对这种复杂溶液体系中金属离子的分布进行定量描述并给予合理的解释,在化学分析和生产过程中有重要的意义[1-7]。
卤离子(Cl-,Br-,I-),氰根阴离子(CN-),硫氰酸根离子(SCN-)和氢氧根离子(OH-)等阴离子与一些金属阳离子反应会同时形成沉淀物和络合物。如在含有Ag+的溶液中,当加入的CN-浓度很小时,会有AgCN白色沉淀形成,而随着CN-加入量增大,则会形成、型络合物,使AgCN沉淀重新溶解在溶液中。在上述涉及沉淀和络合物生成的反应中,参与反应的试剂本身既是沉淀剂又是络合剂,因而反应中既有同离子效应,降低了沉淀的溶解度,又有络合效应,增大沉淀的溶解度。沉淀剂适当过量,同离子效应起主导作用,沉淀的溶解度降低。沉淀剂过量太多,则络合效应起主导作用,沉淀的溶解度增大。对形成沉淀物和络合物的溶液体系化学反应的研究,已有文献报道[4-11]。但对既存在沉淀反应又有络合反应的反应体系的研究,多局限单一组分,而对同时形成沉淀物和络合物的多组分化学反应体系综合考虑并进行解释的研究,鲜有报道。
提出了同时形成沉淀物和络合物的多组分化学反应体系的反应模型,给出了沉淀物和络合物分布的计算方法,基于上述公式,计算了混合溶液中金、银、铜、镍阳离子和氰化物的沉淀率,理论计算与实验结果一致。
2 主要试剂和实验方法
氯化金、氯化银、氯化铜、氯化镍、氯化镉、氯化锌、氰化钾、氢氧化钾,盐酸,以上试剂均为分析纯,水为二次去离子水。
金、银、铜、镍四种离子的沉淀率是通过火焰原子吸收分光光度法(AAS)测定反应后溶液中剩余的金属阳离子浓度,或将沉淀收集后再溶解用AAS法测定。CN-沉淀率通过比浊法进行。
3 多组分反应体系模型
溶液中的金属阳离子和试剂阴离子L-反应,在一定酸度下会同时形成型沉淀物和,,…,型络合物。反应体系的模型如图1所示。

图1 形成型沉淀物和型络合物的反应模型Figure 1.Reaction models for forming precipitate andcomplex.
其中为溶液中的金属阳离子(i=1,2,…,p),L-为阴离子,Yj为络合剂(j=1,2,…,h);图中实线“—”为主反应,虚线“---”为副反应。
这里定义金属阳离子()沉淀率Gi为形成沉淀的金属阳离子浓度与该金属阳离子总浓度之比,表示如式(1):

式中为溶液中某一金属阳离子()总浓度,[]为参与形成型沉淀反应的金属阳离子()浓度。与L-反应形成型沉淀物的金属阳离子(Mini+)浓度由式(2)给出:

式中[Mi′]为与阴离子(L-)形成沉淀和络合反应后溶液中剩余的游离金属阳离子()浓度,gij为金属阳离子()与阴离子(L-)反应生成的络合物的最大配位数。
金属阳离子()与试剂阴离子L-反应生成的络合物的浓度 []可依据条件累积稳定常数公式(3)[9-14]得出:

式中[L-]为与金属阳离子()形成沉淀和络合物后溶液中剩余的阴离子L-浓度,为络合物的条件累积稳定常数。
整理式(1)~(3),导出式(4):
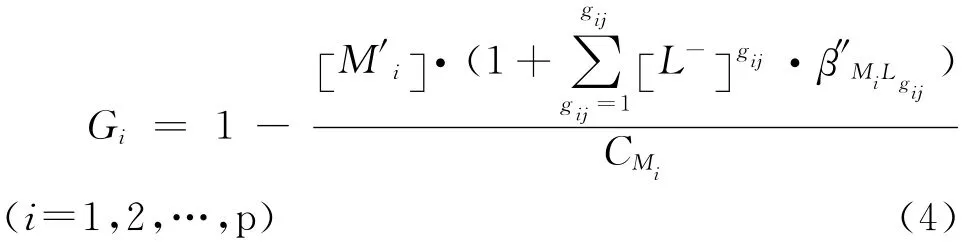
参与阴离子L-的反应而溶液中剩余的金属阳离子()浓度根据条件溶度积常数公式[12-14]可以表示如式(5):

式中为沉淀物的条件溶度积常数。
将式(5)代入式(1),整理得到任意金属阳离子沉淀率为式(6):

根据式(6)和(8),为了求出型沉淀物的沉淀率Gi和型络合物的形成率Fi,j,需要求出与金属阳离子()反应形成沉淀和形成络合物后溶液中剩余的阴离子L-浓度[L-]。
令反应体系中的阴离子L-总浓度为,则

根据式(1)和(7),对型沉淀物和型络合物分别有公式(10)、(11):

将公式(6)、(8)、(10)和(11)变形、代入式(9),整理得到式(12):

阴离子L-沉淀率GL-以式(13)表示:

将式(10)代入式(13),得到阴离子L-沉淀率GL-如式(14):

阴离子L-络合物形成率FL-以式(15)表示。

将式(11)代入试(15),求得阴离子L-络合物形成率FL-如式(16):

根据以上公式,反应体系内各种金属阳离子和阴离子的沉淀率和络合物形成率的计算框图如图2。
4 结果和讨论
用于实验的多组分混合溶液中阳离子及其浓度如表1所示。计算所需的金属氰化物沉淀的溶度积、金属氰络合物累积稳定常数、金属氢氧络合物累积稳定常数和氰氢酸的解离常数的数据可参看文献[12-14]。
将氰化物(氰化钾)加入组成如表1的溶液中时,溶液中氰化钾总浓度(CCN-)对溶液中金属阳离子和游离CN-的分布的影响如图3所示。图中分别给出了随CCN-的增加,Au+、Ag+、Cu+、Zn2+、Cd2+、Ni2+和CN-的沉淀率、相应的络合物形成率以及溶液中游离CN-浓度的变化曲线。
由图3-(a)可知,随着CCN-的增加,Au+逐渐转变成AuCN型氰化物沉淀,当CCN-为1.19× 10-5mol/L时,AuCN型氰化物沉淀率达到99.9%以上,继续增加CCN-,AuCN型沉淀开始转变为Au(CN)2-型络合物,当CCN-为2.69×10-3mol/L以上时,AuCN沉淀率急剧降低、而Au(CN)2-型络合物形成率显著增加,CCN-为(3.31×10-3mol/L,Au+全部以型络合物存在溶液中。

图2 计算程序Figure 2.Schematic diagram of the computation program.

表1 溶液组成及浓度Table 1 The composition and concentration of the solution mol/L
Ag+也随CCN-的增加转变为AgCN型氰化物沉淀,CCN-为2.99×10-3mol/L时,AgCN型沉淀率达到99.7%,CCN-继续增加,AgCN沉淀率急剧降低而Ag型络合物形成率增加,当CCN-大于3.58× 10-3mol/L时,Ag(CN)2-型络合物形成率达到99.9%以上,CCN-为(1.16×10-2mol/L时型络合物形成率又开始逐步降低而型络合物开始形成,CCN-为7.42×10-2mol/L以上时,开始形成型络合物(图3-(b))。
Cu+的分布见图3-(C)。由图可知,Cu+随CCN-的增加转变成CuCN[1,2,12-14]型氰化物沉淀,CCN-为2.80×10-3mol/L时,CuCN型沉淀率达到99.9%以上,继续增加CCN-,CuCN型沉淀率降低而型络合物形成,当CCN-为6.60×10-3mol/L时,Cu型络合物形成率达到99.4%,继续增加CCN-,型络合物形成率急剧降低、而型络合物形成,CCN-为1.26×10-2mol/L时型络合物形成率达到93.3%,继续增加大CCN-,Cu型络合物形成率降低而型络合物开始形成,CCN-为1.00×10-1mol/L时,Cu(CN)32-型络合物和型络合物的形成率分别达到19.7%和80.3%。


图3 CCN-对金属阳离子和CN-分布(G、F)及游离CN-浓度的影响Figure 3.Effect of CN-total concentration on distribution of metallic cations and cyanide ions(G、F)and on free CN-concentration.
根据图3-(f),Ni2+随CCN-的增加,转变成Ni(CN)2型氰化物沉淀,CCN-为5.10×10-3mol/L时,Ni(CN)2型沉淀率达到99.1%,CCN-继续增加时,Ni(CN)2型沉淀率降低而型络合物开始形成,CCN-(7.19×10-3mol/L时型络合物形成率达到99.9%以上,CCN-为1.81× 10-2mol/L时,型络合物才开始形成。
由图3-(g)和图3-(h)可知,将氰化物加入组成如表1所示的阳离子溶液中,当溶液中CCN-很低时,氰根阴离子CN-与金银铜镍等金属阳离子反应形成Mi(CN)ni型沉淀物,但CCN-为3.09× 10-3mol/L以上时,Mi(CN)ni型CN-的沉淀率降低而Mi(CN)gij型CN-的络合物形成率增加,CCN-为7.10×10-3mol/L时,Mi(CN)gij型CN-的络合物形成率达到99.9%以上,CCN-继续增加,Mi(CN)gij型CN-的络合物形成率再次降低而溶液中游离CN-浓度增加,CCN-为1.55×10-1mol/L时,Mi(CN)gij型CN-的络合物形成率和游离CN-形成率分别达到9.6%和90.4%,此时溶液中游离CN-浓度约为1.40×10-1mol/L。
测定了5种离子的沉淀率。不同的CCN-下Au+、Ag+、Cu+、Ni2+和CN-的沉淀率变化的理论计算结果和实验结果的比较列于表2。由表2可知,理论计算结果和实验值的差异不大,从而证实了所提出的计算公式的可靠性。

表2 溶液中金银铜镍氰化物的沉淀率的理论计算结果和实验测定结果比较Table 2 The comparison of the precipitation rate by calculation with that by experimental determination for Au+,Ag+,Cu+,Ni 2+and CN-/%
5 结论
基于公式(6)、(8)、(12)、(14)、(16)的计算结果,可以很好地描述上述多组分化学反应体系中同时形成沉淀物和络合物的金属阳离子和阴离子的分布、即沉淀率和络合物形成率,而且可以定量地考察溶液酸度、离子浓度对沉淀率和络合物形成率的影响。
金、银、铜、锌、镉,镍等6种金属阳离子与氰化物反应形成Mi(CN)ni型沉淀物或Mi(CN)gij型氰络合物,它们的存在形态因氰化物、金属阳离子浓度和pH值的变化而不同。
基于上述公式的理论计算得到的沉淀率和实验结果没有显著性差异。
[1]Dai X,Breuer P L.Cyanide and copper cyanide recovery by activated carbon[J].Minerals Engineering,2009,22:469-476.
[2]Saba M,Yousefi A M.Diagnostic pre-treatment procedure for simultaneous cyanide leaching of gold and silver from a refractory gold/silver ore[J].Minerals Engineering,2011,24:1703-1709.
[3]彭建蓉,王吉坤,杨大锦,等.从含铟加压浸出溶液中回收铟试验[J].中国稀土学报,2010,28(4):755-758.
[4]Soo-Nam K,Hi-Jung B,Woong-An J,et al.Use of chloride-hypochlorite leachants to recover gold from tailing[J].Int.J.Mineral Processing,2008,86:131-140.
[5]高利利,赵中伟,赵红敏,等.选择性沉淀法除钼后溶液中铜的行为研究[J].稀有金属,2011,3(3):428-432.
[6]Gyliene O,Aikaite J,Nivinskiene O.Recycling of Ni(II)–citrate complexes using precipitation in alkaline
solutions[J].Journal of Hazardous Materials,2004,B109:105-111.
[7]Alonso-González O,Nava-Alonso F,Uribe-Salas A.Copper removal from cyanide solutions by acidification[J].Minerals Engineering,2009,22:324-329.
[8]苏平,摘译.硫化物沉淀法及其对金属硫化物去除率的探讨[J].中国有色冶金,2009,4:6-10.
[9]龙文清.计算分布分数的新方法[J].大学化学,2001,16(2):53-55.
[10]王爱丽.关于分布分数及其应用的教学[J].天水师专学报:理科版,1990,1:84-90.
[11]张泽志,颜阳.酸碱分布分数及其应用的教学探讨[J].河南教育学院学报:自然科学版,2011,20(2):55-57.
[12]中南矿冶学院分析化学敎硏室.化学分析手冊[M].北京:科学出版社,1987:36-255.
[13]杭州大学化学系分析化学教研室.分析化学手册:第一分册[M].第2版,北京:化学工业出版社,1997:99-172.
[14]俞汶勤.化学分析[M].北京:科学出版社,2008:25-186.
A New Method for Calculating Ions Distribution in a Precipitation-Complex Reaction System
JONG Daerok1,2*,JONG Yenghun1,2,FANShihua1
(1.NortheasternUniversity,Shenyang,Liaoning110819,China;2.Chongjinmine&metallurgyUniversity,Chongjin,DPRofKorea)
A new method was proposed for the calculation of ion distributions of metallic cation and anion in the complicated reaction system,in which precipitate and complex formed simultaneously.The various factors that influence the formation of precipitate and complex were studied.The concentrations of the metallic cations including Au+,Ag+,Cu+,Zn2+,Cd2+,Ni2+and anion CN-were calculated based on the described algorithm,and the precipitation rates of the ions were obtained.The calculation results were in agreement with the experimental values.
ion precipitation rate;complex forming rate;cyanide;distribution
O655.24;O655.25
A
2095-1035(2012)01-0077-06
10.3969/j.issn.2095-1035.2012.01.0019
2011-12-16
2011-12-30
郑大录,男,教授,主要从事有色金属分析化学研究。E-mail:zhengdalu1968@126.com。
