海洋环境二氧化碳水合物生成的实验研究①
2012-01-10陈伟军刘道平
肖 晨,刘 妮,陈伟军,刘道平
(上海理工大学制冷技术研究所,上海 200093)
·工艺与设备·
海洋环境二氧化碳水合物生成的实验研究①
肖 晨,刘 妮,陈伟军,刘道平
(上海理工大学制冷技术研究所,上海 200093)
温室气体CO2的海洋封存是CO2处理的重要设想,对减缓全球气候变化有着深远的意义。CO2水合物在海洋环境中与在纯水溶液中的生成条件有很大的不同。为了研究海洋环境中CO2水合物的生成特性,设计了一套CO2气体水合物实验装置和一套实验流程,利用这套实验装置模拟海洋深度500 m处海水环境,在海水—CO2体系中合成CO2水合物,探讨了温度、压力和盐度等对海洋环境中CO2水合物生成特性的影响。
CO2;水合物;海洋环境;盐度
研究表明,近50年来的气候变暖主要是人类使用化石燃料而排放大量的CO2等温室气体的增温效应造成的。为了减缓全球气候变化,1977年,MARCHETTI提出了CO2海洋封存设想,即将主要的化石能源消耗工厂 (主要是大型火电厂)排放的CO2收集起来,以不同形式 (气体、液体、固体或水合物)倾废到深海,让其在高压低温条件下自动形成稳定的固体冰状水合物,实现长期隔离地球化学循环,减少大气CO2的积累,减低其在大气中浓度常年增长的趋势[1]。对海洋环境下CO2水合物基础物性研究,尤其是海洋环境CO2水合物实验室模拟研究非常必要。当今发达国家例如日本、美国、挪威、加拿大等已相继开展海洋环境CO2水合物的研究工作,并已举办过多次国际研讨会[2-3]。
国外对海洋环境CO2水合物的研究主要集中在以下几个方面:CO2水合物作为影响CO2在深海中溶解扩散的过渡媒介[4];CO2在深海沉积层中的永久储藏[5];深海 CO2水合物的形成与分解[6-7];二氧化碳深海倾废的环境效应等[8-9]。目前国内对CO2水合物的研究包括:CO2水合物的生成与分解动力学[10-11]、CO2水合物生成特性及强化方法[12-16]、水合物法分离CO2技术[17]、CO2置换天然气水合物[18]等方面,而对海洋环境CO2水合物的研究鲜见报道。
海洋表层环境是多变的,受到气象条件、海流、地形等的影响,而深海中海水的性质变化很小。海水温度随深度增加而递减,深度3000 m以下水温几乎不变。海水中含有丰富的盐类物质,主要是氯化钠和氯化镁,盐度变化范围1%~4.1%,世界大洋的平均盐度约为3.5%。目前海洋水合物实地研究难度很大,成本较高,因此我们想通过实验室模拟手段模拟海水环境生成CO2水合物。实验参照500 m左右深处的海水环境,选取实验压力为5 MPa,实验温度变化范围为4~10℃,初始盐度为平均盐度3.5%。
本文设计了一套实验装置和相应的实验流程,通过实验模拟并研究了各种海洋环境,包括温度、压力、盐度等对CO2水合物生成特性的影响,测定了盐度3.5%海水中CO2水合物的相平衡条件。
1 实验装置和仪器
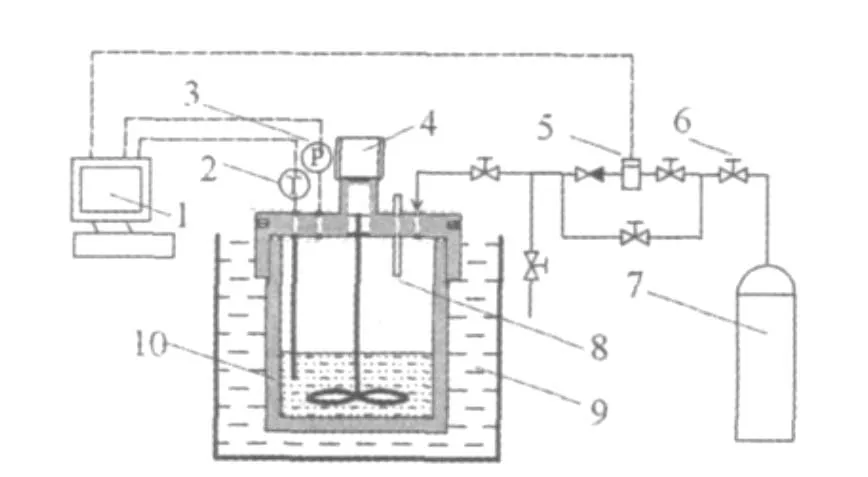
图1 实验装置示意图Fig.1 Experimental apparatus
本实验装置主要由供气系统、高压反应釜、恒温水浴系统、数据采集系统及气体管路等构成(如图1)。高压反应釜由不锈钢加工而成,容积680 mL,最大工作压力20 MPa;反应釜采用了磁力耦合式驱动装置,釜内搅拌器的转速由直流调速电机控制,转速在0~1000 r/min内可调;反应釜内的温度由铂电阻温度传感器测量,精度为A级;压力由扩散硅式压力传感器测量,量程为0~10 MPa,精度为0.3%;恒温水浴系统包括2台低温精密恒温槽,控制反应釜温度,控温范围为-20~100℃,精度为±0.05℃;所用采集仪为Aglient 34970A型数据采集仪。本实验选用美国优特公司生产的SALT6型盐度计,量程:0.1% ~5%,分辨率:0.01%,精度: ±1%,温度量程: -10.0~110.0℃。
实验过程中涉及的主要材料:纯度99.9%的CO2气体、一次性蒸馏水、海水盐、NaCl含量≥99.5%的氯化钠分析纯AR。
2 实验过程
实验均是在恒容条件下进行的,实验用水为以蒸馏水和海水盐配制的3.5%盐度的人工海水,用水量为200 mL,全过程搅拌。实验操作流程为: (1)用蒸馏水清洗反应釜2~3次并擦拭干净,加入200 mL蒸馏水或配制好的盐溶液,拧紧釜盖; (2)将温度传感器、压力传感器和搅拌装置正确安装在反应釜上并连接到数据采集仪; (3)将反应釜置入设定温度为20℃的恒温水浴中,用真空泵将反应釜及管路抽真空,然后充入CO2气体至0.5 MPa,放气置换,重复两次,对反应釜进行吹扫并检查气密性; (4)打开供气系统阀门,缓慢地向反应釜内充入气体,同时开启磁力搅拌装置(200 r/min),直至反应釜温度稳定在20℃且釜内压力恒定在设定压力,关闭供气阀门; (5)将反应釜迅速放入另一已达到反应设定温度的恒温水浴中,开始水合物的生成反应并记录数据; (6)反应结束后保存数据,放掉反应釜内剩余气体,打开反应釜进行相应处理。
3 结果和讨论
3.1 温度对CO2水合物生成的影响
图2所示为实验用水为初始盐度3.5%的人工海水,初始压力5 MPa,反应温度分别为5、6、7和8℃下二氧化碳水合物生成过程中的压力及温度随时间变化曲线。
图2中,F、E、C三组实验分别在22、34、147 min时刻出现温度突升、压力突升的现象,表明水合物的快速生成,而实验R在反应过程中却无此现象,且随着设定温度的升高,反应结束时系统的终了压力依次升高,出现温度突升现象的时间(诱导时间)越迟。图2(a)中,F、E、C三组实验均出现压力突升现象,这是因为初始压力为5 MPa,降温时部分CO2气体发生液化,当CO2分子开始快速生成水合物时,同时放出大量反应热,温度突升,导致液态CO2吸热汽化,压力也突升。实验E在第130 min时刻出现明显的第二次温度上升现象,是由于液化的CO2已全部汽化和溶解于水中,之前的气态CO2、液态CO2、水和水合物四相热平衡状态被打破,水合物反应热释放速率大于恒温槽吸热速率,温度缓慢上升,气态CO2的消耗没有了补充,压力持续下降。实验C的此转变过程不明显是因为温度过高,液化CO2的量较少,实验F的转变过程在22~28 min内,由于水合物生成速度很快,所以转变过程时间很短。图2表明,系统反应温度越低,水合物成核和晶体增长的驱动力就越大,水合物成核的诱导时间就越短,晶核的增长速度也就越快,水合物开始生成需求的压力越低,水合物生成速率越大,反应过程中消耗的CO2气体越多,水合物的终了压力越低。

图2 温度对CO2水合物生成的影响Fig.2 Effect of temperature on hydrate formation
实验R未出现压力曲线突变现象,这是由于在8℃条件下,实验终了压力4.24 MPa低于此海水环境下的CO2水合物的理论相平衡压力,水合物生成的驱动力不够,使得反应不能进行。
3.2 压力对CO2水合物生成的影响
图3所示为实验用水为初始盐度3.5%的人工海水,反应温度7℃,初始压力分别为4、4.5、5、5.25和5.5 MPa下水合物生成过程中的压力及温度随时间变化曲线。

图3 压力对CO2水合物生成的影响Fig.3 Effect of pressure on hydrate formation
图3中,实验O、S、C和N的诱导时间分别为38、51、147和520 min。其中实验O、S和C有部分CO2气体发生液化,开始生成水合物时刻的压力相同,均为4.17 MPa(7℃下CO2的临界压力),温度、盐度也相同,而诱导时间却相差很多,原因在于初始压力越高,液化的CO2量越多,而液态CO2的溶解度和扩散系数比气态 CO2的大[19],有利于水合物晶核的形成,导致诱导时间变短;与O、S和C这三组实验中曲线突变时温度突升、压力也突升的现象所不同的是,实验N开始生成水合物时的压力为3.98 MPa,低于7℃下CO2的临界压力,CO2未液化,温度突升,压力却是突降的。由图3(b)可以看出,实验O、S和C温度突升的幅度Δt分别为0.86、0.8、0.5℃,由于水合物的生成是一个放热反应,且曲线突变前温度相同,因此可以从Δt的大小直观地看出水合物生成的量是依次递减的。实验D在整个过程中始终没有出现温度压力曲线突变,此现象说明反应温度为7℃,初始压力4 MPa的条件下没有水合物生成。
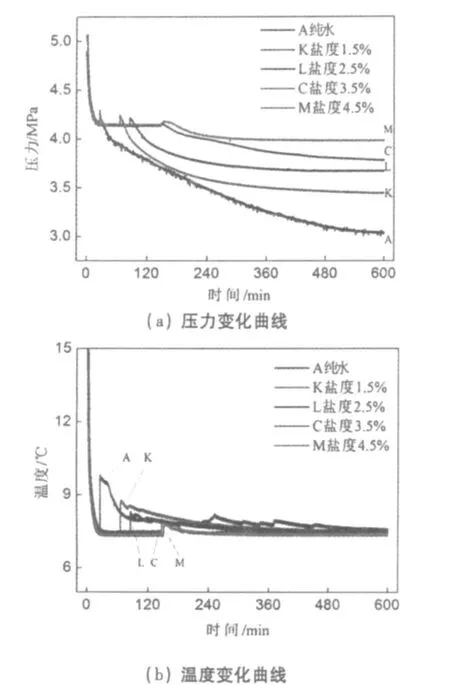
图4 盐度对CO2水合物生成的影响Fig.4 Effect of salinity on hydrate formation
实验证明,一定温度下初始压力越大,CO2的溶解度越高,过饱和度越大,水合物生成的驱动力就越大,形成的水合物量也越多。在有液态CO2存在的水合物反应中,由于液态CO2的溶解度和扩散系数比气态CO2的大,更有利于CO2水合物晶核的形成,缩短了诱导时间。此外,CO2水合物在相同温度下的理论相平衡压力是相同的,实验反应终了压力应当相同,而实验O、S、C和N的反应结束终了压力却是依次降低的,这是因为水合物生成的量越多,消耗的水的量越多,剩余水的盐度越高,导致CO2水合物的相平衡压力越高 (参考本文3.3节),所以会有反应终了压力依次降低的现象。
3.3 盐度对CO2水合物生成的影响
盐度是海水中含盐量的标度。海水盐度的定义为:“1千克海水中的溴和碘全部被当量的氯置换,而且所有的碳酸盐都转换成氧化物之后,其所含的无机盐的克数。图4所示为实验初始压力5 MPa,反应温度7℃,实验用水分别为纯水、初始盐度1.5%、2.5%、3.5%和4.5%的人工海水条件下二氧化碳水合物生成过程中的压力及温度随时间变化曲线。由图4可以看出,A、K、L、C和M五组实验分别在25、66、85、146和150 min时刻出现压力突升、温度突升的现象,水合物成核的诱导时间越来越长,且图4(b)显示温度升高的幅度Δt随着初始盐度的增加而减小,说明反应的剧烈程度依次减小,水合物生成速率依次减慢,水合物生成的量依次减小。这是基于海水中含有的 NaCl、MgCl2等盐类物质属于离子型化合物,而在离子型化合物溶解生成水合离子的过程中,由于离子电荷强电场作用对水分子产生一种相互作用力,破坏了水的簇团结构,这使得水分子形成晶格需要克服该作用力。因此,此时需要一定的额外能量才能满足水合物生成的相平衡条件。
为了具体说明盐度对CO2水合物生成的影响,随后进行了一组CO2水合物相平衡实验,运用图形法[20]测定了CO2水合物在3.5%盐度海水的相平衡。

表1 实验测得CO2水合物相平衡数据Table 1 Experimental data of CO2 hydrate phase equilibrium

图5 CO2水合物的相平衡图Fig.5 Phase equilibrium diagram of CO2 hydrate
表1为实验测得的盐度3.5%海水中CO2水合物的相平衡数据,图5为盐度3.5%海水的实验数据与Sloan[21]的纯水和盐度3.5%NaCl溶液数据的对比图。结果发现本文测定的盐度3.5%海水中CO2水合物的相平衡数据与 Sloan的盐度3.5% NaCl溶液中的数据十分接近,说明海水中含有的除Na+之外的少量Mg2+,K+,Ca2+等离子对CO2水合物的额外影响很小;与纯水相比,盐度3.5%的海水提高了CO2水合物的相平衡压力,抑制了CO2水合物的生成。
实验表明,盐类物质对CO2水合物的生成有抑制作用,并且当体系中的盐度越高时,诱导时间越长,CO2水合物的相平衡压力越高,抑制作用就越强;海水中除Na+之外的K+,Ca2+,Mg2+等离子含量很少,对CO2水合物的生成造成的额外影响极小,可与Na+合并计入盐度一起考虑。
4 结 论
本文根据CO2海洋封存的设想,设计了一套实验装置和相应的实验流程,通过实验室实验模拟深海环境,包括温度、压力、盐度等环境条件,研究了密闭系统海洋环境中CO2水合物的生成反应特性。结果发现温度越低、压力越高,水合物生成的诱导时间越短,反应速率越快,生成水合物的量越多;在有液态CO2存在的水合物反应中,由于液态CO2的溶解度和扩散系数比气态CO2的大,更有利于CO2水合物晶核的形成,缩短了诱导时间;盐度对CO2水合物的生成有抑制作用,并且当体系中的盐度越高,诱导时间就越长,CO2水合物的相平衡压力越高,抑制作用就越强。
[1]MARCHETTIC.On geoengineering the CO2problem[J].Climatic Change,1977(1):59-68.
[2]MITSUKAWA H.International symposium on ocean disposal of carbon dioxide[J].Waste Management,1997 (17):275.
[3]TSUNOGAIS,WONG C S.Second international symposium on carbon dioxide in the oceans,Tsukuba,Japan (January 1999)[J].Mar Chem,2000(72):79-81.
[4]GOLOMB D S,ZEMBA SG.The fate of CO2sequestered in the deep ocean[J].Energy Conversion and Management,1992,33(5-8):675-683.
[5]KOMAI T.Formation and dissociation kinetics of gas hydrates inmarine sediments[R].Proc of ICGH5,Trondheim,Norway,2006.
[6]BREWER P G,FRIEDERICH G,PELTZER E T,et al.Direct experiments on the ocean disposal of fossil fuel CO2[J].Science,1999(284):943-945.
[7]GABITTO J,TSOURISC.Dissolution mechanisms of CO2hydrate droplets in deep seawaters[J].Energy Conversion and Management,2006,47(5):494-508.
[8]HUESEMANN M H,SKILLMAN A,GRECELIUS E A.The inhibition ofmarine nitrification by ocean disposal CO2[J].Marine Pollution Bulletin,2002,44(2):142-148.
[9]TAMBURRIM N,PELTZER E T,FRIEDERICH G et al.A field study of effects of CO2ocean disposal on mobile deep-sea animals[J].Marine Chemistry,2000,72(2-4):95-101.
[10]孙长宇,马昌锋,等.二氧化碳水合物分解动力学研究[J].石油大学学报,2001,25(3):8-10.
[11]马昌锋,陈光进,郭天民.水中悬浮气泡法研究水合物生长动力学 [J].中国科学,2002,32(1):90-96.
[12]刘妮,王亮.二氧化碳水合物储气特性的实验研究[J].环境工程学报,2010,4(3):621-624.
[13]刘妮,李菊,等.机械强化制备二氧化碳水合物的特性研究[J].中国电机工程学报,2011,31(2):51-54.
[14]刘妮,轩小波.温度扰动促进CO2水合物生成特性的实验研究[J].中国电机工程学报,2010,30(17): 41-44.
[15]刘妮,张国昌,等.添加剂对CO2水合物生成的影响[J].天然气化工,2008,28(12):104-107.
[16]轩小波,刘妮,等.影响二氧化碳水合物生成特性的实验研究[J].天然气化工,2011,36(2):10-13.
[17]余康.水合物法分离烟气中二氧化碳的实验研究[J].化学工程与装备,2010(11):3-5.
[18]李遵照,郭绪强,等.CO2置换CH4水合物CH4的实验和动力学[J].化工学报,2007,58(5):1197-1203.
[19]TENG H,MASUTANISM,etal.Solubility of CO2in the ocean and its effect on CO2dissolution[J].Energy Conversion and Management,1996,37(6-8):1029-1038.
[20]孙志高,石磊,等.气体水合物相平衡测定方法研究[J].石油与天然气化工,2001,30(4):164-166.
[21]SLOAN E D.Clathrate Hydrates of Natural Gases[M].New York:Marcel Dekker,Inc,1997.
Experiments on The Formation of CO2Hydrate Under Simulating Marine Environment
XIAO Chen,LIU Ni,CHENWeijun,LIU Daoping
(Institute of Refrigeration Technology,University of Shanghai for Science and Technology,Shanghai200093,China)
It is significant for ocean storage of CO2to reduce or eliminate CO2emission from large power plants and major industrial processes.There aremany differences of CO2hydrate formation under the condition of pure water or ocean environment.To study the promoting and inhibiting factors on CO2hydrates formation in seawater,an experimental instrument is designed to simulate the CO2hydrate formation under themarine environmentof the depth of500m.With the experimental data,factors affecting the experimental results,including temperature,pressure and salinity,are in turn discussed.
carbon dioxide;hydrate;marine environment;salinity
P744.4
B
1007-7804(2012)01-0013-05
10.3969/j.issn.1007-7804.2012.01.001
2011-12-06
国家自然科学基金资助项目(50706028);上海市教育委员会科研创新项目资助(12YZ106);上海市重点学科建设项目(S30503)
肖 晨 (1986),男,硕士,制冷及低温工程,研究方向:气体水合物蓄冷、储能技术。
