IGF-1R、EGFR、VEGF、HER2在胃癌组织中的表达及与其预后的关系
2012-01-09胡伟民
王 进 曾 祥 胡伟民
胃癌是常见的恶性肿瘤,其发病率占所有肿瘤的第4位,而死亡率却占第2位[1]。根据中国国家癌症预防控制办公室的估计,2005年我国胃癌新发病例数约为376 000例,死亡约为295 000例[2]。50%~80%的患者首次就诊时,已经属于Ⅲ、Ⅳ期患者,失去了最佳的手术时机。胃癌5年生存率较低,影响胃癌预后的临床病理因素很多,如患者年龄、性别、肿瘤发生部位、手术方式、肿瘤病理类型、浸润深度、淋巴结转移、远处转移、分期、肿瘤大小、术后化疗等。目前公认TNM分期是影响胃癌预后重要的因素,但是具有相同TNM分期的胃癌,其预后也不尽相同,除TNM分期外,可能还有其它因素影响胃癌的预后。本研究通过回顾性分析,摘录医院病例及相关检查记录、随访记录,选取胃癌患者的石蜡切片,经免疫组化处理,统计IGF-1R、EGFR、HER2、VEGF阳性表达率,采用SPSS统计软件探讨影响胃癌的预后因素,旨在为制定胃癌的个体化治疗方案提供可靠依据。
1 材料与方法
1.1 一般资料
收集我院2003年1月至2005年12月手术切除的胃癌组织蜡块,共108例。其中男性77例,女性31例,男:女比例为2.5∶1,年龄18~88岁,平均年龄(57±10.8)岁。其中胃窦癌61例(56%),胃体癌12例(12%),胃底贲门癌35例(32%)。大体分型:BorrmannⅠ型10例(9%),Ⅱ型35例(33%),Ⅲ型43例(40%),Ⅳ型20例(18%)。108例患者低分化腺癌71例(65%),中分化腺癌23例(22%),高分化腺癌14例(13%)。术后病理分期:Ⅰ期4例(4%),Ⅱ期59例(55%),Ⅲ期36例(33%),Ⅳ期9例(8%)。
1.2 治疗方法
本组108例胃癌患者行胃癌根治术99例,姑息性手术9例,术后均辅助化疗,方案为FOLFOX4(奥沙利铂 85 mg/m2,静滴,d1;5-Fu 3000 mg/m2·d,泵滴,48 h;CF 200 mg/m2,静滴,d1、2)。化疗疗程均在6个周期以上(平均7.8个周期)。
1.3 主要材料和试剂
IGF1Rα亚单位试剂盒 ab78405,Ab-1购于德国lab Vison 公司;EGFR pharmDX kit GT209302 购于丹麦 DAKO公司,a HercepTest kit GA048502 购于丹麦 DAKO公司;VEGF M727329 购于丹麦 DAKO公司;DAB Liquid System K346 购于丹麦 DAKO公司;羊抗鼠IgGCodeK 4 000 购于丹麦 DAKO公司。
1.4 实验方法
常规石蜡标本切片,厚4 μm。严格按照说明书进行免疫组化操作,IGF-1R、EGFR、VEGF与HER2均以细胞膜和(或)细胞质出现均匀一致的棕黄色颗粒为阳性细胞。
1.5 随访
随访方式以查阅病例、电话、信件随访相结合方式进行。随访截止日期为2010年12月31日。3个月随访1次,连续随访2次未能联系到则记为失访。
1.6 统计学方法
IGF-1R、EGFR、VEGF、HER2的相关性采用Spearman等级相关分析研究;临床病理因素及IGF-1R、EGFR、VEGF、HER2采用Kaplan-Meier法描绘其生存率曲线图,生存曲线采用Log-rank检验评价其统计学意义。应用Cox危险率比例模型,评价IGF-1R、EGFR、VEGF、HER2蛋白表达情况及其对胃癌患者预后的意义。
2 结果
2.1 IGF-1R、EGFR、VEGF、 HER2在胃癌组织中的表达
108例胃癌组织中IGF-1R阳性67例(62%),EGFR阳性55例(51%),VEGF阳性46例(44%),HER2阳性22例(20%),联合表达情况见表1。
2.2 IGF-1R、EGFR、HER2与VEGF表达的相关性
在胃癌组织中IGF-1R表达与EGFR、VEGF、HER2表达均呈正相关性,R>0,P<0.05。相关性由强到弱顺序为:IGF-1R与HER2;IGF-1R与EGFR;IGF-1R与VEGF,其中以IGF-1R与HER2相关性最强,见表1。

表1 IGF-1R、EGFR、VEGF、HER2联和表达及相关性(例,%)
2.3 IGF-1R对胃癌患者生存期影响
108例胃癌组织中IGF-1R表达阳性66例(61.11%),阴性42例(38.89%),其中位生存时间分别为19.1和24.7个月,两者比较有显著性差异,P=0.02,见图1。

图1 IGF-1R表达对胃癌患者生存期的影响
2.4 EGFR对胃癌患者生存期影响
108例胃癌组织中EGFR表达阳性55例(50.93%),阴性53例(49.07%),其中位生存时间分别为20.1和25.4个月,两者比较无显著性差异,P=0.103,见图2。
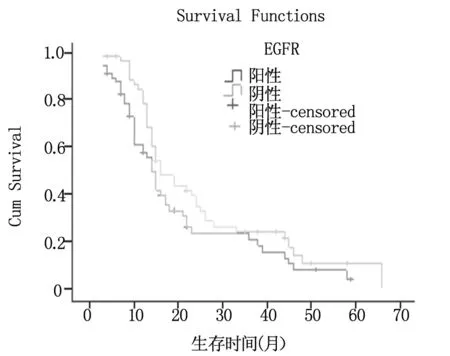
图2 EGFR表达对胃癌患者生存期的影响
2.5 VEGF对胃癌患者生存期影响
108例胃癌组织中VEGF表达阳性48例(44.44%),阴性60例(55.56%),其中位生存时间分别为19.5和24.5个月,两者比较无显著性差异,P=0.252,见图3。

图3 VEGF表达对胃癌患者生存期的影响
2.6 HER2对胃癌患者生存期影响
108例胃癌组织中HER2表达阳性22例(20.37%),阴性86例(79.63%),其中位生存时间分别为14.2和25.5个月,两者比较有显著性差异,P=0.024,见图4。
2.7 影响胃癌的COX分析
应用COX比例风险模型进行多因素分析,结果显示,PTNM病理分期[EXP(B)=2.185,P<0.001]、IGF-1R [EXP(B)=1.755,P=0.0255]和Borrmann分型[EXP(B)=1.174,P=0.0261]为胃癌预后的独立预测因素,见表2。

图4 HER2表达对胃癌患者生存期的影响
3 讨论
EGFR是1种受体酪氨酸激酶,能够介导多条信号转导通路,EGFR是原癌基因cerbB-1的产物,HER2(c-erbB-2)与EGFR具有约50%的同源性,通过参与激活Ras/Raf/Mek/ERK/MAPK、P13K/PDKl/Akt ( PKB )、PLC7、JAK/STAT 等细胞信号通路[3],从而介导细胞分化、生存、迁移、侵袭、黏附、损伤修复等重要功能。研究[4,5]发现,EGFR过表达参与肿瘤发生、增殖和转移。
VEGF是1种多肽类细胞因子,也是1种高度特异性的有丝分裂原,能为血管内皮细胞的增殖、迁移及新生血管的形成提供基质支架,因而VEGF成为肿瘤发生发展过程中调节和促进血管生成的最重要的细胞因子,也是在胃癌等实体瘤生长和转移中发挥重要作用的因子。
胰岛素受体与胰岛素样生长因子(IGF)受体有交叉,高胰岛素还可以通过IGF的受体,通过AKT及MTOR等途径[6],引发促有丝分裂和抗凋亡作用,促进肿瘤发生。由于正常上皮细胞和癌细胞均可表达IGF-1受体,IGF-1可同时作用于癌变前期和癌变阶段,IGF-1信号转导的过度增加是癌变细胞存活的关键性因素。此外,IGF-1R还可以刺激肿瘤细胞表达VEGF,从而诱发血管形成[7]。
IGF-1R是具有酪氨酸激酶活性的跨膜糖蛋白,能够与IGF-1R结合的配体有2种,即IGF-1和IGF-2,它们与受体结合后可激活受体,并引起一系列的生物学效应,包括促进细胞增殖、浸润和转移的效应。在一些细胞中,IGF-1R可引起信号转导并使转录活化蛋白(STAT)激活因子磷酸化,抑制细胞的增殖和凋亡。

表2 影响胃癌预后的多因素分析
此外,IGF-1R的信号转导还可引起细胞的恶性化以及细胞黏附性的改变[5]。因此,IGF-IR被认为是治疗肿瘤的有效靶点。IGF-1R表达持续增高是乳腺癌、胰腺癌、结肠癌、肺癌发生的危险因子[6]。Carboni等[7]将具有IGF-IR活性的融合受体转染小鼠,融合受体以二聚体形式在转基因鼠体内具有持续活性,小鼠在8周龄发展成乳腺癌。然而有关IGF-1R在胃癌中表达情况及4种因子与胃癌术后预后的多因素风险分析,鲜有报道。
日本国家癌症研究中心的Matsubara等[8]报道IGF-1R与EGFR联合表达率为55%,IGF-1R与HER2联合表达为18%,EGFR与HER2联合表达率为15%,本研究中IGF-1R与HER2联合表达结果与之相近,但其他两项均低于此篇报道,考虑可能的原因为入组条件不一样,免疫结果判定标准不一样,Junichi Matsubara的研究是选用半定量法评分系统,本研究采用双评分半定量法,即以阳性细胞百分比计分和染色强度计分之和所得总分进行结果判定,结果更加客观、准确。对于VEGF联合表达率此篇文献未提及,但是大量文献报道VEGF在胃癌中表达率较高,且分子生物学方面提示VEGF与IGF-1R、EGFR、HER2在肿瘤发生、发展过程中具有相互协同[9]。本研究Spearman相关分析显示,在胃癌组织中的IGF-1R与EGFR、VEGF、HER2呈正相关性,进一步说明4种因子在胃癌组织中存在某种联系,这提示对于抗EGFR、VEGF、HER2分子靶向药物产生耐药的胃癌晚期患者,抗IGF-1R靶向药物可能具有一定的疗效。
本研究单因素分析结果显示,IGF-1R、HER2、IGF-1R与EGFR,IGF-1R与VEGF,IGF-1R与HER2,IGF-1R与EGFR、VEGF、HER2三者及四者均呈阳性表达的胃癌患者预后较差,多因素分析结果显示仅IGF-1R为独立的胃癌预后因素。虽然IGF-1R、EGFR、VEGF、HER2联合表达不能成为胃癌独立的预后因素,但是所有联合阳性表达的患者生存期均较阴性表达者短,而且随选择的联合研究因素增加,预后越差,尤其是IGF-1R、EGFR、VEGF、HER2均为阳性的3例患者,生存时间仅为5个月,是本研究中最短的生存时间,说明联合表达可能为预后的判断指标,但需进一步研究。
[1]Parki DM,Bray FI,Devesa SS.Cancer burden in the year 2000.The global Picture〔J〕.Eur J Caneer,2001,37:54.
[2]Crew KD,Neugut Al.Epidemiology of gastric cancer〔J〕.World J Gastroenterol,2006,12:354.
[3]Ciardiello F,Tortora G.EGFR antagonists in cancer treatment〔J〕.N Engl J Med,2008,358(11):1160.
[4]付建华,赵 曼,胡国强,等.EGFR和E cadherin与肿瘤的发生发展及其调控机制的研究进展〔J〕.实用癌症杂志,2008,23(1):107.
[5]Molinari F,Martin V,Saletti P,et al.Differing deregulation of EGFR and downstream proteins in primary colorectal cancer and related metastatic sites may be clinically relevant〔J〕.Br J Cancer,2009,100(7):1087.
[6]Pollak MN,Schernhammer ES,Hankinson SE.Insulin-like g-rowth factors and neplasia〔J〕.NAT Rev Cancer,2004,4:505.
[7]Carboni JM,Lee AV,Hadsell DL,et al.Tumor development by transgenic espression of constitutively active insulin-like growth factor 1 receptor〔J〕.Cancer Res,2005,65(9):3781.
[8]Matsubara J,Yamada Y,Hirashima Y,et al.Hnpact of insulin-Like growth factor type-1 receptor,epidermal growth factor recaptor,and HER2 expressions on outcomes of patients with gastric cancer〔J〕 Clin Cancer Res,2008,14(10):3022.
[9]James R,Tonra.Prioritiation of EGFR/IGF-1R/VEGFR2 c-ombination targed therapies utilizing cancer models〔J〕.Anticancer Research,2009,29:1999.
