提高双歧杆菌活力的优化增菌发酵技术研究
2012-01-08何枫媛葛武鹏卫伟朱红刘锐
何枫媛,葛武鹏,卫伟,朱红,刘锐
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
提高双歧杆菌活力的优化增菌发酵技术研究
何枫媛,葛武鹏,卫伟,朱红,刘锐
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
以MRS为基础培养基,选取添加4种不同的增菌因子,即:魔芋胶水解物、薏苡仁浸提液、山药浸提液、菊粉,以单因素实验筛选出较优的3种增菌因子,通过正交实验以活菌数为活力评价指标,确定最佳增菌配方。结果表明,单因素实验中,魔芋胶水解物增菌效果最佳,当其在MRS培养基中添加体积分数为35 mL/L时,双歧杆菌的活菌数可达1.21×109mL-1;正交实验所得最佳增菌配方为:MRS+魔芋胶水解物(30 mL/L)+薏苡仁浸提液(25 mL/L)+菊粉(20 g/L),37℃厌氧培养36 h,活菌数可达7.4×109mL-1。
双歧杆菌;增菌因子;活菌数;正交实验
0 引言
双歧杆菌是定植于人体肠道内并促进人体健康的一种益生菌[1]。其多种生物学功能已经被发现并应用[2-3]。双歧杆菌专性厌氧,对生长条件要求苛刻,活性保持较难,其生长繁殖和体外培养需要多种双歧因子[4-6]。
低聚糖是一类双歧因子。Gibson等报道了果聚糖对双歧杆菌增殖的影响[7]。秦湘红等人研究认为用魔芋制备葡甘露低聚糖可促双歧杆菌体外生长[8]。李香串研究显示薏苡仁浸提液可促进双歧杆菌的增殖[9]。张火云等研究显示山药粗多糖(DOT-X)对双歧杆菌的增殖起主要作用[10]。殷洪等研究表明菊粉可使有益菌群在肠道中占有优势[11]。用多种增菌因子复合增殖双歧杆菌的研究还鲜见报道。
本文主要研究魔芋胶水解物、薏苡仁浸提液、山药浸提液、菊粉这4种物质对双歧杆菌体外增殖的影响,以期为该菌的体外培养提供新的参考依据。
1 材料与方法
1.1 材料与试剂
双歧杆菌B94;魔芋,薏苡仁,山药,菊粉。
MRS培养基:酵母粉5 g,葡萄糖20 g,柠檬酸氢二铵2 g,蛋白胨10 g,牛肉膏10 g,无水乙酸钠5 g,吐温80 1 mL,七水和硫酸镁0.58 g,四水和硫酸锰0.25 g,磷酸氢二钾2 g,蒸馏水1 000 mL,调节pH值至7.1,121℃高压灭菌20 min。
1.2 仪器与设备
Galaxy系列二氧化碳培养箱;PB-10pH计;SWCJ-2D型净化工作台;BZG30菌落计数器;TOMY ES315自动蒸汽消毒柜;XSP-2CA双目生物显微镜;FA2004电子分析天平。
1.3 方法
1.3.1 魔芋胶水解物的制备
将质量分数为0.4%的魔芋精粉于37℃溶胀过夜后倒入高速组织捣碎机中搅拌10 min,放入37℃培养箱,保温72 h,取出离心(4 000 r/min,15 min),取上清液于100℃加热20 min,将所得液浓缩至原体积的50%,既得魔芋胶水解物[12]备用。
1.3.2 薏苡仁浸提液的制备
将薏苡仁用10倍水浸泡30 min,将其煮沸,沸后在保持微沸30 min,将煮得的薏苡仁汁倒出,再加原薏苡仁10倍的水煮沸,方法同上。将两次所得汁液混合过滤,即得薏苡仁浸提液。
1.3.3 山药浸提液的制备
准确称取适量山药,按料水质量比1∶10加入三角瓶中,置于80~90℃水浴锅保温,3 h后用细密纱布过滤除渣,即得山药浸提液,浓缩浸提液至山药粗多糖的质量浓度为100 g/L。
1.3.4 活菌计数
将双歧杆菌B94用基础培养基MRS进行多次活化后,分别接种于添加不同浓度增菌因子的基础培养基中,37℃厌氧培养36 h,以血球计数板法计数,重复3次,取平均值,记录数据并统计分析[13]。
1.3.5 单一增菌因子促进双歧杆菌生长试验
选择魔芋胶水解物、薏苡仁浸提液、山药浸提液、菊粉等四种物质作为增菌因子,按不同比例加入MRS培养基中,其中魔芋胶水解物、薏苡仁浸提液分别按20,25,30,35,40 mL/L的不同体积分数添加;山药浸提液按3,4,5,6,7 mL/L的不同体积分数添加;菊粉按12,16,20,24,28 g/L的不同质量浓度添加。分别在以上含不同体积分数增菌因子的MRS培养基内以4%的比例接入已活化好的双歧杆菌,37℃厌氧培养36 h,按1.3.4法测定活菌数。上述各实验均设3次重复,且各因素均以MRS基础培养基作为对照组。
1.3.6 增菌因子复合配比促进双歧杆菌生长实验
根据单因素实验,在MRS基础培养基上,筛选魔芋胶水解物(A),薏苡仁浸提液(B),菊粉(C)等3个因素作为增菌因子,采用正交表L9(34),以发酵液活菌数为指标,做进一步优化,每试验进行3次重复。筛选促进双歧杆菌菌体生长的最佳复合配比。其正交因素与水平如表1所示。

表1 因素水平
2 结果分析与讨论
2.1 双歧杆菌增殖培养单因素实验
2.1.1 魔芋胶水解物对双歧杆菌体外增殖的影响
图1为魔芋胶水解物体积分数与活菌数目的关系。由图1可以看出,在一定范围内,随着魔芋胶水解物浓度的增加,活菌数目逐渐增加,当添加量为35 mL/L时,活菌数目达到峰值,为1.21×109mL-1,而对照组的活菌数仅有2.21×108mL-1,可见魔芋胶水解物的添加对双歧杆菌的增殖起到明显促进作用。分析表明,当魔芋胶水解物的添加体积分数分别为25 mL/ L以及30 mL/L时,活菌数目增殖显著(P<0.05),当添加量为30 mL/L以及35 mL/L时,活菌数目增殖不显著(P>0.05),故选择体积分数为25,30,35 mL/L作为魔芋胶水解物在正交试验中的水平值。

2.1.2 薏苡仁浸提液对双歧杆菌体外增殖的影响
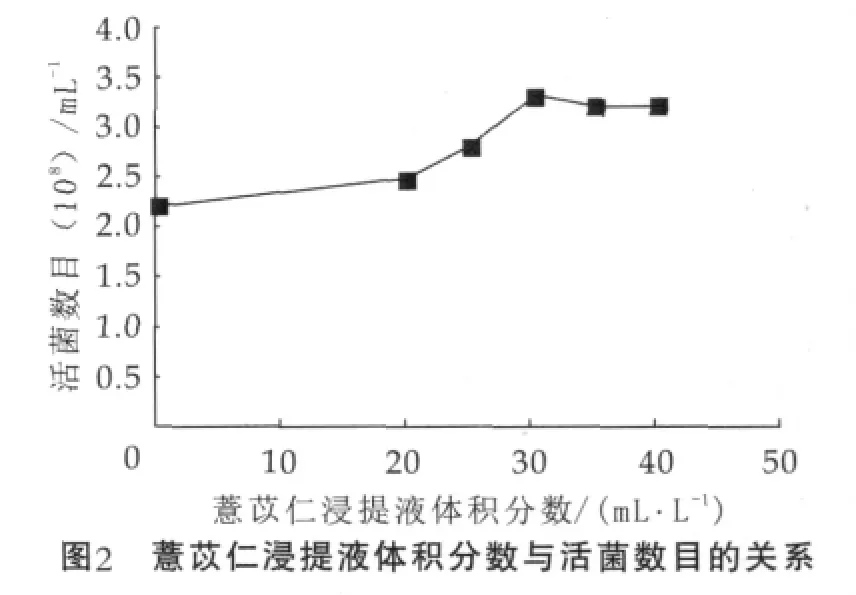
图2为薏苡仁浸提液体积分数与活菌数目的关系。由图2可以看出,在一定范围内,活菌数目随薏苡仁浸提液体积分数的增加而增加,当添加量为30 mL/L时,活菌数目达到峰值,为3.32×108mL-1,而对照组的活菌数仅有2.21×108mL-1。分析表明,当薏苡仁浸提液的添加体积分数分别为25 mL/L以及30 mL/L时,活菌数目增殖显著(P<0.05);当添加量分别为30 mL/L以及35 mL/L时,活菌数目增殖不显著(P>0.05)。故选择体积分数为25,30,35 mL/L作为薏苡仁浸提液在正交实验中的水平值。
2.1.3 山药浸提液对双歧杆菌体外增殖的影响
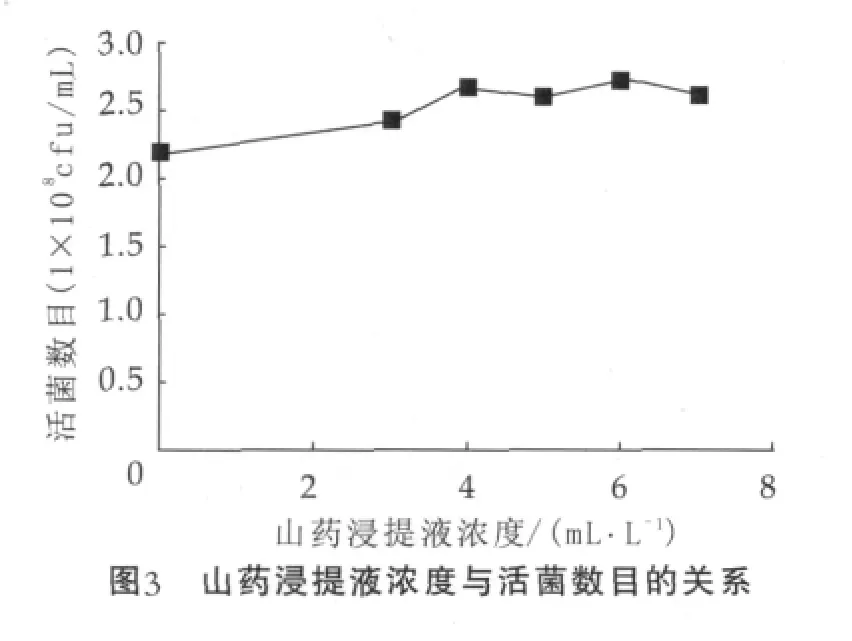
图3为山药浸提液浓度与活菌数目的关系。由图3可以看出,添加山药浸提液对于双歧杆菌的增殖有一定促进作用,但增菌效果不明显。分析发现,各水平组的活菌数目增殖均不显著(P>0.05),活菌数目最高只达到2.72×108mL-1,对照组活菌数为2.21×108mL-1,因此,在正交试验设计中剔除该因素。
2.1.4 菊粉对双歧杆菌体外增殖的影响
图4为菊粉质量浓度与活菌数目的关系。由图4可以看出,在一定范围内,随着菊粉浓度的增加,活菌数目逐渐增加,在菊粉质量浓度达到20 g/L时,活菌数目达到峰值为4.78×108mL-1,而对照组仅为2.21×108mL-1。分析表明,当菊粉的添加量分别为16 g/L以及20 g/L时,活菌数目增殖显著(P<0.05),当添加量为20 g/L以及24 g/L时,活菌数目增殖不显著(P>0.05),故选择质量浓度为16,20,24 g/L作为菊粉在正交试验中的水平值。

综合比较看出,各因子在选取添加范围内,各自最佳添加量对活菌增菌效果的排列顺序为:魔芋胶水解物(35 mL/L)>菊粉(20 g/L)>薏苡仁浸提液(30 mL/L)>山药浸提液(6 mL/L)。
2.2 各增菌因子复合配比正交试验
将各增菌因子按照L9(34)正交设计表进行复合配比实验,进行培养基的优化,以确定3种因子的最佳增菌配比。发酵培养以pH值为7.1为初始pH值,温度37℃,时间36 h,以发酵培养液活菌数为评价指标,试验结果与极差分析如表2所示,相应的方差分析如表3所示。
表2中极差值与表3中F值大小顺序是一致的,极差与方差结果均表明,在复合配比试验所考察的三个增菌因子中魔芋胶水解物(A)对发酵液活菌数的影响最为显著,各增菌因子交互作用时对菌体增殖的影响力排序依次为:魔芋胶水解物(A)>菊粉(C)>薏苡仁浸提液(B)。方差分析说明魔芋胶水解物与菊粉这两种增菌因子的添加对试验结果的影响高度显著,而薏苡仁浸提液的添加对试验结果影响显著。结合表2得出最优增菌因子组合为A2B1C2,即魔芋胶水解物的添加体积分数是30 mL/L,薏苡仁浸提液的添加体积分数是25 mL/L,菊粉的添加质量浓度是20 g/L。
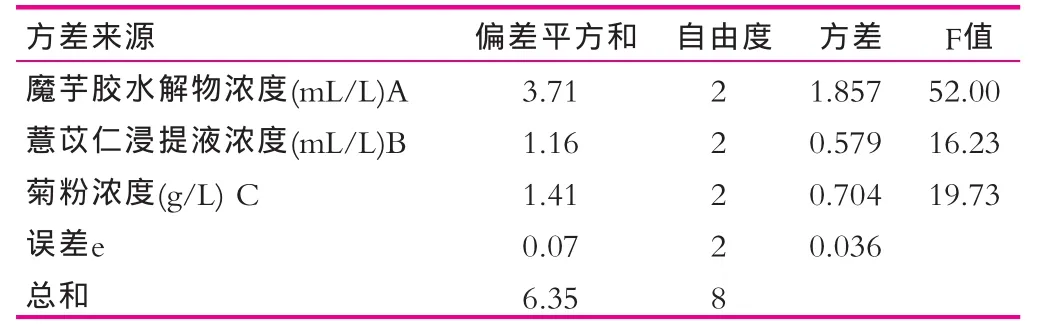
表3 方差分析
2.3 验证实验
根据L9(34)正交实验结果分析选出的最优增殖因子组合,进行验证实验,将其添加到MRS培养基(pH值为7.1)中,37℃厌氧培养36 h,进行3次重复,双歧杆菌增菌培养的试验结果高于表2的实验结果,活菌数平均可达到7.4×109mL-1,比起对照组(2.21×108mL-1)有了很大的提高。可见优化得到的增菌组合利于双歧杆菌增殖。
2.4 讨论
单因素试验结果结果表明:山药浸提液对双歧杆菌增殖的促进作用不明显,故在正交试验中只选取了魔芋胶水解物、薏苡仁浸提液、菊粉这3种作为增菌因子。正交试验结果显示,魔芋胶水解物的添加量在25~30 mL/L范围内时,其促进双歧杆菌增殖的效果随浓度的提高而提高,这一点与单因素试验结果是相一致的。通过参照比较国内外相关研究结果,张火云等人以中药优化双歧杆菌培养基,可使双歧杆菌活菌数达到2.21×108mL-1[14];孟祥晨等人[15]通过培养基的筛选优化,使活菌数达到2.9×109mL-1等,本研究得到的最佳复合配比增菌因子组合使双歧杆菌在37℃,厌氧培养36 h时,其活菌数达到了7.4×109mL-1,增菌效果明显,为相关研究提供了新的参考。
3 结论
(1)在以MRS培养基为基础培养基所选取的4种增菌因子(魔芋胶水解物、薏苡仁浸提液、山药浸提液、菊粉)中,单因素试验结果表明:魔芋胶水解物的对对双歧杆菌体外增殖的促进作用最好,当添加量为35 mL/L时,双歧杆菌的活菌数可达1.21×109mL-1。
(2)正交实验所得最佳复合增菌因子组合为魔芋胶水解物(30 mL/L)、薏苡仁浸提液(25 mL/L)、菊粉(20 g/L),经添加了该增菌因子组合的MRS培养基37℃厌氧培养36h,双歧杆菌活菌数可达7.4×109mL-1。
[1]RASIC J L,KURMANN J A.Bifidobacteria and Their Role:Microbiological Nutritional-Physiological Medical and Technological Aspects and Bibliography[M].Boston:Besel,1983.
[2]张建浩.双歧杆菌的生物学特征、生理功能及食品中的开发应用[J].食品科学,2002,23(10):141-142.
[3]吴淑清,王顺余,谭克,等.双歧杆菌的研究现状[J].长春大学学报, 2007,17(4):57-61.
[4]陈思羽,李祯祯,陈芳.人体肠道益生菌的生理功能和安全性研究现状[J].中国微生态学杂志,2007,19(4):397-398.
[5]郭本恒,汪河,双歧杆菌及其相关乳制品[J].食品工业,1998(1):24-26.
[6]NAKAZAVA Y.Function of Fermented Milks:Challenges for the Health[M].London and New york:Elsecier Apllied Sciences,1992:45-47.
[7]GIBSON R G,WANG X.Regulatory Effects of Bifidobacteria on the Growth of Other Colonic Bacteria[J].J.Appl.Microbiol,1994,77(2): 412-420.
[8]秦湘红,张群芳.魔芋粉酶解产物与低聚果糖对双歧杆菌的促生长作用比较研究[J].中国微生态学杂志,2003,15(5):261-263.
[9]李香串.薏苡仁双歧杆菌酸乳的研制[J].科技情报开发与经济,2004,14(9):189-190.
[10]张火云,吴传兵,孙永林.山药浸提物对青春双歧杆菌发酵的影响[J].襄樊学院学报,2009,30(8):31-34.
[11]殷洪,林学进.菊粉、低聚果糖的研究进展[J].中国食品添加剂,2008 (4):97-101.
[12]吴拥军,孟望霓,蔡金藤,等.魔芋葡萄甘露低聚糖的提取发酵产物对耐氧双歧杆菌的促生长作用[J].研究与探讨,2002,23(9):41-43.
[13]刘树兴,张明.双歧杆菌最佳培养条件的研究[J].食品研究与开发, 2007,28(9):47-49.
[14]张火云.孙启玲.袁月祥.中药及其优化培养基对双歧杆菌增殖的影响[J].四川大学学报,2004(11);189-192.
[15]孟祥晨.王亚峰.霍贵成.青春双歧杆菌增菌培养基的优化[J].研究报告,2009,28(7):15-19.
Research on the optimistic fermentation technology of the activities of Bifidobacterium
HE Feng-yuan,GE Wu-peng,WEI Wei,ZHU Hong,LIU Rui
(College of Food Science and Technology,Northwest A&F University,Yangling 712100,China)
Viable counts ofBifidobacteriumis one of the key criterions to improve human body health.The study adopted MRS as basic medium,and four optimal ingredients were chosen and added:Konjac Gum Hydrolyzates,Extractive Juice of Semen Coins,Extractive Juice of Yam,Inulin.Through single-factor test,3 better optimal ingredients were sifted out.To take the viable counts as index,orthogonal experiment was used to select a formula which is the best to enriching high activitybifidobacterium.The experimental result showed that in singlefactor test,Konjac Gum Hydrolyzate had the best effect to enrichingbifidobacteriumamong the above 4 factors,and the additive concentration was MRS added with Konjac Gum Hydrolyzates(35 mL/L),with the viable counts being 1.21×109CFU/mL.Orthogonal test showed that the optimum medium was MRS added with Konjac Gum Hydrolyzates(30 mL/L),Extractive Juice of Semen Coins(25 mL/L),Inulin(20 g/L),incubated under anaerobic conditions for 36h at 37℃,with the viable counts being 7.4×109CFU/mL.
Bifidobacterium;optimal ingredient;viable counts;orthogonal test
Q93-335
A
1001-2230(2012)05-0016-04
2011-11-04
西北农林科技大学人才基金资助项目(22050205)。
何枫媛(1989-),女,本科,研究方向为乳品科学及生物技术。
葛武鹏
