大黄酸固体分散体的制备及对大鼠血脂的影响
2012-01-07唐丽源王彦雪
韩 刚,唐丽源,索 炜,刘 莉,康 欣,王彦雪,赵 媛
(河北联合大学 药学院,河北 唐山 063000)
近年来随着人们生活方式的改变,高脂血症在我国发病率呈逐年上升的趋势。研究表明高脂血症与冠心病密切相关[1]。而目前多数降血脂药物均有不良反应,因此在中药中寻找具有降血脂和抗氧化的活性物质备受关注[2]。
大黄酸(Rhein)为中药大黄中的主要活性成分,属蒽醌类化合物,具有保肝、降脂、抗纤维化、降血脂、抗氧化、抗肿瘤、抗炎等多种药理作用[3]。而大黄酸难溶于水,体内生物利用度低。固体分散体技术可用于增加难溶性药物的溶解度和溶出速率,提高生物利用度[4]。本文以聚乙烯吡咯烷酮(PVP)为载体制备大黄酸固体分散体(RSD),考察其对高脂血症模型大鼠血脂的影响。
1 材料
大黄酸(纯度>98%),南京泽朗医药科技有限公司;PVP,上海化学试剂公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、甘油三脂(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDLC)等试剂盒,南京建成生物工程研究所。
FTIR-8400S红外光谱仪(日本SHIMADZU公司);449C差示扫描量热仪(德国NETZSCH STA公司);TU-1800紫外可见分光光度计(北京普析通用公司)。
SPF级SD大鼠,雌雄各半,体重180~220 g,北京维通利华实验动物技术有限公司提供,许可证号:SCXK京2009-0004。SPF级环境下饲养,温度20~25℃,相对湿度45% ~70%,自然光照。
2 方法
2.1 RSD的制备
将大黄酸与PVP按质量比1∶4的比例放入烧杯中,加入适量无水乙醇,超声5 min使溶解,转移至旋转蒸发仪中,60℃除去乙醇即得RSD,粉碎,过筛备用[5]。
2.2 RSD的物相鉴定
2.2.1 RSD差热分析 采用差示扫描量热法(DSC)进行样品分析,测试条件为铝坩埚,气氛氮气,流速10 mL/min,升温速率10℃/min。由图1可见,大黄酸在305.2℃有一熔融吸热峰,而其物理混合物在433.9℃有一吸热峰。RSD在439.2℃有一吸热峰,固体分散体中大黄酸305.2℃熔融吸热峰消失。初步推测大黄酸在载体中形成了共沉淀物。可能是由于PVP分子中的羰基与大黄酸分子中的羟基形成氢键,使大黄酸分子以无定形状态进入完全水溶的PVP大分子,从而抑制难溶药物分子的结晶的生成和成长,药物形成过饱和状态,这就大大提高难溶药物的溶解度[6]。
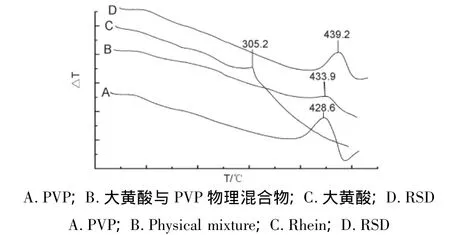
图1 样品的DSC图Fig.1 DSC curves of samples
2.2.2 RSD红外光谱分析 采用溴化钾压片法进行红外光谱分析。由图2可见,大黄酸的羟基峰位在3 320 cm-1,羰基峰位在1 640 cm-1;RSD羟基峰位在3 360~3 320 cm-1为一钝峰,羰基峰位在1 680 cm-1。物理混合物羰基峰位1 640 cm-1,两者比较大黄酸在RSD中的羟基峰和羰基峰均向高波数端移动,由此推测,大黄酸两羟基与载体PVP的C=O之间发生了氢键相互作用,使吸收峰向高波数位移。
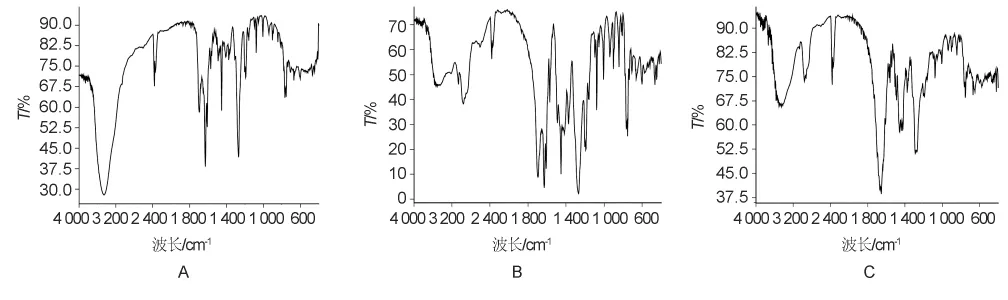
图2 大黄酸(A)、大黄酸与PVP(B)、RSD(C)的红外光谱图Fig.2 FTIR spectra of rhein(A),physical mixture(B)and solid dispersion(C)
2.3 脂肪乳剂的制备
取猪油30 g,胆固醇10 g,加热融化,加吐温80 10 mL,搅拌均匀,得油相。另取胆酸钠2 g和丙硫氧嘧啶0.1 g,加入 1,2-丙二醇10 mL,加热融化,加入水38 mL,搅拌均匀,得水相。将水相倒入油相中,搅拌,即成脂肪乳剂[7],用时加热融化。
2.4 动物分组与给药
大鼠40只,适应性饲养一周,随机分为5组:正常对照(CON)组、高脂血症模型(MOD)组、大黄酸(RH)组、RSD低剂量(RSDL)组、RSD高剂量(RSDH)组,每组8只。每天上午灌胃前后大鼠禁食禁水1 h,除CON组灌服水10 mL/kg外,其他各组均灌服脂肪乳剂10 mL/kg,连续8周。下午,RH组给予大黄酸25 mg/kg,RSDL组给予RSD 125 mg/kg(相当于大黄酸25 mg/kg)、RSDH组给予RSD 250 mg/kg。
2.5 标本采集
末次给药后,禁食不禁水12 h,大鼠用12%水合氯醛溶液以3 mL/kg腹腔注射麻醉,心脏取血,凝固后,3 000 r/min离心15 min,分离血清;摘取大鼠肝脏左叶,在冷生理盐水中漂洗后,剪取1 g置于匀浆器中,用生理盐水制成10%的组织匀浆,3 000 r/min离心后得肝组织匀浆。测定大鼠血清TG、TC、HDL-C、LDL-C含量,同时测定血清和肝匀浆中MDA含量、SOD和GSH-Px活力。
2.6 统计学分析数据
3 结果
3.1 对大鼠血脂指标的影响
与CON组相比,MOD组大鼠TC、TG、LDL-C值显著升高(P<0.05),而HDL-C值则显著降低(P<0.05),符合高脂血症的特征。各给药组与MOD组比较,TC、TG值均明显下降(P<0.05),RSDL和RSDH组下降的更为明显(P<0.05);三个给药组血清HDL-C含量与MOD相比均有上升。说明RSD对高脂血症大鼠有降血脂作用。
3.2 对大鼠抗氧化能力指标的影响
与CON组相比,MOD组大鼠血清及肝匀浆MDA含量显著上升(P<0.01),GSH-Px、SOD活力显著下降(P<0.01),表明在该高脂血症模型状态下,实验大鼠肝脏出现氧化损伤。与MOD组相比,RH、RSDL和RSDH组血清及肝脏MDA含量均降低,GSH-Px和SOD活力升高(P<0.05),说明RSD具有显著的抗氧化作用。
表1 大鼠TC、TG、HDL-C、LDL-C浓度(±s,n=8)Tab.1 The contents of TC、TG、HDL-C、LDL-C in rats(±s,n=8)
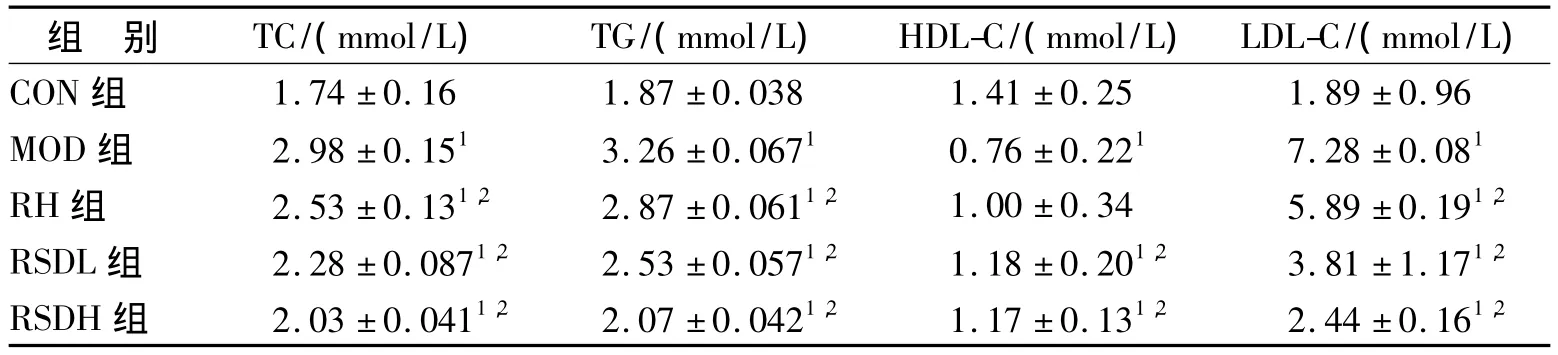
表1 大鼠TC、TG、HDL-C、LDL-C浓度(±s,n=8)Tab.1 The contents of TC、TG、HDL-C、LDL-C in rats(±s,n=8)
与CON组比较:1P<0.01;与MOD组比较:2P<0.05Compare with normal control groups:1P<0.01;Compare with mode groups:2P<0.05
组 别 TC/(mmol/L) TG/(mmol/L) HDL-C/(mmol/L) LDL-C/(mmol/L)CON组1.74±0.16 1.87±0.038 1.41±0.25 1.89±0.96 MOD组 2.98±0.151 3.26±0.0671 0.76±0.221 7.28±0.081 RH 组 2.53 ± 0.131,2 2.87 ± 0.0611,2 1.00 ± 0.34 5.89 ± 0.191,2 RSDL 组 2.28 ± 0.0871,2 2.53 ± 0.0571,2 1.18 ± 0.201,2 3.81 ± 1.171,2 RSDH 组 2.03 ± 0.0411,2 2.07 ± 0.0421,2 1.17 ± 0.131,2 2.44 ± 0.161,2
表2 大鼠血清和肝组织中SOD、GSH-Px和MDA水平(±s,n=8)Tab.2 The levels of SOD、GSH-Px and MDA in rats(±s,n=8)
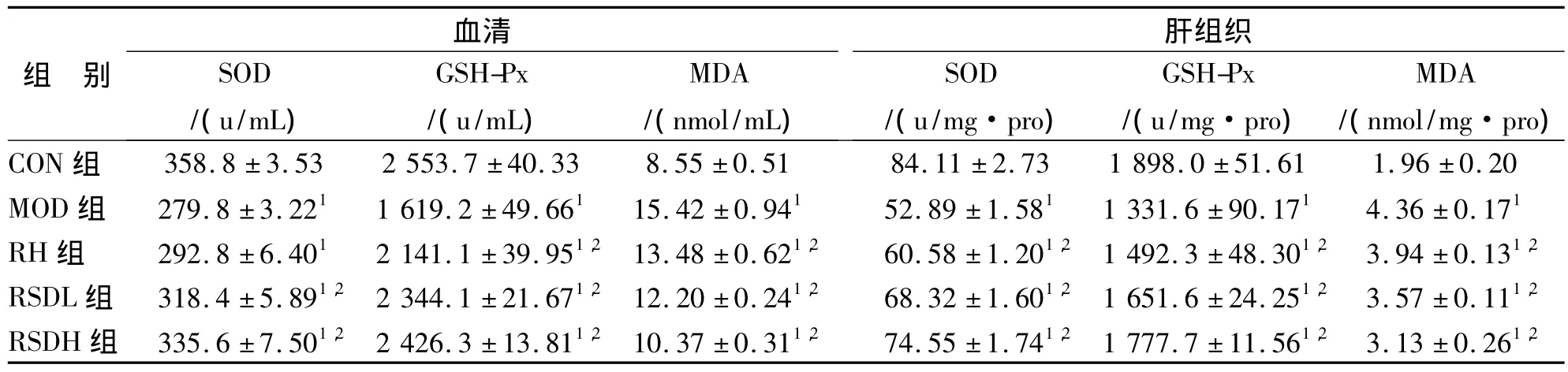
表2 大鼠血清和肝组织中SOD、GSH-Px和MDA水平(±s,n=8)Tab.2 The levels of SOD、GSH-Px and MDA in rats(±s,n=8)
与CON组比较:1P<0.01;与MOD组比较:2P<0.05Compare with normal control groups:1P<0.01;Compare with mode groups:2P<0.05
组 别血清SOD/(u/mL)GSH-Px/(u/mL)MDA/(nmol/mL)肝组织SOD/(u/mg·pro)GSH-Px/(u/mg·pro)MDA/(nmol/mg·pro)CON组 358.8±3.53 2 553.7±40.33 8.55±0.51 84.11±2.73 1 898.0±51.61 1.96±0.20 MOD组 279.8±3.221 1 619.2±49.661 15.42±0.941 52.89±1.581 1 331.6±90.171 4.36±0.171 RH 组 292.8 ± 6.401 2 141.1 ± 39.951,2 13.48 ± 0.621,2 60.58 ± 1.201,2 1 492.3 ± 48.301,2 3.94 ± 0.131,2 RSDL 组 318.4 ± 5.891,2 2 344.1 ± 21.671,2 12.20 ± 0.241,2 68.32 ± 1.601,2 1 651.6 ± 24.251,2 3.57 ± 0.111,2 RSDH 组 335.6 ± 7.501,2 2 426.3 ± 13.811,2 10.37 ± 0.311,2 74.55 ± 1.741,2 1 777.7 ± 11.561,2 3.13 ± 0.261,2
4 讨论
红外光谱分析和DSC分析表明,大黄酸与PVP形成共沉淀物,大黄酸以无定形状态分散于载体中,从而增加了大黄酸的溶解度和溶出度,提高了大黄酸的生物利用度,使得更多药物进入血液循环[8]。实验结果显示RSD能明显降低大鼠血清中TC、TG和LDL-C的含量,增加HDL-C含量,说明RSD能使大鼠血脂水平降低;RSDL和RSDH组可显著提高大鼠血清中GSH-Px、SOD活力,降低MDA水平,说明RSD具有抗氧化的作用,降低自由基的毒副作用,进而降低脂质过氧化作用对心血管的损伤。RSD对高脂血症模型大鼠有明显的降血脂及抗氧化作用。
[1] Saha S A,Arora R R.Hyperlipidaemia and cardiovascular desease[J].Curr Opin Lipidol,2011,23(4):278-284.
[2] 李 晓,冯 雷,胡尊丽.马齿苋多糖的抗氧化活性研究[J].中国生化药物杂志,2010,31(4):244-246.
[3] Zhao Y L,Shan L M,Zhou G D,et al.Rhein protects against acetaminophen-induced hepatic and renal toxicity[J].Food Chem Toxicol,2011,15(4):1124-1131.
[4] Vasconcelos T,Sarmento B,Costa P.Solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs[J].Drug Discov Today,2007,12(23):1068-1075.
[5] 韩 刚,阎林奇,索 炜,等.大黄素固体分散体的制备及体外溶出度测定[J].中草药,2011,42(3):487-490.
[6] 严瑞暄.水溶性高分子[M].北京:化学工业出版社,2001:633-642.
[7] 吕 萍,陈海峰,谭青霜,等.脂必妥对大鼠实验性高脂血症的作用[J].中国生化药物杂志,2007,28(4):275-276.
[8] Srinaronq P,Kouwen S,Visser M R,et al.Effect of drug-carrier interaction on the dissolution behavior of solid dispersion tablets[J].Pharm Dev Technol,2010,15(5):460-468.
