阿德福韦酯—海藻酸钠多壁碳纳米管复合物的体外缓释行为
2012-01-07万洪善
万洪善
(连云港职业技术学院,江苏 连云港 222006)
碳纳米管(carbon nanotubes,CNTs)由于其独特的物理和化学性能,受到了极大的关注。由于其中空结构,且本身为纳米结构,因此可载送生物活性分子及药物进入细胞或组织,而且在载送的过程中保护药物及分子免受破坏[1]。此外,经过功能化修饰的CNTs可改善其溶解性,对人体毒性小,并且有良好的生物相容性[2],可以共价或非共价结合并输送某些药物或分子,如小分子药物[3-4]、多肽[5]、蛋白质[6-7]、DNA[8-10]等,使 CNTs作为药物传送系统的运输载体得以应用[11]。实现药物控制释放是医药工作者长期以来追求的目标。随着医学科学和纳米科学研究的不断发展,纳米粒子载药体系正凭借其独特的优点,成为药物控制释放和靶向释放研究的主要方向[12-14]。
阿德福韦酯(Adefovir Dipivoxil,ADV)是一种抗乙型肝炎病毒(HBV)药物,属单磷酸腺苷磷酸核苷酸类似物。本文以此作为模型药物,以海藻酸钠(Alginate sodium,ALG)修饰的多壁碳纳米管(MWCNTs)(MWCNTs-ALG)作为药物载体,考察其体外释放性能,为进一步研究开发以CNTs作为药物载体的缓释制剂提供依据。
1 材料
MWCNTs(直径 10~20 nm,纯度≥95%,深圳纳米港有限公司);ADV(江苏正大天晴药业股份有限公司);ALG(连云港昌浩海藻助剂有限公司);其它试剂均为分析纯。
Nicolet5700型智能傅立叶红外光谱仪(美国尼高力公司);JEM-100CXⅡ透射电镜(日本电子株式会社);ASAP2020C全自动快速比表面积及孔隙度分析仪(美国麦克仪器公司);754紫外分光光度计(上海精密科学仪器有限公司);RC-8溶出度仪(天津天光光学仪器有限公司)。
2 方法
2.1 MWCNTs-ALG的制备
取硝酸15 mL、MWCNTs 200 mg置圆底烧瓶中,超声分散30 min后转入微波炉内,反应30 min。产物经洗涤和干燥后得氧化MWCNTs-COOH。
MWCNTs-COOH 150 mg与ALG 200 mg,同时滴加适量的催化剂碳化二亚胺(EDC),混匀后置微波炉内,辐射反应30 min,冷却后将所得物溶于2% 醋酸溶液形成悬浮液,离心后,所得固体用无水乙醇洗涤,并于70℃真空干燥12 h,得MWCNTs-ALG。
2.2 测试与表征
2.2.1 FTIR(傅利叶转换红外光谱) 采用红外光谱仪以溴化钾压片法测得。
2.2.2 复合膜的形貌分析 在透射电镜上完成。
2.2.3 比表面积和孔结构测定 使用全自动快速比表面积及孔隙度分析仪以BET法和BJH法测定。
2.3 ADV储备液的制备
精密称取ADV原料药150.0 mg于100 mL量瓶中,以95%乙醇溶解并稀释至刻度,得到浓度为1.5 mg/mL的储备液,备用。
2.4 复合物的制备
取ADV储备液50 mL,加入MWCNTs-ALG 2.0 g,超声处理30 min,室温下搅拌12 h,测定溶液中ADV浓度直至不再变化为止。抽滤水洗,室温真空干燥12 h,备用。计算该纳米管载药率为(142±5)%。载药前后MWCNTs-ALG的质量差为载药量,载药量与MWCNTs-ALG质量的比值即为载药率。
2.5 药物体外释放度实验
2.5.1 溶出介质的选择 ADV水中极难溶,不能达到漏槽条件,为了更好地释放,故需在介质中加入表面活性剂,根据溶解度测定结果,且参照美国药典30版,选择pH 6.8,含0.2%十二烷基硫酸钠磷酸盐缓冲液(SDS-PBS)为释放介质。
2.5.2 标准曲线的制备 分别取1.5 mg/mL ADV储备液 0.25,0.5,1.0,1.5,2.5 和 5.0 mL 置 50 mL量瓶中,加0.2%SDS-PBS稀释至刻度,测定254 nm波长处吸光度(A)值,以ADV溶液质量浓度(C)对A进行线性回归,得线性回归方程:C=16.920 A-0.113,r=0.999 9,在浓度 0.25 ~10.04 μg/mL 范围内线性关系良好。
2.5.3 体外释放度测定 取本品,采用转篮法,以0.2%SDS-PBS 1 000 mL为释放介质,在(37.0±0.5)℃,100 r/min(r=15 cm)条件下,依法操作,在不同时间分别取溶液5 mL滤过,并即时补加等量介质,以0.45 μm微孔滤膜过滤。照分光光度法(中国药典2010年版二部附录IVA)计算出ALG-MWCNTs-ADV在不同时间的累积释放度Q(%),绘制ALG-MWCNTs-ADV复合物的体外释放曲线。
2.5.4 释药过程的动力学方程拟合 将溶出结果用常见的释放动力学模型进行拟合,寻找描述药物释放的最佳模型。
3 结果与讨论
3.1 MWCNTs的表征
图1为ALG及MWCNTs-ALG的 FTIR谱图。在1 412 cm-1附近有梭基的伸缩振动,2 868 cm-1处的峰是由于C-H的伸缩振动。并且,在1 652 cm-1附近有强的由-HCO-伸缩振动产生的吸收峰。FTIR光谱表明MWCNTs上的-COOH与ALG上的-NH2反应生成了-NHCO-。
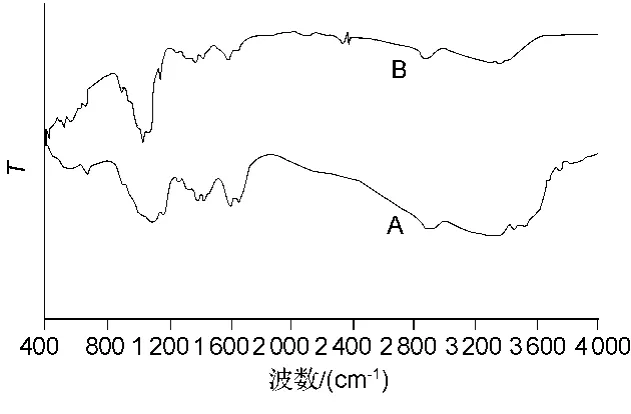
图1 ALG(A)和MWCNTs-ALG(B)的红外光谱图Fig.1 FTIR spectra of ALG(A)and MWCNTs-ALG(B)
通过透射电镜观察可知,未处理过的MWCNTs存在着较严重的缠结和团聚现象(图2a),而MWCNTs-ALG分散性明显提高,基本达到单根分散程度(图2b)。
MWCNTs和MWCNTs-ALG的孔径分布见图3。采用BJH法测定MWCNTs的孔径分布及孔容积。从图3中可以看出,MWCNTs的孔径主要集中在5~32 nm之间。经过修饰处理之后,孔径稍有变化,在13~32 nm之间的有所减少,而5~10 nm之间的却明显增加,但平均孔径MWCNTs-ALG仍大于MWCNTs。除此之外,MWCNTs-ALG孔容积也有一定程度增加。

图2 未处理的MWCNTs(a)和MWCNTs-ALG(b)的TEM照片Fig.2 TEM images of raw MWCNTs(a)and MWCNTs-ALG(b)
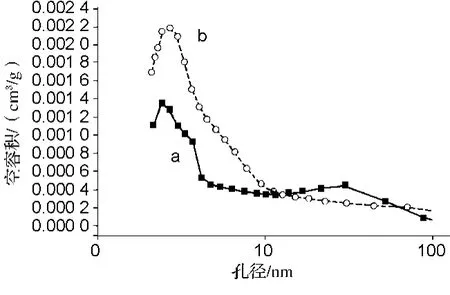
图3 MWCNTs(a)和MWCNTs-ALG(b)的孔径分布Fig.3 Pore diameter distribution of MWCNTs(a)and MWCNTs-ALG(b)
3.2 ALG-MWCNTs-ADV复合物的体外释放曲线
从图 4可见,ALG-MWCNTs-ADV复合物在0.2%SDS-PBS中的累积释放率为80.1%,释放持续约41 h。由于ADV与MWCNTs-ALG之间这种强烈的相互作用,使得部分非共价结合较牢固的ADV分子很难脱附下来;另外,在吸附过程中,MWCNTs一部分sp2电子转移到被吸附的ADV轨道上。由于ADV本身共轭程度较高,堆积作用强,提供给MWCNTs的sp2轨道较多,因此两者之间的吸附力较强,不容易脱附下来[15],从而使释放缓慢。
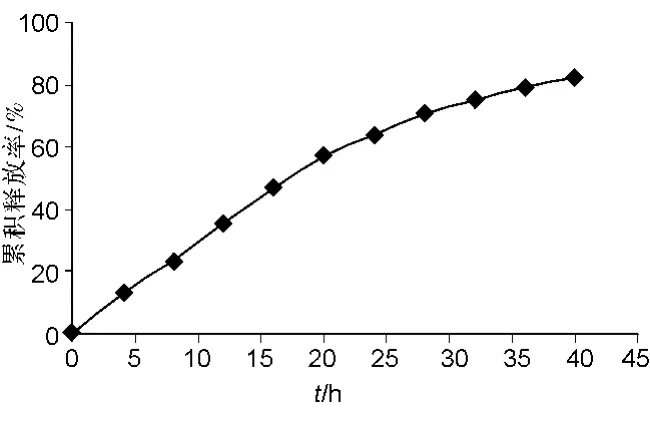
图4 ALG-MWNTs-ADV复合物的体外释放曲线Fig.4 Release curves of ALG-MWNTs-ADV
3.3 体外释放度模型拟合
见表1。各模型间释放度与时间均有较好的相关性,经Peppas方程拟合得时间项t的指数n=0.732 2,0.45 <n<0.89,且 Higuchi方程拟合仍有很好的线性关系;表明ALG-MWCNTs-ADV基本以恒定速率主动释放,受介质浓度影响较小,符合长效制剂要求。

表1 各模型拟合方程及拟合相似度数据Tab.1 Fitting of drug release data of optimized formulation according to various models
4 结论
MWCNTs经过ALG修饰后,团聚现象基本消失,长度变短,比表面积明显增大,孔径也相应增大,有利于对ADV的吸附。
MWCNTs-ALG作为载药载体,对 ADV的载药率为(142±5)%。体外释药试验表明,能使药物缓慢释放,释放时间达41 h,累积释放率达80.1%。同时,MWCNTs-ALG释药行为符合 Higuchi模型,基本以恒定的速率释放药物,符合长效制剂要求。
基于CNTs特殊的性能,CNTs在药物领域作为载体的研究将继续深入,并逐渐走向临床应用。探讨载药CNTs的释药机理,用于指导CNTs载体的实际应用,是今后的研究重点之一。
[1] Marc in het Panhuis.Vaccine delivery by carbon nanotubes[J].Chem Biol,2003,10(10):897-898.
[2] Sun Lan ,Zhang Yingge.The biocompatibility of carbon nanotubes[J].J Biomed Eng,2008,25(3):1034-1047.
[3] Kam N W S,O'Connell M,Wisdom J A,et al.Carbon nanotubes as multifunctional biological transporters and near infrared agents for selective cancer cell destruction[J].Proc Natl Acad Sci,2005,102(33):11600-11605.
[4] Wu W,Wieckowski S,Pastorin G,et al.Targeted delivery of amphotericin B to cells by using functionalized carbon nanotubes[J].Angew Chem(Int Ed Engl),2005,44(39):6358-6362.
[5] Kam N W S,Jessop T C,Wender P A,et al.Nanotube molecular transporters:Internalization of carbon nanotube protein conjugates in to mammalian cells[J].J Am Chem Soc,2004,126(22):6850-6851.
[6] Kam N W S,Dai H.Carbon nanotubes as intracellular protein transporters:Generality and biological functionality[J].J Am Chem Soc,2005,127(16):6021 6026.
[7] Bianco A.Carbon nanotubes for the delivery of therapeutic molecules[J].Expert Opin Drug Deliv,2004,1(1):57-65.
[8] Kam N W S,Liu Z,Dai H.Carbon nanotubes as intracellular transporters for proteins and DNA:an investigation of the uptake mechanism and pathway[J].Angew Chem(Int Ed Engl),2006,45(4):577-581.
[9] Singh R,Pantarotto D,Mccarthy D,et al.Binding and condensation of plasmid DNA on to functionalized carbon nanotubes:toward the construction of nanotube based gene delivery vectors[J].J Am Chem Soc,2005,127(12):4388-4396.
[10] Kamn W S,Liu Z,Dai H.Functionalization of carbon nanotubes via cleavable disulfide bonds for efficient intracellular delivery of s-RNA and potent gene silencing[J].J Am Chem Soc,2005,127(36):12492-12493.
[11] Alberto B.Carbon nanotubes for the delivery of therapeutic molecules[J].Expert Opin Drug Deliv,2004,11(1):57-65.
[12] Portney N G,Ozkan M.Nano-oncology:Drug delivery,imaging,and sensing[J].Anal Bioanal Chem,2006,384(3):620-630.
[13] Wang Y,Tang Z,Kotov N.Bioapplication of nanosemiconductors[J].Mater Today,2005,8(5):20-31.
[14] Rawat M,Singh D,Saraf S,et al.Nanocarriers:Promising vehiele for bioactive drugs[J].Biol Pharm Bull,2006,29(9):1790-1798.
[15]慕春海,李超鹏,韩 博,等.异甘草素-多壁碳纳米管复合物的体外缓释行为[J].中国药学杂志,2010,45(1):36-40.
