板栗中蛋白质的分离鉴定及活性研究
2012-01-07张太平张鹤云
李 艳,张太平,张鹤云
(南京大学 生命科学学院 医药生物技术国家重点实验室,江苏 南京 210093)
板栗(Castanea mollissima Blume)又名大栗(《浙江天目山药用植物志》)栗果(《滇南本草》)、栗实(《新修本草》)等[1]。具有一定的保健功能,本草纲目称栗果有“补肾益气,治腰,脚无力;内寒腹泄;活血化淤”等功效[2],中医上又把栗子称为“肾之果”。迄今为止国内外对板栗的研究多在化学成分的鉴定上,对其药理作用的研究少之又少,尤其是蛋白质的研究还未见报道。本实验对板栗中蛋白质的活性进行了研究,为板栗"补肾"提供科学数据,为板栗的深度开发利用提供参考。
1 材料
板栗,由河北省兴隆县提供。
DMEM(批号:NVH0303),赛默飞世尔生物化学制品(北京)有限公司;胰蛋白酶(批号:24301316),AMRESCO;四甲基偶氮唑盐(MTT),南京大冶生物科技有限公司;胎牛血清(FBS,批号:8131652),GIBCO;促肝细胞生长因子(HGF,批号:20100401),广东省药物研究所制药厂;寡聚原花色素(OPC),本实验室自山楂中提取。
肝癌细胞HepS细胞株由中科院上海药物研究所提供,江苏省肿瘤研究所培养传代,本实验室冻存;小鼠肉瘤S180腹水型肿瘤细胞为本实验室冻存。
清洁级昆明种小鼠,雌性,22~35 g,购于南京医科大学实验动物中心,合格证号:SCXK(苏)2008-0004。
KQ-250DE型数控超生波清洗器,昆山市超声仪器有限公司;UV-9100型紫外可见近红外分光光度计,北京瑞利分析仪器公司;DG5033A酶联免疫检测仪,南京华东电子集团医疗装备有限公司生产;CO2培养箱,Thermo Forma公司;DY-1001S型电泳仪,南京大学仪器厂;JD801凝胶电泳图像分析仪,南京捷达公司。
2 方法
2.1 板栗蛋白(CAS)的提取纯化
板栗破壳去皮,以料水比1∶4打碎,超声处理1 h后过滤,滤渣重复操作一次,两次滤液合并,经乙醇沉淀,弃上清,沉淀用水溶解后7 000 r/min离心10 min,留上清,重复离心3次,收集上清液,加入(NH4)2SO4沉淀蛋白质,充分沉淀后,沉淀物用7 000 r/min离心15 min,弃上清,沉淀用水溶解后装透析袋透析;收集透析内液,6 000 r/min离心10 min,收集上清,沉淀用水溶解后重复离心3次,合并上清液过大孔树脂,水洗脱,收集的流出液再上纤维素柱,分别用不同盐离子强度的0.01 mol/L磷酸盐缓冲液(pH 6.5,PBS)洗脱,收集蛋白质峰。
2.2 CAS的鉴定
提取得到的蛋白质样品进行聚丙烯酰胺凝胶垂直平板电泳[3]。
2.3 细胞体外增殖研究
2.3.1 CAS对正常小鼠肾细胞体外增殖的促进作用 无菌条件下,取正常小鼠肾脏于加有D-HK的培养皿中,剪碎,以1∶1比例加入胰蛋白酶,37℃消化30 min,DMEM终止消化,离心去红细胞,再用培养液离心(1 500 r/min,5 min)洗两次,用含有20%FBS的DMEM配制成肾细胞浓度为1×105/mL的细胞悬液,分别加入到2块96孔板中,每孔80 μL。每块板均设一个无细胞空白对照孔(加入DMEM 160 μL);DMEM阴性对照组和HGF阳性对照组(终浓度为 20 μg/mL)[4],每组 8 个复孔;CAS 组 5个浓度,终浓度分别为 1,5,10,20,40 μg/mL,每组16个复孔。培养板置于37℃,5%CO2培养箱中培养。培养24和48 h后各取一块板,加入5 mg/mL MTT溶液 100 μL/孔,继续培养,4 h 后加入 20%SDS溶液 40 μL/孔,次日用酶标仪测定570 nm波长处的吸光度(A)值。重复3次,每组的复孔取平均值。
2.3.2 CAS对肿瘤细胞的体外增殖的抑制作用
2.3.2.1 CAS对肝癌细胞HepS体外增殖的抑制作用 无菌条件下取接种7~10 d的HepS瘤源小鼠的腹水,DMEM离心(1 500 r/min,5 min)洗涤两次,用含20%FBS的DMEM配制成肝癌细胞HepS的浓度为1×106/mL的细胞悬液,分组及测定方法同2.3.1项,阳性对照组为OPC(终浓度为40 μL/mL)[5],CAS 组终浓度为 10,20,40,80,160 μg/mL。
2.3.2.2 CAS对小鼠肉瘤S180体外增殖的抑制作用 配制成小鼠肉瘤S180细胞悬液的浓度为1×105/mL,按2.3.2.1项下操作。
2.4 CAS对免疫细胞增殖的促进作用
2.4.1 CAS对T细胞增殖的促进作用 无菌条件下,取正常小鼠胸腺,碾碎,离心去红细胞,DMEM(1 500 r/min,5 min)离心洗两次,配制成T细胞浓度为5 ×106/mL,接种到 96 孔板,80 μL/孔,设置一个不加细胞的空白孔(加入DMEM 160 μL)。设5个浓度的CAS组,每组16个复孔,加入相应浓度的CAS 80 μL,终浓度分别为 5,10,20,40,80 μg/mL,另设DMEM阴性对照组,OPC阳性对照组(浓度为40 μg/mL)[5],各 8 个复孔。其余操作同 2.3.1 项。
2.4.2 CAS对B细胞增殖的促进作用 无菌条件下,取正常小鼠脾脏,按2.4.1项下方法操作,B细胞浓度为 5×106/mL,CAS组终浓度为 10,20,40,80,160 μg/mL。
2.5 DNA凝胶电泳法测定CAS对肝癌细胞HepS凋亡的影响
参照林科等[6]的方法进行。
3 结果与分析
3.1 CAS结构的鉴定
用含高盐离子强度的PBS洗脱时几乎没有蛋白质峰,故只将含有低盐离子强度的PBS洗脱的洗脱液经脱盐处理,浓缩得到CAS样品[7],占果实总质量的0.424%。
得到的CAS经聚丙烯酰胺凝胶垂直平板电泳,得到6条带,其中最下面的三条比较清楚(图1)并进行了结构分析,结果表明这三条带为同一种蛋白质,并确定为欧栗球蛋白,分子质量62 452,由542个氨基酸组成(图2)。

图1 聚丙烯酰胺凝胶垂直平板电泳Fig.1 Vertical slab polyacrylamide gel electrophoresis

图2 欧栗球蛋白分子结构Fig.2 Molecular structure of Castanin
3.2 CAS体外对肾细胞增殖的促进作用
CAS和HGF均有促进肾细胞增殖的作用,见表1。与DMEM组比较有显著差异,结果表明CAS在体外能够促进肾细胞的增殖。
表1 CAS对小鼠肾细胞体外增殖的影响(n=3,±s)Tab.1 Promotion of CAS on mouse renal cells proliferation(n=3,±s)

表1 CAS对小鼠肾细胞体外增殖的影响(n=3,±s)Tab.1 Promotion of CAS on mouse renal cells proliferation(n=3,±s)
与 DMEM 组比较:1P<0.05,2P<0.01,3P<0.001Compared with DMEM group:1P <0.05,2P <0.01,3P <0.001
组 别 浓度/(μg/mL)A 值24 h 48 h DMEM组0.113±0.061 0.149±0.049 HGF组 20 0.174±0.0541 0.211±0.0711 CAS组 1 0.249±0.0743 0.206±0.0901 5 0.164±0.0651 0.205±0.0771 10 0.172±0.0811 0.207±0.0791 20 0.182±0.0931 0.207±0.0841 40 0.207±0.1062 0.221±0.0891
3.3 CAS对肿瘤细胞增殖的抑制作用
CAS和OPC均能抑制肝癌细胞HepS和小鼠肉瘤细胞S180的增殖见表2~3。与DMEM组相比,有非常明显差异(P<0.01),在HepS中当CAS浓度达到20 μg/mL以及以上浓度时差异更加显著(P<0.001)。在S180细胞上这种差异表现的也是异常显著(P<0.001),结果表明 CAS对肝癌细胞HepS和小鼠肉瘤细胞S180的增殖有抑制作用。
表2 CAS对小鼠肝癌HepS细胞增殖的影响(n=3,±s)Tab.2 Inhabition of CAS on mouse hepatoma cell HepS proliferation(n=3,±s)

表2 CAS对小鼠肝癌HepS细胞增殖的影响(n=3,±s)Tab.2 Inhabition of CAS on mouse hepatoma cell HepS proliferation(n=3,±s)
与对照组比较:1P<0.01,2P<0.001Compared with DMEM group:1P <0.01,2P <0.001
组 别 浓度/(μg/mL)A 值24 h 48 h DMEM组0.687±0.056 0.528±0.043 OPC组 40 0.598±0.0562 0.490±0.0881 CAS组 10 0.536 ±0.0622 0.462±0.0611 20 0.495±0.0742 0.384±0.0962 40 0.429±0.0822 0.376±0.0432 80 0.382±0.0792 0.247±0.0612 160 0.394±0.0622 0.233±0.0812
表3 CAS对小鼠肉瘤S180腹水型肿瘤细胞增殖的影响(n=3,±s)Tab.3 Inhibition of CAS on proliferation of S180 mouse sarcomaasides tumor cells(n=3,±s)
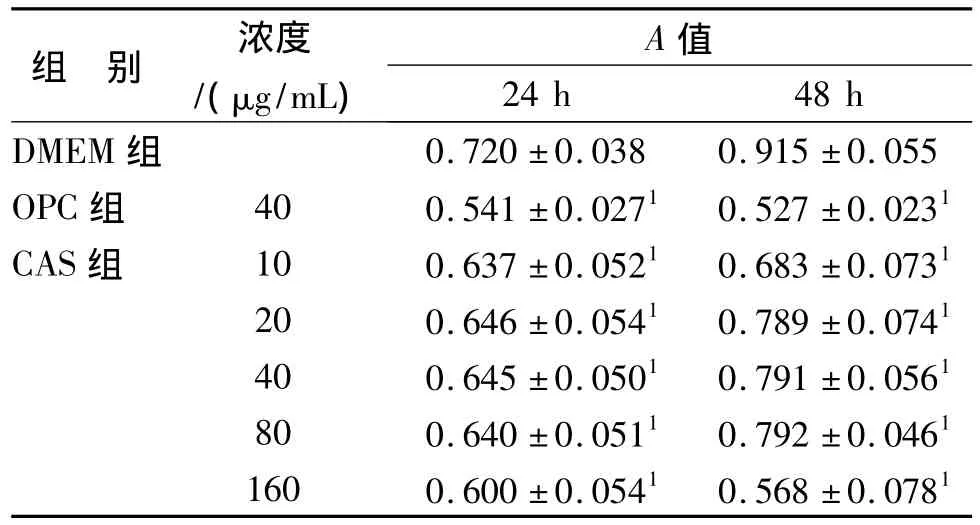
表3 CAS对小鼠肉瘤S180腹水型肿瘤细胞增殖的影响(n=3,±s)Tab.3 Inhibition of CAS on proliferation of S180 mouse sarcomaasides tumor cells(n=3,±s)
与对照组比较:1P<0.001Compared with DMEM group:1P<0.001
组 别 浓度/(μg/mL)A 值24 h 48 h DMEM组0.720±0.038 0.915±0.055 OPC组 40 0.541±0.0271 0.527±0.0231 CAS组 10 0.637±0.0521 0.683±0.0731 20 0.646±0.0541 0.789±0.0741 40 0.645±0.0501 0.791±0.0561 80 0.640±0.0511 0.792±0.0461 160 0.600±0.0541 0.568±0.0781
3.4 CAS对免疫细胞体外增殖作用的影响
CAS和OPC在体外对免疫细胞的增殖有促进作用,见表4~5。结果表明,与DMEM组相比,CAS对免疫细胞的增殖有较显著的促进作用。
3.5 DNA凝胶电泳法测定CAS对肝癌细胞HepS凋亡的影响
实验结果表明(图3),160 μg/mL没有小分子质量的DNA片段,显示大部分细胞已死亡;其他5组与空白对照组相比,有较多的小分子DNA条带且形成“Ladder”,大分子质量较少,说明细胞内的大部分DNA已降解成分子质量为核小体整数倍的DNA梯形片段,而对照组主要为大分子DNA。结果表明4个剂量的CAS及阳性对照OPC对肝癌细胞HepS的凋亡有显著促进作用。
表4 CAS对小鼠T细胞体外增殖的影响(n=3,±s)Tab.4 Effect of CAS on mouse thymus cells proliferation(n=3,±s)
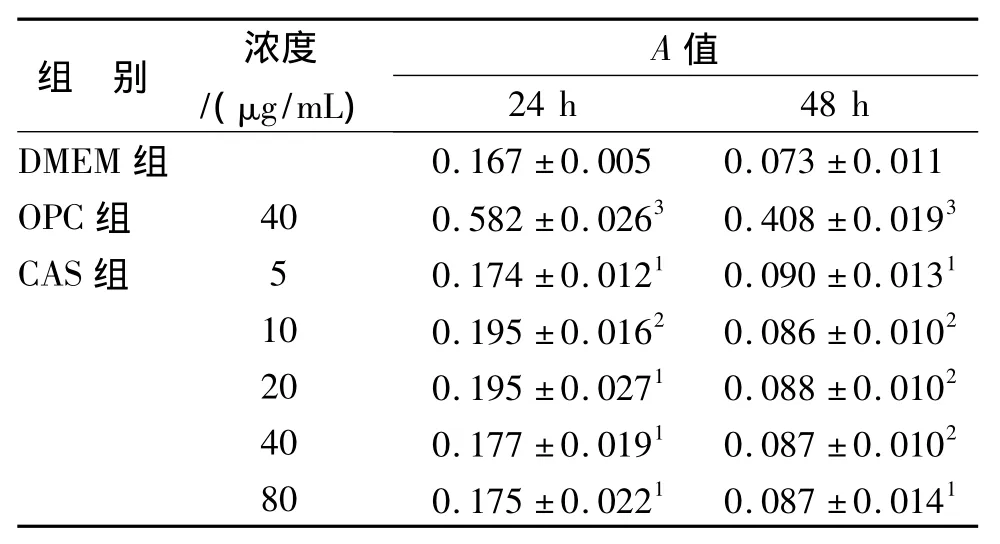
表4 CAS对小鼠T细胞体外增殖的影响(n=3,±s)Tab.4 Effect of CAS on mouse thymus cells proliferation(n=3,±s)
与对照组比较:1P<0.05,2P<0.01,3P<0.001Compared with DMEM group:1P <0.05,2P <0.01,3P<0.001
组 别 浓度/(μg/mL)A 值24 h 48 h DMEM组0.167±0.005 0.073±0.011 OPC组 40 0.582±0.0263 0.408±0.0193 CAS组 5 0.174±0.0121 0.090±0.0131 10 0.195±0.0162 0.086±0.0102 20 0.195±0.0271 0.088±0.0102 40 0.177±0.0191 0.087±0.0102 80 0.175±0.0221 0.087±0.0141
表5 CAS对小鼠B细胞体外增殖的影响(n=3,±s)Tab.5 Effect of CAS on mouse spleen cells proliferation(n=3,±s)

表5 CAS对小鼠B细胞体外增殖的影响(n=3,±s)Tab.5 Effect of CAS on mouse spleen cells proliferation(n=3,±s)
与对照组比较:1P<0.05,2P<0.01,3P<0.001Compared with DMEM group:1P <0.05,2P <0.01,3P<0.001
组 别 浓度/(μg/mL)A 值24 h 48 h DMEM组0.315±0.085 0.363±0.025 OPC组 40 0.737±0.0633 0.685±0.0503 CAS组 10 0.358±0.0901 0.454±0.0533 20 0.382±0.1111 0.503±0.0303 40 0.400±0.1142 0.567±0.0433 80 0.395±0.1282 0.679±0.0533 160 0.318±0.177 0.617±0.0483

图3 DNA凝胶电泳Fig.3 Map of DNA agarose gel electrophoresis
4 讨论
CAS经聚丙烯酰胺凝胶垂直平板电泳后,出现6条带,而后三条带着色深且带宽,说明在板栗蛋白溶液中该类蛋白的含量占绝大部分,是发挥作用的主要蛋白质,之后的结构分析证明,这三条带均为同一种蛋白质,这可能是由于电泳时使用β-巯基乙醇加热处理样品而造成亚基断裂使蛋白处于还原状态所致。
体外实验表明,板栗蛋白对肾脏细胞的增殖有明显的促进作用,其是否预示该蛋白对体内肾脏器官也能起到保护作用,其体内实验以及作用机制还有待进一步研究。
CAS对HepS,S180的增殖有显著的抑制作用。DNA凝胶电泳的结果表明,CAS抑制HepS细胞增殖的机制可能是,在低浓度时引起细胞凋亡,高浓度时直接产生细胞毒作用造成细胞死亡。实验说明CAS在体外具有显著的抗肿瘤活性,其可能机制是通过引起细胞凋亡而产生作用。
CAS对免疫细胞的增殖有明显的促进作用,这一结果是否也预告我们,该蛋白在体内具有增强机体免疫功能的作用,还有待我们下一步实验来证实。
本实验只是初步研究,需要进一步探究CAS抗肿瘤的作用靶点,以及是否对免疫器官也发挥作用,为合理、深入开发利用板栗蛋白提供科学依据。
[1] 中华本草编辑委员会.中华本草:第二卷[M].上海:科学技术出版社,1999:419-421.
[2] 齐 敏,岳崇峰.板栗的药用价值及开发利用[J].中国林副特产,1997(3):51-52.
[3] 陈均辉,李 俊,张太平,等.生物化学实验[M].4版.北京:科学出版社,2008:122-125.
[4] 王华利,赵 伟,杨永峰.促肝细胞生长素对体外培养成人肝细胞增值和细胞周期的影响[J].江苏医药,2009,3(35):327-328.
[5] 彭晓光,张太平,彭士明,等.原花色素对HepS细胞增值抑制诱导凋亡的研究[J].天然产物研究与开发,2007,19:234-235.
[6] 林 科,张太平,张鹤云.山楂中熊果酸的提取及其对小鼠的降血脂作用[J].天然产物研究与开发,2007,28:308-311.
[7] 常学东,朱京涛,舒 媛,等.板栗水溶性蛋白质提取工艺的优化[J].食品科学,2004,25:142-143.
