FKHRL-1基因转染对血管损伤后平滑肌细胞增殖能力的影响
2012-01-06蔡文玮上海交通大学医学院附属第九人民医院老年病科上海200011
孙 贇 蔡文玮 胡 萍 (上海交通大学医学院附属第九人民医院老年病科,上海 200011)
经皮冠状动脉腔内成形术(PTCA)术广泛开展的重要因素之一〔1〕,尤其是许多亚组患者,如糖尿病或小血管弥漫性病变,发生率更高。血管平滑肌细胞(VSMC)过度增生所致的新生内膜增厚,是造成PTCA术后血管再狭窄的主要原因〔2〕。Forkhead家族具有一个高度保守的DNA结构域,自1989年首次被发现以来,这一新兴的转录因子家族已经有了19个亚家族,表现出生物活性的高度多样性,其家族成员FKHRL-1(FoxO3a),更是广泛表达于多个组织器官中,在细胞发育、代谢、凋亡及癌变过程中起着关键性的调控作用。本研究探讨FKHRL-1基因转染对VSMC增殖能力的影响,为基因治疗PTCA术后再狭窄在实际中的应用提供一种可行的途径。
1 材料与方法
1.1 动物与分组 清洁级SD大鼠(上海斯莱克实验动物有限公司),雄性,体质量280~320 g;动物生产许可证号为SCXK(沪)2007-2005,使用许可证号为SYXK(沪)2007-2007。其中,先取21只SD大鼠分成对照组(C1组,n=3)和球囊损伤组(S组,n=18),其中球囊损伤组又分为:损伤后0.5 h(S1组,n=3)、1 h(S2 组,n=3)、2 h(S3 组,n=3)、3 h(S4 组,n=3)、6 h(S5组,n=3)和12 h(S6组,n=3)。再取15只SD大鼠,完成颈总动脉球囊损伤建模后、以损伤后2 h为时间截点,随机分为3组:正常对照组(C2组,n=5)、空白对照组(N组,n=5)和体外转染组(T组,n=5)。
1.2 主要仪器与试剂 2F动脉取血栓导管(120602F,爱德华生命科学有限公司);DMEM培养液(Hyclone);0.25%胰蛋白酶-EDTA(Gibco);胎牛血清(Hyclone);二甲基亚砜(DMSO)、MTT(Sigma);FoxO3a抗体、p-FoxO3a抗体、HA-Tag兔抗单克隆抗体(CST);PCR引物(上海英维捷基贸易有限公司);质粒HA-FoxO3a TM(Addgene、质粒号1788)(图1);QIAGEN plasmid mini kit(Qiagen、货号12125);脂质体LipofectAMINETM2000由上海交通大学附属第九人民医院组织工程重点实验室提供。
图1HA-FoxO3a TM质粒图谱
1.3 建立颈动脉球囊损伤模型 SD大鼠(按照0.3 ml/100 g体重腹腔内注射10%水合氯醛)麻醉后,将其固定于手术台上,常规消毒颈部皮肤、备皮、铺巾,取颈部正中切口,逐层分离软组织、暴露颈总动脉,用止血钳钝性分离左侧颈总动脉、左颈内、外动脉及迷走神经,颈总动脉近心端与颈内动脉分叉处远心端分别活结结扎,颈外动脉分叉处远心端死结结扎。用显微外科剪在颈外动脉分叉处与结扎处之间剪一“V”型切口,从左侧颈外动脉置入2F取栓导管至左侧颈总动脉结扎处,于球囊内注入0.9%生理盐水以扩张球囊,并向远心端牵拉导管以剥脱内膜,抽去生理盐水后送回颈总动脉内。重复上述操作3次后,退出导管,于颈外动脉分叉处和切口之间结扎,松开颈总动脉和颈内动脉的活结,待血供恢复后,逐层缝合伤口,继续以标准饲料按照清洁级动物饲养。
1.4 VSMC的培养和鉴定 取正常的和损伤后的颈总动脉血管组织,以组织块贴壁法培养VSMC,原代细胞用含10%胎牛血清的DMEM培养液培养,取第3代细胞用于实验。以免疫组织化学方法、采用来源于平滑肌细胞的特异性SMα-actin抗体,鉴定血管平滑肌细胞。
1.5 RT-PCR检测FKHRL-1 mRNA的表达 收集C1组和S组不同损伤时间点的VSMC,TRIzol试剂提取细胞总RNA,将逆转录产物cDNA进行Real-time PCR反应。PCR引物由上海英维捷基贸易有限公司合成,引物序列:5'-TGCTCACTTCGGACTCGC-3'(上游)、5'-GACATCATTGGGTCGTTGC-3'(下游),产物长度为136 bp。内参β-actin引物由上海交通大学附属第九人民医院组织工程国家重点实验室提供,产物长度为592 bp。RT-PCR反应条件:95℃预变性5 min、95℃变性30 s、56℃退火30 s、72℃延伸45 s、35个循环后延伸5 min。PCR产物经1.8%琼脂凝胶电泳2 h后,凝胶成像系统进行观察分析。1.6 Western印迹检测FKHRL-1总蛋白及其磷酸化蛋白的表达 取不同时间点VSMC,分别加入100 μl组织裂解液(Sigma)和3 μl蛋白酶抑制剂(PMSF)制成匀浆,提取蛋白并检测蛋白浓度。10%分离胶上样10 μl蛋白样品,80V电泳、继之400 mA转膜 2 h,5%TBST封闭过夜;一抗(FoxO3a抗体,1∶1 000;p-FoxO3a 抗体,1∶800)过夜,洗涤后加二抗(1∶2 000);曝光、显影。
1.7 VSMC的转染①取球囊损伤后2 h的第3代VSMC,于转染前24小时胰酶消化制成细胞悬液、接种于6孔细胞培养板上(每孔含1×105/2 ml细胞悬液);细胞分三组(6孔板,每组样本n=3),C2组(损伤后VSMC不予干预,未转染质粒)、N组(阴性转染质粒 pECE-GFP(-)、T组(转染质粒 HA-FoxO3a TM)。②首先使用Lipofectmaine2000脂质体分别对质粒pECEGFP(-)和质粒 HA-FoxO3a TM进行包裹,充分混匀、静置20 min以便形成复合物,后分别加入N组和T组细胞中、转染VSMCs;待6孔板中溶液分布均匀,将细胞重新放回恒温培养箱内培养;倒置显微镜下观察,若VSMC内出现脂质体空泡,说明转染完成。③转染后24 h,荧光倒置显微镜下观察转染效率,并对细胞进行换液(DMEM+10%FBS)、继续培养;转染后48 h,荧光倒置显微镜下观察转染效率。Western印迹检测转染后VSMC中质粒蛋白的表达 取转染后各组的VSMC,具体步骤同前,一抗(HA-Tag,1∶1 000)、二抗(1∶2 000)。
1.8 MTT法检测转染后细胞的增殖能力 取转染后C2组、N组和T组的损伤后VSMC,于培养后5 d内每日检测VSMC的增殖能力,每个时间点设4个复空。吸弃原培养液,每孔加入5 mg/ml的MTT工作液20 μl,置于培养箱内孵育4 h后,小心吸尽上清液,加入150 μl DMSO,振荡10 min以溶解结晶。以酶标仪测定在570 nm波长的光密度(以无细胞生长的培养液作为调零)。
1.9 统计学处理 采用SPSS16.0软件进行统计学分析,计量资料用x±s表示,组间比较采用t检验。
2结果
2.1 VSMC的鉴定及FKHRL-1 mRNA的表达 经来源于平滑肌细胞的特异性 SMα-actin鉴定,明确为 VSMC(图2)。RTPCR 检测结果显示,在 C1、S1、S2、S3、S4、S5、S6 组中均可见FKHRL-1 mRNA的表达,约136 bp(图3)。
图2 VSMC鉴定(×100)
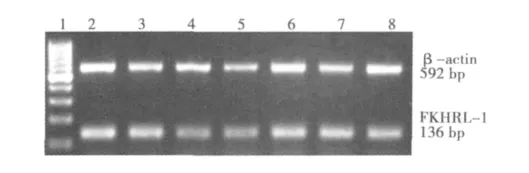
图3RT-PCR检测VSMC中FKHRL-1 mRNA的表达
2.2 VSMC FKHRL-1总蛋白及其磷酸化蛋白的表达水平
Western印迹检测结果显示,在 C1、S1~6各组中均可见FKHRL-1总蛋白表达,且S3组可见FKHRL-1磷酸化蛋白的明显表达。其中,各S组与C1组在FKHRL-1总蛋白表达水平上比较无统计学意义(P>0.05);在各S组中,损伤后S1组和S2组中FKHRL-1磷酸化蛋白的表达呈现上升趋势,直至S3组(损伤后2 h)可见FKHRL-1磷酸化蛋白表达达到高峰,与其他组比较差异均有统计学意义(P<0.01),而在S4组、S5组中FKHRL-1磷酸化蛋白水平呈逐渐下降趋势,至S6组中磷酸化蛋白则呈低表达见图4,表1。
2.3 VSMC转染效果检测
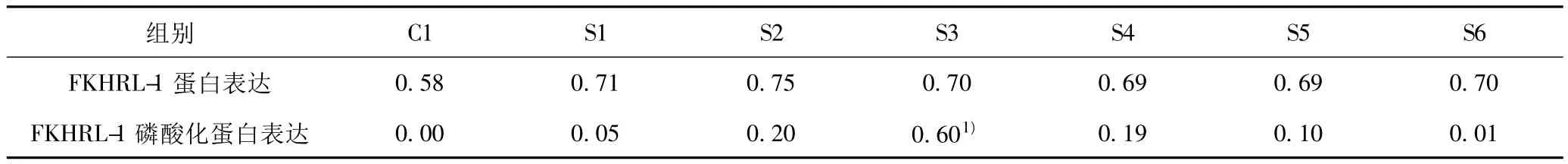
表1 Western印迹检测VSMC中FKHRL-1总蛋白及磷酸化蛋白的表达
2.3.1 荧光倒置显微镜下观察 转染后N组中VSMC生长形态良好,细胞内可见绿色荧光分布,且随着转染后细胞培养时间的延长,绿色荧光分布逐渐密集,证明携带有基因GFP的空载质粒成功转染入VSMC内,并表达绿色荧光蛋白(图5)。
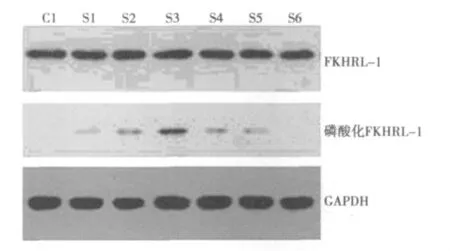
图4Western印迹检测VSMC FKHRL-1总蛋白及磷酸化蛋白的表达
图5 空白对照组转染后VSMC形态(×200)
2.3.2 转染后VSMC中质粒蛋白的表达水平 在正常对照组(C2组,0.002)和空白对照组 (N组,0.004)的VSMC中,质粒HA-FoxO3a TM的标记蛋白HA-Tag呈现极低表达;而在体外转染组 (T组,0.642)中,可见标记蛋白HA明显表达增强,与C组、N组之间存在显著性差异 (P<0.01),提示脂质体成功将带有HA-FoxO3a TM基因片段的质粒转染入VSMC中(图6)。
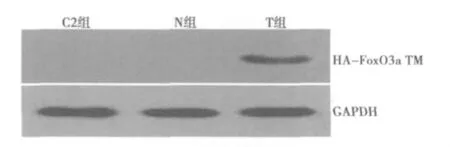
图6 转染后质粒蛋白的表达
2.3.3 FKHRL-1转染对VSMC增殖能力的影响 应用MTT法比较各组间VSMC的增殖能力,与正常对照组(C2组)相比,体外转染组(T组)VSMC的OD值明显降低,提示转染前后VSMC增殖能力的变化差异具有统计学意义(P<0.01);而空白对照组(N组)与正常对照组(C2组)之间,VSMC的增殖能力比较没有统计学意义,见表2。
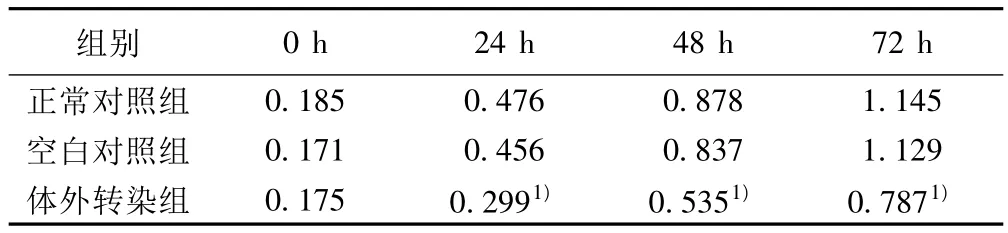
表2 各组间VSMC增殖能力比较
3讨论
随着对再狭窄分子生物学机制的认识与研究的深入,以及分子生物学技术的发展,越来越多的转录调节基因被发现参与到VSMC的增殖过程中。通过阻断上述基因的表达以抑制VSMC的增殖、减轻内膜的增生〔3〕,成为了未来解决再狭窄问题的突破点之一。
所谓基因治疗,就是应用基因工程和细胞生物学技术,将功能正常的基因转移到靶细胞中,通过导入的基因表达,使得靶细胞获得特定的功能、补充丢失或缺失的正常功能蛋白质、或者抑制体内基因的过盛表达,从而达到治疗目的。传统意义上的基因治疗是指外源基因导入受体细胞后,与细胞染色体基因组发生整合,成为宿主细胞遗传物质的一部分,外源基因表达产物起到对疾病的防治作用。近年来,随着基因转移技术的发展,外源基因导入后并不发生整合,而在染色体外表达基因产物,或者仅仅导入反义核苷酸抑制特定基因的表达,同样能发挥治疗效果。
基因治疗的关键和基础就是基因转染,使其能够安全、真实、长效地表达。通常基因转染的载体可分为两大类:病毒载体和非病毒载体。腺病毒载体由于其转染能力强曾被广泛应用,但由于转染时可以复原为致病性的野生型腺病毒、具有细胞毒性和免疫原性,实际应用受到许多限制〔4〕。非病毒载体,如阳离子脂质体、阳离子类脂质体和聚合物等,具有许多优势,如价格低廉、无致炎性和免疫原性、良好的生物相容性、安全性高、重复性好。近年来研发的阳离子脂质体(如本实验选用的Lipofectamin 2000),对基因片段代谢大小限制较少、转染过程相对无害,当它与质粒DNA混合后即可自动形成包裹DNA的脂质体颗粒,通过细胞内吞作用转移至细胞内。本实验选择上述阳离子脂质体为载体,将目的基因(HA-FoxO3a TM)转染至体外培养的球囊损伤后VSMC中。转染治疗后通过Western印迹法检测质粒DNA标记蛋白的表达,以及荧光显微镜下观察到阴性转染后VSMC内的大量绿色荧光分布、而正常对照组中均未见绿色荧光分布和蛋白表达,提示脂质体包裹质粒的转染方式成功。
研究证实〔5〕,FKHRL-1可使细胞周期停滞在G1-S和G2-M期“限制点”,抑制细胞生长,具有上游调控作用并且在分化晚期调控基因表达,还可使细胞对凋亡刺激敏感性增强。同时人们提出,FKHRL-1的上游活性通路是一个磷酸化与乙酰化的双重调节机制。目前认为,FKHRL-1的磷酸化修饰是该转录因子最常见、最重要的上游调控通路,哺乳动物体内存在着多条信号通路共同发挥着上述作用,促使FKHRL-1磷酸化而发生核排斥、滞留于细胞质中,从而活性受到抑制。我们在前期的研究中也发现〔6〕,血管损伤后,血管平滑肌细胞内FKHRL-1快速发生磷酸化且持续时间短,磷酸化的高峰在损伤后12 h内出现,并伴随血管平滑肌细胞增殖能力的显著升高。
本实验结果一方面提示非磷酸化FKHRL-1的含量升高可能在抑制VSMC增殖过程中发挥作用;另一方面也提示通过基因转染方式抑制血管损伤后修复过程的可行性。
1 Schartl M,Bocksch W,Koschyk DH,et al.Use of intravascular ultrasound to compare effects of different strategies of lipid-lowering therapy on plaque volume and composition in patients with coronary artery disease〔J〕.Circulation,2001;104(4):387-92.
2 Horlitz M,Sigwart U,Niebauer J.Fighting restenosis after coronary angioplasty:contemporary and future treatment options〔J〕.Int J Cardiol,2002;83(3):199-205.
3 Guard N,Mangement C,Bertrand P,et al.Ilyaluneetines secretion by monocytes:downregulation by IL-13 upregulation by IL-10〔J〕.Cytokine,1999;11(4):579-84.
4 Verma IM,Somia N.Gene therapy-promises,problems and prospects〔J〕.Nature,1997;389(6648):239-42.
5 Jacobs FM,van der Heide LP,Wijchers PJ,et al.FoxO6,a novel member of the FoxO class of transcription factors with distinct shuttling dynamics〔J〕.Biol Chem,2003;278(38):35959-67.
6 孙 贇,盛 净,胡 萍,等.转录因子FoxO3a磷酸化对血管平滑肌细胞增殖能力的影响〔J〕.上海交通大学学报(医学版),2011;31(4):429-33.
