老年良性前列腺增生症并代谢综合征的临床相关性
2012-01-06周苏斌杨剑文卢启海
周 毅 周苏斌 王 伟 姚 远 杨剑文 卢启海
(广西医科大学附属柳州市人民医院泌尿外科,广西 柳州 545006)
良性前列腺增生症(BPH)与代谢综合征(MS)是老年男性的常见病,MS与BPH继发下尿路症状(LUTS)有一定的相关性〔1〕。2000年我国6城市BPH患病率调查报道,我国60岁及以上社区男性人群中患病率为43.68%〔2〕。BPH并MS的庞大人群以及高昂的医疗费用已经成为一种社会问题。本研究通过研究老年男性BPH患者各项代谢指标与BPH病程的相关性,进一步探讨MS与BPH发生发展的关系。
1 对象与方法
1.1 研究对象 2011年9月至2012年3月我院泌尿外科门诊及住院诊断为BPH患者158例,平均年龄(72.43±6.01)岁。入选标准根据2009年中华医学会泌尿外科学会BPH诊断指南,具有LUTS:①国际前列腺症状评分(IPSS)≥8分;②最大尿流率(Qmax)≤15 ml/s;③B超检查前列腺体积(PV)>20 ml;④排尿后直肠指检前列腺Ⅰ度以上(横径>3 cm)。MS诊断标准根据2007年《中国成人血脂异常防治指南》修订的组分量化指标〔3〕:腹型肥胖为腰围≥90 cm;甘油三酯(TG)≥1.7 mmol/L;高密度脂蛋白胆固醇(HDL-C)≤1.04 mmol/L;血压(BP)≥130/85 mmHg;空腹血糖(FPG)≥6.1 mmol/L及(或)餐后2 h血糖(2 h PG)≥7.8 mmol/L,或有糖尿病史。具有以上三项或三项以上者可诊断MS。排除标准:前列腺癌、尿道狭窄、膀胱颈挛缩、膀胱肿瘤、尿路感染、膀胱结石、其他膀胱疾患而影响正常的排尿功能者;病史或体征提示有神经系统疾病如脑卒中、帕金森病和神经源性膀胱,或者具有精神障碍不能配合者;合并有糖尿病、高脂血症、代谢综合征者;资料填写不完整或拒绝配合者。分为单纯BPH组(72例)和BPH合并MS组(86例)。依据体重指数(BMI)≥25 kg/m2为肥胖(90例),其中以腰围>90 cm属于腹型肥胖为标准,分非腹型肥胖组(36例)、腹型肥胖组(54例);依据舒张压(DBP)(85 mmHg)为界,分为舒张压(SBP)升高组(69例)、SBP正常组(89例);FPG≥6.1 mmol/L为异常,分为 FPG正常组(61例)、FPG异常组(97例)。
1.2 问卷调查 均测量腹围,计算BMI。问卷调查,包括IPSS评分、LUTS出现时间、是否有高血压病史、糖尿病病史、是否口服降压、降糖及降脂药物等。
1.3 BPH临床观察指标及生化代谢指标的测定 均接受经腹或直肠超声检查测定PV,测定值取2次平均值。PV=0.52×前后径×左右径×上下径(ml)。嘱患者排尿后在B超下测膀胱残余尿量(PVR),>50 ml为异常。Qmax测定,嘱患者憋尿,尿量在150~200 ml时进行检查。成年男性正常≥15 ml/s,<15 ml/s表示有梗阻存在。并行直肠指诊,尿常规检查。检查前1 d清淡饮食,禁食10 h以后,清晨空腹抽取静脉血检测TG、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、HDL-C、血常规、FPG、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)、肝功能、肾功能、前列腺特异性抗原(PSA),进食2 h后进行检测2 h PG。休息10 min后,应用血压计进行收缩压(SBP)和舒张压(DBP)测量。直肠指诊,尿常规检查,采用IPSS量表评估LUTS及出现时间。
1.4 统计学方法 采用SPSS18.0软件包,数据用x±s表示,组间差异采用t检验,相关分析采用Pearson法。
2结果
2.1 单纯BPH组与BPH合并MS组临床资料比较 单纯BPH 组与 BPH 合并 MS组的年龄、LDL-C、TC、SBP、IPSS、PSA、PVR、Qmax、LUTS出现时间水平差异均无统计学意义(P>0.05),而 BMI、腹围、TG、FPG、FINS、HDL-C、PV 水平差异显著(P<0.001),且DBP水平差异显著(P<0.05),见表1。
2.2 非腹型肥胖与腹型肥胖BPH患者前列腺增生相关指标比较 与非腹型肥胖BPH患者相比,腹型肥胖BPH患者的PV明显增大(P<0.001),见表2。
2.3 不同DBP水平BPH患者前列腺增生相关临床指标比较DBP升高BPH患者PV明显增大,差异有统计学意义(P<0.05),见表3。
2.4 不同FPG水平BPH患者前列腺增生相关指标比较 与FPG水平正常的BPH患者比较,FPG异常的BPH患者PV增大,IPSS分值升高(P<0.05),见表4。
2.5 PV与各代谢指标的相关性分析 Pearson相关分析发现PV 与 BMI、FPG、FINS、DBP呈正相关(P <0.05),与 HDL-C 呈负相关(P <0.05),与腰围、2 h PG、HbA1c、TG、TC、LDL-C、SBP无显著相关性(P>0.05),见表5。

表1 单纯BPH组与BPH合并MS组临床资料比较(x±s)
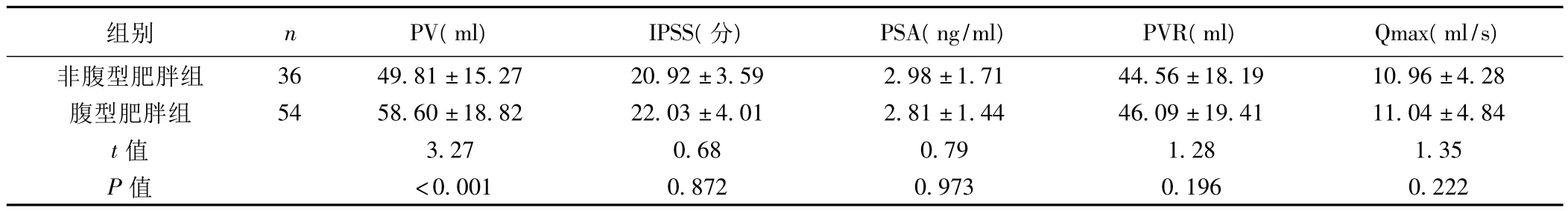
表2 非腹型肥胖与腹型肥胖BPH患者前列腺增生相关指标比较(x±s)

表3 不同DBP水平BPH患者前列腺增生相关指标比较(x±s)

表4 不同FPG水平BPH患者前列腺增生相关指标比较(x±s)
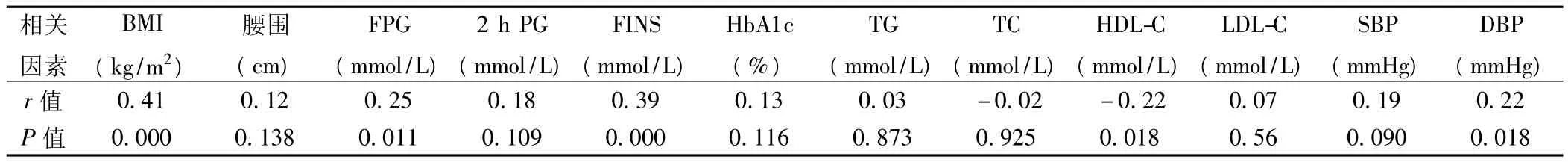
表5 PV与各代谢指标的相关性分析
3讨论
BPH主要表现为组织学上的前列腺间质和腺体成分的增生、解剖学上的前列腺增大(BPE)、LUTS为主的临床症状以及尿动力学上的膀胱出口梗阻(BOO)〔4〕。前列腺的组织学增生一般发生在40岁以后,60岁时的发生率高于50%,85岁后上升至90%,有组织学增生的患者中约50%伴随有中重度LUTS。MS是一组以肥胖、高血糖(糖尿病或糖调节受损)、血脂异常〔指高TG血症和(或)低HDL-C血症〕以及高血压等聚集发病,严重影响机体健康的临床征候群,是一组在代谢上相互关联的危险因素的组合。研究发现MS与年龄具有相关性,在60岁以上男性中发病率为56.7%〔5〕。近年来有研究证实了BPH与MS具有密切相关性〔6〕。BPH的确切病因及发病机制至今仍未完全阐明,比较公认的是年龄的增长和有功能睾丸的存在是其发病的主要因素。脂肪组织是一个活跃的内分泌器官,可分泌多种细胞因子,并可诱导T淋巴细胞移行至前列腺组织,增加至一定程度T淋巴细胞能杀死周围的前列腺组织细胞,从而导致前列腺组织代偿性纤维化增生。而且,腹部脂肪还是性激素转换的主要部位,腹型肥胖患者可影响雄激素与雌激素的转化过程,从而使雌激素浓度增加、睾酮浓度的减低〔7〕,最终使发生BPH的风险增加。Parsons等〔8〕研究证实,BMI与PV正相关,每增加1 kg/m2的BMI,PV值增加0.41 ml。与BMI<25 kg/m2者比较,肥胖组发生前列腺增大的概率明显增加(P=0.01)。本次研究说明肥胖以及腹部脂肪堆积是老年MS患者的一个重要组分。本研究显示,BMI与PV呈正相关,可考虑以减轻体重作为预防和治疗PV增大的手段之一。
高血压与BPH发病率均随年龄增加而增加〔9〕,最显著的特点是交感神经系统的过度活动在两者发病原因上的相关性。研究证实,长期的高血压状态可促进前列腺组织的血管新生,因此能促进PV增大。本次研究发现,SBP高的BPH患者PV增大,而DBP高的BPH患者PV无明显增大,相关性分析显示,DBP与PV呈正相关。有研究证实PV的增长率与DBP呈正相关〔10〕,尤其是高SBP状态对BPH的发生、发展起作用。
高血糖直接引起血管内皮损伤后修复减慢,胶原组织血中暴露时间延长,易于血小板黏附和聚集。使内皮源性血管舒张因子产生减少和活性降低,易于动脉粥样硬化的发生和发展。而动脉粥样硬化可通过减少骨盆血流,导致前列腺缺血,基质细胞增殖,从而促进了前列腺增生。有研究表明PV增长较快的BPH患者具有高的2型糖尿病发病率、FINS水平〔11〕。之后,Parsons等〔8〕还研究了FPG浓度、糖尿病及前列腺增生的关系,结果表明PV和糖尿病有正相关关系。FPG浓度越高,前列腺增大越明显。另外,FPG升高对于周围神经的损害常导致糖尿病患者发生糖尿病膀胱病变,表现为膀胱容量增加,逼尿肌收缩功能障碍从而出现排尿症状。FPG是BPH的一个促进因素,推测FPG升高导致的全身血管内皮受损、动脉粥样硬化可能是BPH患者病情发展的机制之一。Nandeesha等〔12〕与 Burke等〔13〕研究发现胰岛素是通过调节交感神经活性、性激素和胰岛素样生长因子(IGF)轴对BPH的发生起作用。同时,胰岛素抵抗通过对内皮功能的损害,加速动脉粥样硬化的进程。因此,合并胰岛素抵抗的人群往往存在肥胖、高血压、血糖异常,以上因素都已被认为是BPH的危险因素。
综上所述,MS各组分在BPH的起病及病程进展过程中可能通过多种机制起到促进作用,从而导致临床上的相关性。可以通过保持理想的体重、适当运动、改变饮食结构以减少热量摄入、戒烟和不过量饮酒等,从而减轻胰岛素抵抗、增加胰岛素的敏感性,并进行调节血脂、降低血糖和降低血压的综合防治措施以减少和延缓BPH发生和发展。
1 Kasturi S,Russell S,Mcvary KT.Metabolic syndrome and lower urinary tract symptoms secondary to benign prostatic hyperplasia〔J〕.Curr Urol Rep,2006;7(2):288-92.
2 于普林,郑 宏,苏鸿学,等.中国六城市老年人前列腺增生的患病率及相关因素〔J〕.中华流行病学杂志,2000;21(4):276-9.
3《中国成人血脂异常防治指南》制订联合委员会.中国成人血脂异常防治指南〔M〕.北京:人民卫生出版社,2007:16-7.
4 AUA Guidelines oil management of benign prostate hyperplasia.Chapter 1:diagnose and treatment recommendations〔J〕.J Urol,2003;170(3):530-47.
5 Bjorn Hildrum,Arnstein Mykletun,Torstein Hole,et al.Age specific prevalence of the metabolic syndrome defined by the International Diabetes Federation and the National Cholesterol Education Program the Norwegian HUNT 2 Study〔J〕.BMC Public Health,2007;7(2):220-3.
6 Ozden C,Ozdal OL,Urgancioglu G,et al.The correlation between metabolic syndrome and prostatic growth in patients with benign prostatic hyperplasia〔J〕.Eur Urol,2007;51(2):199-206.
7 Kristal AR,Amold KB,Schenk JM,et al.Race/ethnicity,obesity,health related behaviors and the risk of symptomatic benign prostatic hyperplasia:results from the prostate cancer prevention trial〔J〕.J Urol,2007;177:1395-400.
8 Parsons JK,Cater HB,Partin AW,et al.Metabolic factors associated with benign prostatic hyperplasia〔J〕.J Clin Endocrinol Metab,2006;91(7):2562-8.
9 Michel MC,Heemann U,Schumacher H,et al.Association of hypertension with symptoms of benign prostatichyperplasia〔J〕.J Urol,2004;172:1390-3.
10 Meigs JB,Mohr B,Barry MJ,et al.Risk factors for clinical benign prostatic hyperplasia in a community based population of healthy aging men〔J〕.Clin Epidemiol,2001;54:935-44.
11 Gupta A,Gupta S,Pavuk M,et al.Anthoropometric and metabolic factors and risk of benign prostat hyperplasic:a prospective cohort study of Air Force Veterans〔J〕.Urology,2006;68:1198-205.
12 Nandeesha H,Koner BC,Dorajan LN,et al.Hyperinsulinemia and dyslipidemia in non-diabetic benign prostatic hyperplasia〔J〕.Clin Chim Acta,2006;370(12):89-93.
13 Burke JP,Jacobson DJ,Mcgree ME,et al.Diabetes and benign prostatic hyperplasia progression in Olmsted county,Minnesota〔J〕.Urology,2006;67(1):22-5.
