肝水解肽的制备及相对分子质量分布研究
2012-01-06蒋桂香李延平刘中原吴科锋
蒋桂香,李延平,刘中原,吴科锋,刘 义,李 立
(1.广东双林生物制药有限公司 湛江市生物制药工程中心,广东 湛江 524005;2.广东医学院 广东天然药物研究与开发重点实验室,广东 湛江 524023)
肝水解肽的制备及相对分子质量分布研究
蒋桂香1,李延平2,刘中原2,吴科锋2,刘 义2,李 立2
(1.广东双林生物制药有限公司 湛江市生物制药工程中心,广东 湛江 524005;2.广东医学院 广东天然药物研究与开发重点实验室,广东 湛江 524023)
目的 研究肝水解肽的制备方法及相对分子质量(Mr)分布。方法 采用碱化-酶解法制备肝水解肽,采用高效液相色谱法测定肝水解肽的Mr。结果 采用碱化-酶解法制备肝水解肽收率稳定,优化的酶解法工艺参数为胰酶用量为0.5%、温度为55℃、pH为7.5、水解时间为6 h,在此条件下酶解多肽提取率平均为4.82%;肝水解肽Mr400~10 000的组分占73%左右。结论 碱化-酶解法制备肝水解肽工艺简便可靠,能保持大部分多肽结构。
肝水解肽;酶解;高效液相色谱法;相对分子质量;分布
肝水解肽(heparolysate)是由健康哺乳动物如牛、猪的肝脏经水解提取制得的活性混合物,含有多肽类、氨基酸类、核酸类等物质,能促进正常肝细胞的增殖和再生,对四氯化碳诱导的肝细胞损伤有较好的保护作用,能降低谷丙转氨酶,促进病变组织恢复,用于慢性肝炎、肝硬化等疾病的治疗[1-2]。肝水解肽与促肝细胞生长素的原料来源、成分相似,主要功能物质包括10~100个氨基酸的多肽、肝细胞刺激因子(HSS)、肝细胞生长因子(HGF)及多种游离氨基酸和微量元素[3]。生物技术的发展促进了大量肽类药物的出现,使得多肽的测定及鉴定技术日趋重要。对于多肽类物质相对分子量(Mr)分布及其测定有多种方法,如渗透压法、光散射法、SDS-聚丙烯酰胺凝胶电泳以及凝胶柱高效液相色谱法等。
肝水解肽是天然混合多肽,其活性很大程度上取决于其Mr的大小[4-5]。具有生理功能的调节因子都是Mr10 000以内的肽类,采用不同的制备技术以及控制酶解条件,能够获得Mr适中的多肽物质[6]。肝水解肽制备过程中,水解条件对于控制多肽Mr分布、保持多肽生物活性具有重要作用。本文以新鲜猪肝为原料,采用碱化-酶解法制备肝水解肽,优化了酶解法制备多肽的工艺参数,并用高效液相色谱法确定了肝水解肽的Mr分布。
1 材料
新鲜猪肝购自湛江某超市。选材标准:外形健康正常,颜色紫红,均匀有光泽,肝包膜平整光滑,肝实质均匀柔软,弹性好,切面整齐润滑,血管和肝小叶纹理清晰。
多肽对照品:细胞色素C(Mr12 000)、抑肽酶(Mr6 500)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Gly-Gly-Try-Arg,Mr451 000) 及乙氨酸-乙氨酸-乙氨酸(Gly-Gly-Gly,Mr189 000)购自 Sigma-Aldrich公司,纯度≥98%;Lowry法蛋白质定量试剂盒购自上海申能博彩生物科技有限公司;胰蛋白酶购自上海林叶生物有限公司。
Agilent 1200型高效液相色谱仪(包括G1311A四元泵,G1328B手动进样器,G1315B二极管阵列检测器,G1316A柱温箱),美国安捷伦科技公司;METTLER AE240型电子天平,梅特勒-托利多上海有限公司;Milli-Q超纯水仪,美国密理博科技公司。
2 方法
2.1 肝水解肽溶液的制备
采用碱化-酶解法。取猪肝100 g,用水冲洗干净,切成小片,放入粉碎机内绞碎;加水600 mL,缓缓搅动,待温度加热至指定温度;用NaOH溶液调pH,加入相应量的胰酶,在指定温度下水解,不断搅拌并保持pH;水解完毕,加HCl溶液调节pH至3.5~6.0,加热至85 ℃保持 30 min;冷却,4 000 r/min离心20 min,取上清,得到肝水解肽提取液。
2.2 含量测定
采用Lowry法。根据试剂盒说明书绘制蛋白含量标准曲线,将制备的肝水解肽适当稀释,用蛋白含量测定试剂盒测定提取溶液中的多肽含量。
2.3 M r分布测定
2.3.1 色谱条件 色谱柱为TSKgel G 3000S WXL(300 mm×650 mm),流动相为乙腈-水-冰乙酸(10∶90∶1),流速为 0.8 mL/min,二极管阵列检测器,检测波长为220 nm,柱温为35℃,进样量为20μL。
2.3.2 标准曲线 取4种已知Mr的多肽对照品,用0.05%叠氮化钠溶液制成0.5 mg/mL的溶液,进样20μL,记录色谱图,以对照品 Mr的对数(lg Mr)对保留时间(tR)线性回归,得标准曲线方程。
2.3.3 样品Mr分布 取肝水解肽供试品溶液,采用0.22μm滤膜过滤,取20μL进样,记录色谱图,把tR代入标准曲线,计算Mr。用峰面积归一法计算得出不同Mr范围的相对百分比。
3 结果
3.1 肝水解肽的制备工艺优化
根据预试验结果,酶解过程中,胰酶的用量(A)、酶解温度(B)、反应pH值(C)以及酶解时间(D)对于水解肽的含量有显著影响,因此设计上述4因素3水平的正交设计表,以水解肽的提取率为考察指标优化酶解过程,提取率(%)=制备液肝水解肽含量/原料猪肝重量×100%。正交设计表及结果见表1~2。

表1 正交试验因素水平表Tab.1 Factor and level of orthogonal test

表2 正交试验结果Tab.2 Results of orthogonal test
由表2极差分析可以看出,最佳条件是A3B2C1D2,即酶用量为0.5%、温度为55℃、pH 为7.5、水解时间为6 h时提取率最高。由极差分析可知,影响提取率的最主要因素是水解时间,其次是酶用量,再次是温度,影响最小的是pH。
3.2 肝水解肽含量测定
Lowry法测定蛋白含量标准曲线性方程为y=1.544 x -0.126,r=0.996 5。蛋白质含量在 0.025~0.5 mg/mL范围内线性良好,可用于测定提取液中多肽含量。
采用优化的工艺参数制备肝水解肽3批,详细操作为:取猪肝250 g,用水洗净,切成小片后绞碎;加水1 500 mL,缓缓搅动;加热到55℃左右,用NaOH溶液调pH至7.5;加入肝重量0.5%的胰酶,在55℃水解6 h,不断搅拌,保持 pH 7.5;水解完毕,加HCl溶液调节 pH至3.5,加热至85℃保持30 min;冷却,4 000 r/min 离心20 min,取上清,得到提取溶液;稀释20倍后,用Lowry法试剂盒测定提取液中的多肽含量,并计算提取率。结果见表3。可见,优化的碱化-酶解法提取多肽含量高,提取率稳定。

表3 优化工艺制备肝水解肽实验结果Tab.3 Results of the heparolysate preparation under optimum conditions
3.3 肝水解肽M r分布的测定
多肽对照品及肝水解肽样品色谱图见图1。Mr测定的标准曲线方程为:lg Mr=-0.210 6 tR+5.632 2,r=0.993 5。
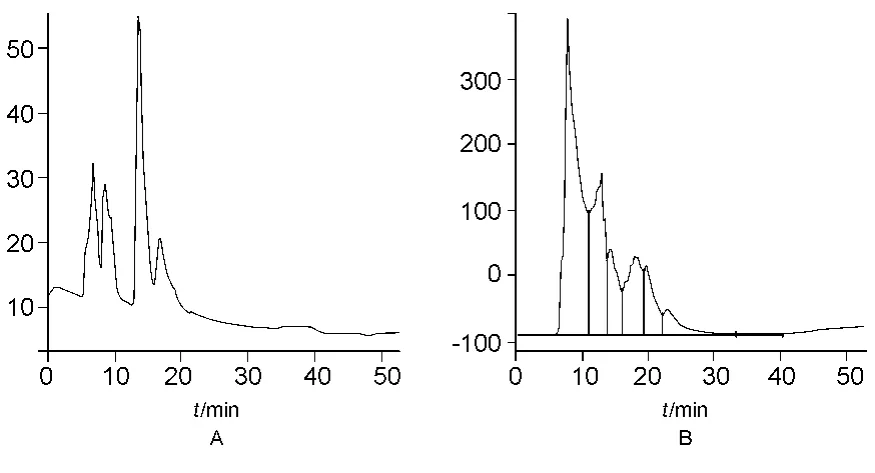
图1 多肽对照品(A)和肝水解肽供试品(B)的M r分布色谱图Fig.1 HPLC chromatograms of polypeptides references(A)and sample(B)
肝水解肽供试品溶液的Mr分布见表4。从表4可知Mr>400部分约占73%,<70部分约为22%,得出肝水解肽中Mr为 400~10 000的肽类约占73%。
4 讨论
通过技术手段如酶水解法或膜法提取技术所获得的肝源性(以猪、牛多见)生物活性肽具有免疫增强作用、促进肝脏再生作用、对肝损伤的保护作用、改善肝炎症状等多种重要生理功能[7]。
肝水解肽溶液制备没有统一的生产工艺,目前有厂家采用胃蛋白酶进行水解的工艺,水解速度慢,时间相对较长,夏季生产必须添加适量防腐剂,且水解后杂蛋白的去除率低,制成制剂后容易出现沉淀和白点现象[8]。本工艺采用胰酶,在碱化条件下酶解,制备的肝水解肽样品质量稳定可靠,Mr在400以上的肽约占73%,表明产品的主要成分是肽类。肽类是由多个氨基酸缩合而成,其Mr介于大分子蛋白质和小分子氨基酸之间。大分子蛋白质由于是人体异种蛋白,给药后易产生严重的抗原抗体反应,而小分子氨基酸缺乏特异的分子空间结构,不具备特殊的生理活性,给药后主要起到营养补充的作用。肝水解肽是天然混合多肽,其活性很大程度上取决于其Mr的大小。采用本工艺制备的肝水解肽含量高,在缩短制备周期的同时,确保产品的安全性及质量要求。
肝源性生物活性肽是一类Mr小、且具有多种重要生物学功能的肽类。目前,临床中治疗肝炎肝硬化只是利用了肝源性生物活性肽众多生物活性的一小部分,对其进一步深入开发极其必要[9-10]。由于生物活性肽为多肽,在某种程度上存在稳定性差、易被消化道中的酶所破坏等缺点,因此目前此类药物以注射剂型为主,不仅使用不便,而且有报道称此类制剂可引发严重过敏反应[11],在一定程度上限制了此类药物的发展;而新型口服给药技术的进步,如蛋白多肽的口服结肠靶向给药技术,可能为此类药物的应用打开更为广阔的前景。

表4 肝水解肽的M r分布Tab.4 Molecular weight distribution in sample
[1]李 勇.生物活性肽研究现状和进展[J].食品与发酵工业,2007,33(1):3-9.
[2]傅 颖,梅 松,王 茵.新生牛肝活性肽对小鼠的免疫增强作用[J].中国生物制品学杂志,2008,21(1):47-50.
[3]Fukuda Y,Sawata M,Washizuka M,et al.Effect of liver hydrolysate on hepatic proliferation in regenerating rat liver[J].Nippon Yakurigaku Zasshi,1999,114(4):233-238.
[4]Shimizu M,Tanabe S,Morimatsu F,et al.Consumption of pork-liver protein hydrolysate reduces body fat in Otsuka Long-Evans Tokushima fatty rats by suppressing hepatic lipogenesis[J].Biosci Biotechnol Biochem,2006,70(1):112-118.
[5]Kumar P,Mishra B.Colon targeted drug delivery systems-an over-view[J].Curr Drug Deliv,2008,5(3):186-198.
[6]李延平,刘 义,吴科锋,等.骨元肽结肠溶胶囊对去卵巢大鼠骨质疏松症的防治作用[J].中国药理学通报,2008,24(3):340-343.
[7]李 立,李延平,吕应年,等.动物肝源性活性肽研究、应用及展望[J].实用医学杂志,2011,27(12):2276-2277.
[8]王 广,吕高辉,沈新影,等.猪源、牛源肝水解肽的质量对比研究[J].中国生化药物杂志,2008,29(2):115-116.
[9]谷 征.肝水解肽治疗肝炎肝硬化疗效观察[J].临床和实验医学杂志,2007,6(5):85-86.
[10] Jung Y,Kim Y M.What should be considered on design of a colonspecific prodrug[J].Expert Opin Drug Deliv,2010,7(2):245-258.
[11]马清华,李小芳,牛风环,等.肝复肽静滴致严重过敏反应1例[J].山东医药,2002,42(22):21.
Study on preparation method and molecular weight distribution of polypeptide in heparolysate
JIANG Gui-xiang1,LI Yan-ping2,LIU Zhong-yuan2,WU Ke-feng2,LIU Yi2,LI Li2
(1.Guangdong Shuanglin Biopharmaceatical Co.,Ltd.,the Engineering Center of Zhanjiang Biopharmacy,Zhanjang 524005,China;2.Guangdong Medical College,Guangdong Key Laboratory for Research and Development of Natural Drugs,Zhanjiang 524023,China)
Purpose To study the preparation technique and to establish a method for determining the molecular weight(Mr)distribution of polypeptide in heparolysate.Methods The heparolysate was prepared by basification-enzymolysis method,and the Mrdistribution was determined by HPLC.Results The optimum preparation data were as follows,the dosage of pancreatin 0.5%,55 ℃,pH 7.5 and the time of enzymolysis 6 h.The average yield of heparolysate was 4.82%,in the Mrrange of 400-10 000 D.There was a good linear relationship between the logarithm of Mrof peptide and the retention time(r=0.993 5),and the peptides with Mr>400 D were about 73%in all the enzymolysis solutions.Conclusion The technique is simple and reproducible for the preparation of heparolysate.
heparolysate;enzymolysis;HPLC;molecular weight;distribution
TQ464.54
A
1005-1678(2012)05-0603-04
2011-09-20
东莞市高等院校科研机构和医疗卫生单位科技计划项目(2008108101059)
蒋桂香,女,制药工程师,主要从事生物制品质量控制工作;李 立,男,通信作者,博士,副研究员,主要从事天然药物及肿瘤分子病理研究,E-mail:LL524@yahoo.cn。
